名校
解题方法
1 . 如图是中学化学常见物质的转化关系,部分物质和反应条件略去。其中A是地壳中含量最多的金属元素的单质,B是一种红棕色粉末;通常情况下,乙为黄绿色气体单质,H是有刺激性气味的气体,在工业上可通过反应⑥在高温高压、催化剂条件下合成;J为难溶于水的红褐色固体;反应⑦在工业上可用于制作印刷电路板。
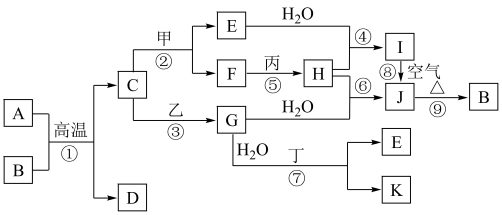
请回答下列问题:
(1)组成物质C的元素在元素周期表中的位置为___________ 。
(2)在反应①~⑨中,不属于氧化还原反应的是___________ 。
(3)写出下列反应的化学方程式:
反应①:___________ 。
反应⑧:___________ 。
(4)写出乙与E在溶液中反应的离子方程式:___________ 。
(5)在E溶液中加入与E等物质的量的一种淡黄色固体,恰好使E转化为J,写出该反应的离子方程式:___________ 。
(6)检验G中阳离子的试剂的化学式为___________ ,反应现象为___________ 。

请回答下列问题:
(1)组成物质C的元素在元素周期表中的位置为
(2)在反应①~⑨中,不属于氧化还原反应的是
(3)写出下列反应的化学方程式:
反应①:
反应⑧:
(4)写出乙与E在溶液中反应的离子方程式:
(5)在E溶液中加入与E等物质的量的一种淡黄色固体,恰好使E转化为J,写出该反应的离子方程式:
(6)检验G中阳离子的试剂的化学式为
您最近一年使用:0次
解题方法
2 . 铁及其化合物在生产、生活中有着重要作用。按要求回答下列问题。
(1)基态Fe原子的价层电子排布式为___________ ;铁元素在元素周期表中的位置是___________ ,属于___________ 区。
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:
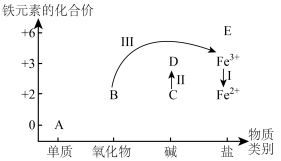
①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:___________ 。
②预测物质E中铁元素具有___________ (填“氧化性”或“还原性”)。
③写出反应Ⅱ的化学方程式:___________ 。
④实现反应Ⅲ的转化,可选择含N元素的试剂为___________ 。
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)
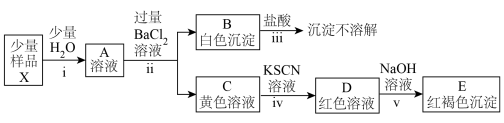
①由步骤ⅰ及其现象可推知铁盐X的物理性质:___________ 。
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为___________ 。
③C溶液呈黄色,不可能是因其体系中含有的___________ 、___________ 、___________ 、___________ (填离子符号)所致;
而可能是因其体系中含有的___________ 、___________ (填粒子的化学式)等所致。
④由步骤iv、v及其现象,体系中与 结合能力最强的离子是
结合能力最强的离子是___________ 。
(1)基态Fe原子的价层电子排布式为
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:

①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:
②预测物质E中铁元素具有
③写出反应Ⅱ的化学方程式:
④实现反应Ⅲ的转化,可选择含N元素的试剂为
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)

①由步骤ⅰ及其现象可推知铁盐X的物理性质:
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为
③C溶液呈黄色,不可能是因其体系中含有的
而可能是因其体系中含有的
④由步骤iv、v及其现象,体系中与
 结合能力最强的离子是
结合能力最强的离子是
您最近一年使用:0次
名校
解题方法
3 . 中学化学中几种常见物质的转化关系如下:
将饱和D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)A、B、H的化学式:A___________ ;B___________ ;H___________ 。
(2)A元素在元素周期表中的位置为:___________ ;红褐色胶体中F粒子直径大小的范围:___________ 。
(3)①Na2O2的电子式:___________ ;NH3极易溶于水的原因:___________ 。
②写出C的酸性溶液与双氧水反应的离子方程式:___________ 。
(4)写出鉴定E中阳离子的实验方法和现象:___________ 。

将饱和D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)A、B、H的化学式:A
(2)A元素在元素周期表中的位置为:
(3)①Na2O2的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式:
(4)写出鉴定E中阳离子的实验方法和现象:
您最近一年使用:0次
解题方法
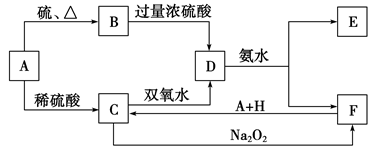
4 . A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂。
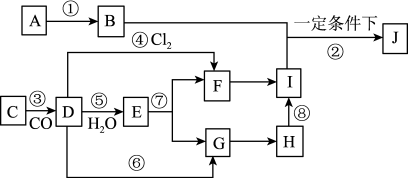
(1) (1)写出物质B的电子式_______ ;D元素在元素周期表中的位置为_______
(填写哪个周期和哪个族),写出物质B与水反应的化学方程式_______
(2) (2)写出下列反应的化学反应方程式:
⑤__________________________________________________________
⑧________________________________________________________________
(3) (3)写出反应的离子方程式:⑦_______
(4) (4)在①−⑧的所有反应中,属于非氧化还原反应的有(填序号)_______
(5) (5)根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因_______________________________________

(1) (1)写出物质B的电子式
(填写哪个周期和哪个族),写出物质B与水反应的化学方程式
(2) (2)写出下列反应的化学反应方程式:
⑤
⑧
(3) (3)写出反应的离子方程式:⑦
(4) (4)在①−⑧的所有反应中,属于非氧化还原反应的有(填序号)
(5) (5)根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因
您最近一年使用:0次
解题方法
5 . 短周期主族元素A、B、C、D、E、G的原子序数依次增大,在元素周期表中A的原子半径最小(稀有气体元素除外),B与C相邻且C的最外层电子数是次外层的3倍,C、D的最外层电子数之和与G的最外层电子数相等,E是地壳中含量最多的金属元素。回答下列问题:
(1)C在元素周期表中的位置是_________ 周期、_________ 族;G的元素符号是_________ 。
(2)B的原子结构示意图是_________ ;C与D组成的既含离子键又含共价键的化合物电子式是_________ 。
(3)E单质能与D的最高价氧化物的水化物浓溶液反应放出氢气,反应的化学方程式是__________________ ;由上述六种元素中的三种组成的某种盐,水溶液显碱性,将该盐溶液滴入硫酸酸化的KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式是__________________ 。
(4)由A、B、C、E中的某些元素组成的化合物X、Y、Z、W有如下转化关系:
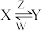
X、Y、Z、W中均由三种元素组成,Z是一种强酸,则Z的化学式是___________ ,Y溶液与过量W反应的离子方程式是___________________________________ 。
(1)C在元素周期表中的位置是
(2)B的原子结构示意图是
(3)E单质能与D的最高价氧化物的水化物浓溶液反应放出氢气,反应的化学方程式是
(4)由A、B、C、E中的某些元素组成的化合物X、Y、Z、W有如下转化关系:
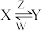
X、Y、Z、W中均由三种元素组成,Z是一种强酸,则Z的化学式是
您最近一年使用:0次
名校
解题方法
6 . 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为4,D是同周期中简单离子半径最小的元素,F元素对应的单质为日常生活中常见金属.
(1)F在元素周期表中的位置时_____ .
(2)B、D、E的简单离子半径由大到小的顺序为_____ (离子符号表示).
(3)B的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在的化学键类型为_____ ,写出检验该化合物中阳离子的离子方程式_____ .
(4)写出由A、B元素形成的六核分子的电子式_____ .
(5)已知常温下化合物FE的Ksp=6×10﹣18mol2•L﹣2,常温下将1.0×10﹣5mol•L﹣1的Na2E溶液与含FSO4溶液按体积比3:2混合,若有沉淀FE生成,则所需的FSO4的浓度至少是_____ .(忽略混合后溶液的体积变化).
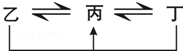
①均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;
②均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
请回答下列问题:
a.均含有D元素的乙与丁在溶液中发生反应的离子方程式_____ .
b.丙、丁分别是含F元素的简单阳离子,检验含丙、丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:_____ .
(1)F在元素周期表中的位置时
(2)B、D、E的简单离子半径由大到小的顺序为
(3)B的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在的化学键类型为
(4)写出由A、B元素形成的六核分子的电子式
(5)已知常温下化合物FE的Ksp=6×10﹣18mol2•L﹣2,常温下将1.0×10﹣5mol•L﹣1的Na2E溶液与含FSO4溶液按体积比3:2混合,若有沉淀FE生成,则所需的FSO4的浓度至少是
图中均含D或F元素的物质均会有图示转化关系:

①均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;
②均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
请回答下列问题:
a.均含有D元素的乙与丁在溶液中发生反应的离子方程式
b.丙、丁分别是含F元素的简单阳离子,检验含丙、丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:
您最近一年使用:0次
解题方法
7 . Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用化学用语答题)
(1)R的元素符号为_______ ; M在元素周期表中的位置为___________________ 。
(2)X与Y按原子个数比1:1构成的物质的电子式为________ ;所含化学键类型________ 。
(3)X+, Y2‾,M2‾ 离子半径大小顺序为________________________________ 。
(4)将YM2通入FeCl3溶液中的离子方程式_________________________________ 。
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式_________________________ 。
Ⅱ.如下图转化关系

①若B为白色胶状不溶物,则A与C反应的离子方程式为____________________________ 。
②若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为______________________________ 。
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(2)X与Y按原子个数比1:1构成的物质的电子式为
(3)X+, Y2‾,M2‾ 离子半径大小顺序为
(4)将YM2通入FeCl3溶液中的离子方程式
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式
Ⅱ.如下图转化关系

①若B为白色胶状不溶物,则A与C反应的离子方程式为
②若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为
您最近一年使用:0次
8 . A~I都是由短周期元素组成的常见物质,它们之间的转化关系如下图所示。已知:A为气体,其水溶液呈碱性;D、F均能与人体血液中的血红蛋白结合而使人中毒;E可作为半导体材料。

(1)化合物A的电子式为__________ 。
氧化物I中化学键类型:___________ 。
组成E单质的元素在元素周期表中的位置是________________ 。
图中物质所含元素原子的半径由大到小依次是(写元素符号)_____________ 。
(2)反应④的化学方程式为_________________________ 。
(3)将F与B按体积比2:1混合生成气体M,常温下测定M相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)____________ 。
(4)某容积为V L的试管中充满F气体(标准状况下),若将该气体完全被水吸收,需通入B的物质的量为(写含V的表达式)_________ mol,此时所得溶液中再通入气体A,恰好完全反应后所得溶液中各离子浓度由大到小依次为:______________ 。

(1)化合物A的电子式为
氧化物I中化学键类型:
组成E单质的元素在元素周期表中的位置是
图中物质所含元素原子的半径由大到小依次是(写元素符号)
(2)反应④的化学方程式为
(3)将F与B按体积比2:1混合生成气体M,常温下测定M相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)
(4)某容积为V L的试管中充满F气体(标准状况下),若将该气体完全被水吸收,需通入B的物质的量为(写含V的表达式)
您最近一年使用:0次
解题方法
9 . 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:________ (填字母)。
a.ⅰ中,C做还原剂 b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸 d.元素的电负性C>Si
(2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为________ ,电负性Si________ H(填“>”或“<”)。
②该反应的化学方程式为________ 。
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:________ 。
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
(4)写出基态Ga原子价层电子排布式________ 。
(5)As的第一电离能比Se大的主要原因是:________________ 。
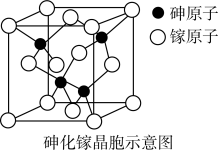
(6)下图为砷化镓晶胞示意图,写出其化学式________ 。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:
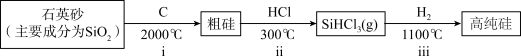
a.ⅰ中,C做还原剂 b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸 d.元素的电负性C>Si
(2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为
②该反应的化学方程式为
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
| Si | |||
| Ga | As | Se |
(4)写出基态Ga原子价层电子排布式
(5)As的第一电离能比Se大的主要原因是:
(6)下图为砷化镓晶胞示意图,写出其化学式
您最近一年使用:0次
解题方法
10 . 海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
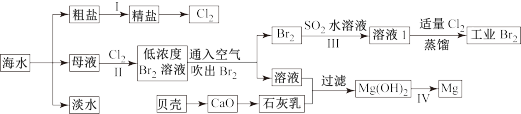
请回答下列问题:
Ⅰ.(1)步骤1中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式_________________ 。
(2)海水提溴,制得1mol Br2需要消耗_________ mol Cl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是___________________________ 。步骤Ⅲ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_______________________________ 。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入__________ 溶液。
Ⅱ.(1)Mg在元素周期表中的位置:_____________ ,Mg(OH)2的电子式:____________ ,Mg(OH)2中所含元素的简单离子半径由小到大的顺序是____________________________ 。
(2)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_______________ (填序号)。
A.Mg(OH)2→MgCl2 Mg B. Mg(OH)2
Mg B. Mg(OH)2 MgO
MgO Mg
Mg
C. Mg(OH)2 MgO
MgO  Mg D. Mg(OH)2
Mg D. Mg(OH)2 无水MgCl2
无水MgCl2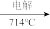 Mg
Mg
(3)判断Mg(OH)2是否洗涤干净的操作是__________________ 。
Ⅲ. 用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
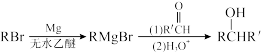 (R:烃基: R':烃基或H)依据上述信息,写出制备
(R:烃基: R':烃基或H)依据上述信息,写出制备 所需溴代烃的可能结构简式:
所需溴代烃的可能结构简式: ___________ 。

请回答下列问题:
Ⅰ.(1)步骤1中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式
(2)海水提溴,制得1mol Br2需要消耗
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入
Ⅱ.(1)Mg在元素周期表中的位置:
(2)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是
A.Mg(OH)2→MgCl2
 Mg B. Mg(OH)2
Mg B. Mg(OH)2 MgO
MgO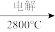 Mg
MgC. Mg(OH)2
 MgO
MgO  Mg D. Mg(OH)2
Mg D. Mg(OH)2 无水MgCl2
无水MgCl2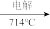 Mg
Mg(3)判断Mg(OH)2是否洗涤干净的操作是
Ⅲ. 用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
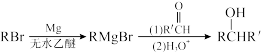 (R:烃基: R':烃基或H)依据上述信息,写出制备
(R:烃基: R':烃基或H)依据上述信息,写出制备 所需溴代烃的可能结构简式:
所需溴代烃的可能结构简式:
您最近一年使用:0次



