1 . Ⅰ.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第四周期第___ 族;其基态原子的电子排布式为___ 。
(2)在Ti的化合物中,Ti可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好、介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图所示,则它的化学式是___ ,其中Ti4+的氧配位数为___ ,Ba2+的氧配位数为____ 。

(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是___ 晶体。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图a所示,我们通常可以用图b所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体形,它有___ 种同分异构体。

(5)已知过氧化氢分子的空间结构如图c所示,分子中氧原子采取___ 杂化。

(6)24Cr是1~36号元素中未成对电子数最多的原子,Cr3+在溶液中存在如下转化关系:Cr3+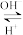 Cr(OH)3
Cr(OH)3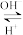 [Cr(OH)4]-。
[Cr(OH)4]-。
①基态Cr原子的价电子排布式为___ 。
②Cr(OH)3是分子晶体,[Cr(OH)4]-中存在的化学键是___ (填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键
(1)Ti元素在元素周期表中的位置是第四周期第
(2)在Ti的化合物中,Ti可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好、介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图所示,则它的化学式是

(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图a所示,我们通常可以用图b所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体形,它有

(5)已知过氧化氢分子的空间结构如图c所示,分子中氧原子采取

(6)24Cr是1~36号元素中未成对电子数最多的原子,Cr3+在溶液中存在如下转化关系:Cr3+
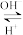 Cr(OH)3
Cr(OH)3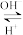 [Cr(OH)4]-。
[Cr(OH)4]-。①基态Cr原子的价电子排布式为
②Cr(OH)3是分子晶体,[Cr(OH)4]-中存在的化学键是
A.离子键 B.极性键 C.非极性键 D.配位键
您最近一年使用:0次
名校
2 . A、B、C、D、E、X均为短周期元素形成的无机物,存在下图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解。请回答以下问题:
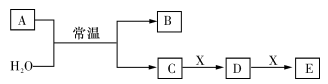
(1)若A 为单质,且C 为一元强酸。
①组成单质A的元素在元素周期表中的位置为__________ 。
②写出一种工业制备单质A方法的离子方程式:__________ 。
③X 可能为________ (填字母代号)。
a.NaOH b. AlCl3 c.Na2CO3 d.NaAlO2
(2)若A 为两种元素形成的化合物,且E 与水反应生成的G的浓溶液遇C 有白烟产生。
①A的电子式为__________ 。
②A 与H2O反应的化学方程式为__________ 。
③G的浓溶液遇C产生白烟的化学方程式为__________ 。

(1)若A 为单质,且C 为一元强酸。
①组成单质A的元素在元素周期表中的位置为
②写出一种工业制备单质A方法的离子方程式:
③X 可能为
a.NaOH b. AlCl3 c.Na2CO3 d.NaAlO2
(2)若A 为两种元素形成的化合物,且E 与水反应生成的G的浓溶液遇C 有白烟产生。
①A的电子式为
②A 与H2O反应的化学方程式为
③G的浓溶液遇C产生白烟的化学方程式为
您最近一年使用:0次
解题方法
3 . Ⅰ.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
(1)推断B元素在元素周期表中的位置_______________________ 。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为_____________ 。
(3)用电子式表示化合物E2F的形成过程_______________________ 。
(4)下图为某新型发电装置示意图,其负极电极反应为_______________________ 。

(5)在101kPa、25℃下,16g液态C2A4在D2中完全燃烧生成气体C2,放出312kJ热量,则C2A4和D2反应的热化学方程式为_______________________ 。
Ⅱ.A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)。

试回答:
(1)若X是强氧化性单质,则A不可能是___________ 。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的 化 学式为___________ 。
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为___________ 。
(1)推断B元素在元素周期表中的位置
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为
(3)用电子式表示化合物E2F的形成过程
(4)下图为某新型发电装置示意图,其负极电极反应为

(5)在101kPa、25℃下,16g液态C2A4在D2中完全燃烧生成气体C2,放出312kJ热量,则C2A4和D2反应的热化学方程式为
Ⅱ.A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)。

试回答:
(1)若X是强氧化性单质,则A不可能是
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的 化 学式为
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为
您最近一年使用:0次
名校
解题方法
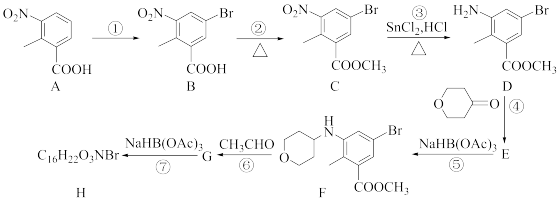
4 . 化合物H是抗肿瘤药泰泽司他的中间体,其合成路线如图:
已知:①
②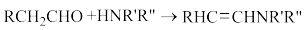 ;
;
③苯环土取代基定位原则(苯环上有该取代基后,下一个取代基在苯环上与该取代基的相对位置):—CH2OH为邻、对位定位基,—CHO为间位定位基。
回答下列问题:
(1)实现反应①的转化,所需试剂除A外还有___________ 。
(2)化合物B中不含氧官能团名称为___________ ;
(3)反应⑤的反应类型为___________ ;化合物G的结构简式为___________ 。
(4)满足下列条件的A的同分异构体的结构简式为___________ 、___________ 。
①含有苯环,且苯环上有5个取代基;②可发生银镜反应;③可与氯化铁溶液发生显色反应;④核磁共振氢谱有4组峰,峰面积之比为1:2:2:2。
(5)已知酯可以水解生成醇,也可以氨解生成醇,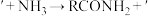 。化合物D通过聚合反应可形成一种高分于;该反应的化学方程式为
。化合物D通过聚合反应可形成一种高分于;该反应的化学方程式为___________ 。
(6)参照题干中的合成路线,设计以苯甲醇为主要原料,制备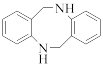 的合成路线
的合成路线___________ (无机试剂任选)。

已知:①

②
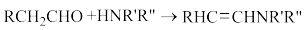 ;
;③苯环土取代基定位原则(苯环上有该取代基后,下一个取代基在苯环上与该取代基的相对位置):—CH2OH为邻、对位定位基,—CHO为间位定位基。
回答下列问题:
(1)实现反应①的转化,所需试剂除A外还有
(2)化合物B中不含氧官能团名称为
(3)反应⑤的反应类型为
(4)满足下列条件的A的同分异构体的结构简式为
①含有苯环,且苯环上有5个取代基;②可发生银镜反应;③可与氯化铁溶液发生显色反应;④核磁共振氢谱有4组峰,峰面积之比为1:2:2:2。
(5)已知酯可以水解生成醇,也可以氨解生成醇,
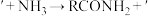 。化合物D通过聚合反应可形成一种高分于;该反应的化学方程式为
。化合物D通过聚合反应可形成一种高分于;该反应的化学方程式为(6)参照题干中的合成路线,设计以苯甲醇为主要原料,制备
 的合成路线
的合成路线
您最近一年使用:0次
2023-05-04更新
|
532次组卷
|
2卷引用:湖南师范大学附属中学2023届高三下学期模拟考试(二)化学试题
名校
5 . 2023年7月3日,商务部与海关总署发布公告,宣布对镓、锗相关物项实施出口管制。金属镓被称为“电子工业脊梁”,氮化镓是5G技术中广泛应用的新型半导体材料。利用粉煤灰(主要成分为 、
、 、
、 还有少量
还有少量 等杂质)制备镓和氮化镓的流程如下:
等杂质)制备镓和氮化镓的流程如下:

已知:①镓与铝同族,其化合物性质相似。
②“碱浸”后溶液的主要成分为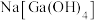 、
、 、
、 。
。
③常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度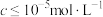 时,可认为已除尽。
时,可认为已除尽。

回答下列问题:
(1)基态Ga原子的核外电子排布式为___________ ,Br在元素周期表中的位置为___________ 。
(2)已知“焙烧”后铝、镓、硅元素均转化为可溶性钠盐,写出 所发生反应的化学方程式为
所发生反应的化学方程式为___________ 。
(3)“沉淀”步骤中加入过量稀硫酸至生成的沉淀不再溶解,则滤渣2的主要成分是___________ (写化学式)。
(4)步骤①和②中通入过量气体A发生反应的离子方程式为___________ 。
(5)常温下,反应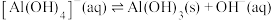 的平衡常数
的平衡常数
___________ 。
(6)以纯镓为原料可制得另一种半导体材料 ,其晶体结构如图所示,已知晶胞密度为
,其晶体结构如图所示,已知晶胞密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,晶胞边长a为
,晶胞边长a为___________ pm(列出计算式即可)。

 、
、 、
、 还有少量
还有少量 等杂质)制备镓和氮化镓的流程如下:
等杂质)制备镓和氮化镓的流程如下:
已知:①镓与铝同族,其化合物性质相似。
②“碱浸”后溶液的主要成分为
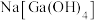 、
、 、
、 。
。③常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度
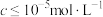 时,可认为已除尽。
时,可认为已除尽。
回答下列问题:
(1)基态Ga原子的核外电子排布式为
(2)已知“焙烧”后铝、镓、硅元素均转化为可溶性钠盐,写出
 所发生反应的化学方程式为
所发生反应的化学方程式为(3)“沉淀”步骤中加入过量稀硫酸至生成的沉淀不再溶解,则滤渣2的主要成分是
(4)步骤①和②中通入过量气体A发生反应的离子方程式为
(5)常温下,反应
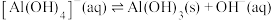 的平衡常数
的平衡常数
(6)以纯镓为原料可制得另一种半导体材料
 ,其晶体结构如图所示,已知晶胞密度为
,其晶体结构如图所示,已知晶胞密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,晶胞边长a为
,晶胞边长a为
您最近一年使用:0次
2024-01-07更新
|
249次组卷
|
2卷引用:2024届湖南省湘东九校联盟高三上学期第一次联考化学试题
名校
6 . 金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是___________ 。写出Ga2O3与NaOH反应的离子方程式:___________ 。
(2)GaN是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产GaN的工艺如图:
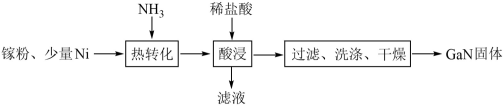
①“热转化”时Ga转化为GaN的化学方程式是___________ 。
②“酸浸”操作目的是___________ 。
(3)As与N同主族,GaAs也是一种重要的半导体材料。
①下列事实不能用元素周期律解释的是___________ (填字母)。
a.碱性:Ga(OH)3>Al(OH)3 b.非金属性:As>Ga c.酸性:H3AsO4>H3AsO3
②用原子结构理论解推测,GaAs中As元素化合价为___________ 价。
(1)铝在元素周期表中的位置是
(2)GaN是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产GaN的工艺如图:

①“热转化”时Ga转化为GaN的化学方程式是
②“酸浸”操作目的是
(3)As与N同主族,GaAs也是一种重要的半导体材料。
①下列事实不能用元素周期律解释的是
a.碱性:Ga(OH)3>Al(OH)3 b.非金属性:As>Ga c.酸性:H3AsO4>H3AsO3
②用原子结构理论解推测,GaAs中As元素化合价为
您最近一年使用:0次
名校
7 . 小分子抗癌新药mutlin—3的合成路线如图:

已知:ⅰ.R—CN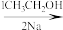

ⅱ.R—OH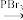 R—Br
R—Br
ⅲ. +
+ →
→ +HCl(R、R′为烃基)
+HCl(R、R′为烃基)
(1)A的名称为____ 。
(2)C分子中的含氧官能团有:醚键、____ 、____ 。
(3)E的分子式为C3H8O,F→G的有机反应类型是___ 。
(4)D+G→H的化学方程式为____ 。
(5)L的结构简式为____ 。
(6)下列说法不正确 的是____ 。
a.B的核磁共振氢谱吸收峰强度比为6∶2∶1
b.F发生消去反应的有机产物不存在顺反异构体
c.1molK与足量NaOH溶液反应,最多消耗4molNaOH
(7)NBS(N—溴代琥珀酰亚胺)是有机合成中的重要试剂,其结构简式为: ,如图是某同学设计合成NBS的流程。请写出流程中X→Y的合成路线(用结构简式表示有机物,用箭头表示转化关系)
,如图是某同学设计合成NBS的流程。请写出流程中X→Y的合成路线(用结构简式表示有机物,用箭头表示转化关系)____ 。
CH2=CH—CH=CH2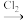 X→……→Y
X→……→Y



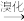


已知:ⅰ.R—CN
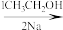

ⅱ.R—OH
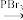 R—Br
R—Brⅲ.
 +
+ →
→ +HCl(R、R′为烃基)
+HCl(R、R′为烃基)(1)A的名称为
(2)C分子中的含氧官能团有:醚键、
(3)E的分子式为C3H8O,F→G的有机反应类型是
(4)D+G→H的化学方程式为
(5)L的结构简式为
(6)下列说法
a.B的核磁共振氢谱吸收峰强度比为6∶2∶1
b.F发生消去反应的有机产物不存在顺反异构体
c.1molK与足量NaOH溶液反应,最多消耗4molNaOH
(7)NBS(N—溴代琥珀酰亚胺)是有机合成中的重要试剂,其结构简式为:
 ,如图是某同学设计合成NBS的流程。请写出流程中X→Y的合成路线(用结构简式表示有机物,用箭头表示转化关系)
,如图是某同学设计合成NBS的流程。请写出流程中X→Y的合成路线(用结构简式表示有机物,用箭头表示转化关系)CH2=CH—CH=CH2
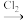 X→……→Y
X→……→Y




您最近一年使用:0次
解题方法
8 . X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断正确的是
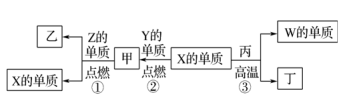

| A.X位于元素周期表第二周期第ⅥA族 |
| B.Z与X可形成多种化合物,其中一种为ZX2,该化合物中既有离子键又有共价键 |
| C.甲、丙、丁均为酸性化合物 |
| D.1mol丙中约含有6.02×1023个分子 |
您最近一年使用:0次
9 . 已知前4周期的部分元素在周期表中的相对位置如图所示,其中X元素的单质在常温下为液体。___________ 元素。海水中提取 时,其中有一步,用到了热空气吹出
时,其中有一步,用到了热空气吹出 ,这是利用了
,这是利用了 的
的___________ 性质。
(2)写出Y的最高价氧化物对应的水化物的稀溶液与单质Q反应的离子方程式:___________ 。
(3)Z的最简单氢化物与 蒸汽在光照下发生反应的反应类型为
蒸汽在光照下发生反应的反应类型为___________ 。
(4)下列说法正确的是________
a.Q元素的最高价氧化物的水化物在水中溶解度很小
b.在Z、R、Y的最高价氧化物的水化物中,Z的最高价氧化物的水化物酸性最弱
c.位于第6周期与X同族的元素,原子序数为85,属于金属元素
d.单晶R是重要的半导体材料
(5)在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,物质转化关系如图所示:___________ 。
②工业上冶炼Al的方法:___________ 。
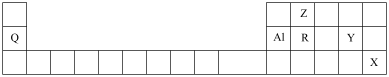
 时,其中有一步,用到了热空气吹出
时,其中有一步,用到了热空气吹出 ,这是利用了
,这是利用了 的
的(2)写出Y的最高价氧化物对应的水化物的稀溶液与单质Q反应的离子方程式:
(3)Z的最简单氢化物与
 蒸汽在光照下发生反应的反应类型为
蒸汽在光照下发生反应的反应类型为(4)下列说法正确的是________
a.Q元素的最高价氧化物的水化物在水中溶解度很小
b.在Z、R、Y的最高价氧化物的水化物中,Z的最高价氧化物的水化物酸性最弱
c.位于第6周期与X同族的元素,原子序数为85,属于金属元素
d.单晶R是重要的半导体材料
(5)在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,物质转化关系如图所示:

②工业上冶炼Al的方法:
您最近一年使用:0次
名校
10 . 芳香族化合物A常用于药物及香料的合成,A有如图转化关系:
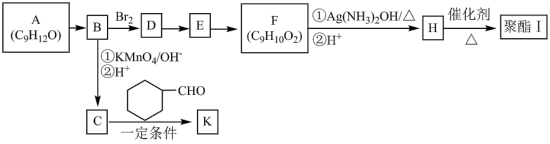
已知:①A能与金属钠反应生成氢气,但不能使酸性高锰酸钾溶液褪色。
②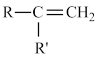

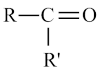 +CO2
+CO2
③RCOCH3+R′CHO RCOCH=CHR′+H2O
RCOCH=CHR′+H2O
回答下列问题:
(1)A生成B,E生成F的反应类型分别为___ ,____ 。
(2)由D生成E的加入试剂和反应条件为____ ,___ 。
(3)H中含有的官能团名称为___ 。
(4)由H生成I的化学方程式为____ 。
(5)K的结构简式为___ 。
(6)F的同分异构体中,同时满足如下条件的有__ 种。
①属于芳香族化合物且苯环上有两个取代基。②能发生水解。
(7)糠叉丙酮( )是一种重要医药中间体,参考上述合成路线,设计一条以叔丁醇[(CH3)3COH]和糠醛(
)是一种重要医药中间体,参考上述合成路线,设计一条以叔丁醇[(CH3)3COH]和糠醛( )为原料制备糠叉丙酮的合成路线(无机试剂任选,箭头上注明反应试剂和条件)
)为原料制备糠叉丙酮的合成路线(无机试剂任选,箭头上注明反应试剂和条件)___ 。
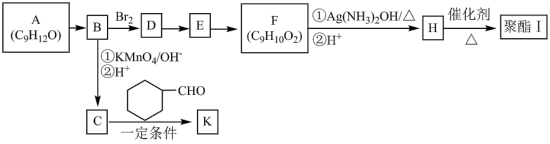
已知:①A能与金属钠反应生成氢气,但不能使酸性高锰酸钾溶液褪色。
②
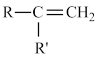

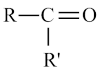 +CO2
+CO2③RCOCH3+R′CHO
 RCOCH=CHR′+H2O
RCOCH=CHR′+H2O回答下列问题:
(1)A生成B,E生成F的反应类型分别为
(2)由D生成E的加入试剂和反应条件为
(3)H中含有的官能团名称为
(4)由H生成I的化学方程式为
(5)K的结构简式为
(6)F的同分异构体中,同时满足如下条件的有
①属于芳香族化合物且苯环上有两个取代基。②能发生水解。
(7)糠叉丙酮(
 )是一种重要医药中间体,参考上述合成路线,设计一条以叔丁醇[(CH3)3COH]和糠醛(
)是一种重要医药中间体,参考上述合成路线,设计一条以叔丁醇[(CH3)3COH]和糠醛( )为原料制备糠叉丙酮的合成路线(无机试剂任选,箭头上注明反应试剂和条件)
)为原料制备糠叉丙酮的合成路线(无机试剂任选,箭头上注明反应试剂和条件)
您最近一年使用:0次
2021-10-24更新
|
401次组卷
|
7卷引用:湖南省攸县第一中学2023届高三第七次月考化学试题



