解题方法
1 . 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含V2O5、K2O、SiO2、少量Fe2O3)制取YVO4的工艺流程如下:
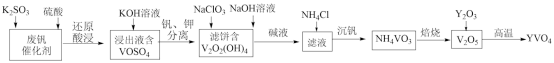
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
回答下列问题:
(1)V元素在元素周期表中的位置为___________ 。
(2)“还原酸浸”时,钒以VO2+浸出,“浸出液”中还含有的金属离子是___________ 。V2O5被还原的离子方程式为___________ 。
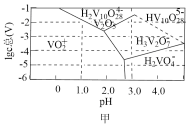
(3)常温下,各种形态五价钒粒子总浓度的对数[lgc总(V)]与pH关系如图甲。pH=4时增大钒粒子总浓度,粒子间转化反应的离子方程式为___________ 、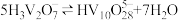 。
。
(4)写出“碱溶”时的化学方程式___________ ,结合“碱溶”和“沉钒”可知,ClO 、VO
、VO 氧化性更强的是
氧化性更强的是___________
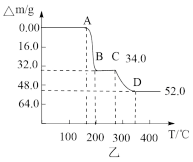
(5)常温下,NH4VO3的溶解度S=0.468 g,则常温下NH4VO3的Ksp=___________ (设NH4VO3饱和溶液的密度为1 g/mL),某研究小组取234 g NH4VO3探究“焙烧”过程中的变化,焙烧过程中减少的质量(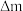 )随温度变化的曲线如图乙所示,则C点所得物质的化学式为
)随温度变化的曲线如图乙所示,则C点所得物质的化学式为___________ 。

已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
回答下列问题:
(1)V元素在元素周期表中的位置为
(2)“还原酸浸”时,钒以VO2+浸出,“浸出液”中还含有的金属离子是
(3)常温下,各种形态五价钒粒子总浓度的对数[lgc总(V)]与pH关系如图甲。pH=4时增大钒粒子总浓度,粒子间转化反应的离子方程式为
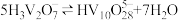 。
。
(4)写出“碱溶”时的化学方程式
 、VO
、VO 氧化性更强的是
氧化性更强的是(5)常温下,NH4VO3的溶解度S=0.468 g,则常温下NH4VO3的Ksp=
 )随温度变化的曲线如图乙所示,则C点所得物质的化学式为
)随温度变化的曲线如图乙所示,则C点所得物质的化学式为
您最近一年使用:0次
名校
2 . (1)短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
①M在元素周期表中的位置是__________________________ 。
②化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________ 。
③(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为_____________ 。
(2)A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
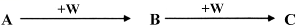
Ⅰ. 若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
①在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为________________
②工业上常用Na2CO3溶液吸收C,生成等物质的量的两种钠盐,该反应的离子方程式为_______________
Ⅱ. A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
①实验室需配制0.1mol·L-1 A溶液450mL。根据计算用托盘天平称取A的质量为__________ g,在实验中其它操作均正确,若定容时仰视刻度线,则所得溶液浓度________________ 0.1mol·L-1 (填“大于”“等于”或“小于”)。
②将标准状况下2.24L 的W通入150mL 1mol·L-1的A溶液中,充分反应。总反应的离子方程式为_______________
①M在元素周期表中的位置是
②化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为
③(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为
(2)A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
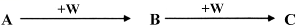
Ⅰ. 若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
①在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为
②工业上常用Na2CO3溶液吸收C,生成等物质的量的两种钠盐,该反应的离子方程式为
Ⅱ. A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
①实验室需配制0.1mol·L-1 A溶液450mL。根据计算用托盘天平称取A的质量为
②将标准状况下2.24L 的W通入150mL 1mol·L-1的A溶液中,充分反应。总反应的离子方程式为
您最近一年使用:0次
3 . A、B、C、D均为中学化学常见的纯净物,且存在如图所示转化关系,其中A是单质。

(1)若A是淡黄色固体,B是气态氢化物,C、D是氧化物,C是造成酸雨的主要物质之一。写出B与C发生反应的化学方程式_________________________ 。
(2)若A、B、D均为两性物质,且A、B生成C的反应均需要强碱溶液。则B生成C的离子反应方程式为________________ ,在A生成C的反应中每消耗1mol还原剂,可生成气体_______________ L(标准状况)。
(3)若组成A、B、C、D的元素为4种短周期元素a、b、c、d,其原子序数逐渐增大,且只有c为金属元素,a、d位于同一主族,b元素原子的最外层电子数是其电子层数的3倍,C、D均为正盐,C是普通玻璃的主要成分之一。则元素d在元素周期表中的位置是________ ,元素a的最高价氧化物对应水化物的水溶液中离子浓度由大到小的顺序为___________ 。

(1)若A是淡黄色固体,B是气态氢化物,C、D是氧化物,C是造成酸雨的主要物质之一。写出B与C发生反应的化学方程式
(2)若A、B、D均为两性物质,且A、B生成C的反应均需要强碱溶液。则B生成C的离子反应方程式为
(3)若组成A、B、C、D的元素为4种短周期元素a、b、c、d,其原子序数逐渐增大,且只有c为金属元素,a、d位于同一主族,b元素原子的最外层电子数是其电子层数的3倍,C、D均为正盐,C是普通玻璃的主要成分之一。则元素d在元素周期表中的位置是
您最近一年使用:0次
解题方法
4 . 甲、乙、丙是三种常见的单质,A、B、C是三种常见的二元无机化合物,它们之间的转化关系如右图所示。请回答下列有关问题:
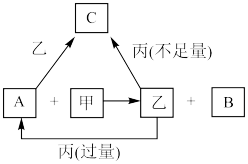
(1)若甲为常见气态非金属单质,丙为金属单质,三种单质中只有甲由短周期元素组成;甲与乙同主族、乙与丙同周期;它们的转化关系均在溶液中进行。则:
①甲物质的名称为___________ 。
②丙元素在元素周期表中的位置是___________ 。
③反应A+甲→乙+B的离子方程式为______________________ 。
④请简述B中阳离子的检验方法__________________________________ 。
(2)若甲为常见金属单质,乙为常见固态非金属单质,且所有物质组成元素均为短周期元素。则:
①乙的化学式为___________ 。
②A的电子式为___________ 。
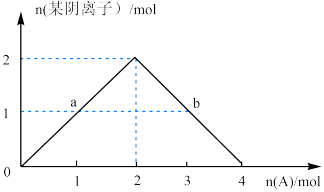
③将A缓慢通入氢氧化钠溶液中,所得溶液中的某种阴离子的物质的量随n(A)的通入转化关系如右图所示。图中a、b两点的溶液中水的电离程度的大小关系为a_______ b(填“>”、“=”或“<")。若溶液X为图中曲线上任意一点,则向溶液X中逐滴加入盐酸至反应完全,消耗盐酸的物质的量最大为___________ 。

(1)若甲为常见气态非金属单质,丙为金属单质,三种单质中只有甲由短周期元素组成;甲与乙同主族、乙与丙同周期;它们的转化关系均在溶液中进行。则:
①甲物质的名称为
②丙元素在元素周期表中的位置是
③反应A+甲→乙+B的离子方程式为
④请简述B中阳离子的检验方法
(2)若甲为常见金属单质,乙为常见固态非金属单质,且所有物质组成元素均为短周期元素。则:
①乙的化学式为
②A的电子式为
③将A缓慢通入氢氧化钠溶液中,所得溶液中的某种阴离子的物质的量随n(A)的通入转化关系如右图所示。图中a、b两点的溶液中水的电离程度的大小关系为a

您最近一年使用:0次
名校
解题方法
5 . 元素X、Y、Z、M、N均为原子序数依次增大的短周期主族元素;R在地壳金属元素中的含量仅次于Z。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4;N-、Z3+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)R在元素周期表中的位置是____________ ;Z3+的离子结构示意图是____________ 。
(2)写出X、Y、N按原子个数之比1:1:1:形成的化合物的电子式__________ ;M和N气态氢化物的稳定性大小比较为________ (用化学式和“>”“<”或“=”表示)。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__________________________________ .
(4)Z元素的单质能与Y和R形成的化合物在一定条件下发生反应,同时放出大量的热,其反应的化学方程式为_____________________________ 。
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,在该转化关系中还原剂是__________ (填化学式),示意图中转移电子的数目为______ 。


(6)由X、Y、M三种元素组成的离子,在水溶液中与H+和OH-均不能大量共存,还能和氯水反应,写出其与新制氯水反应的离子方程式_______________________ 。
(1)R在元素周期表中的位置是
(2)写出X、Y、N按原子个数之比1:1:1:形成的化合物的电子式
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式
(4)Z元素的单质能与Y和R形成的化合物在一定条件下发生反应,同时放出大量的热,其反应的化学方程式为
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,在该转化关系中还原剂是



(6)由X、Y、M三种元素组成的离子,在水溶液中与H+和OH-均不能大量共存,还能和氯水反应,写出其与新制氯水反应的离子方程式
您最近一年使用:0次
2017-12-08更新
|
236次组卷
|
3卷引用:山东省烟台市2018届高三上学期期中考试化学试题
解题方法
6 . 下图为相关物质之间的转化关系,其中甲、乙为生活中常见的金属单质,丙、丁
在常温下为气态非金属单质,A~F为化合物(水均已略去)。
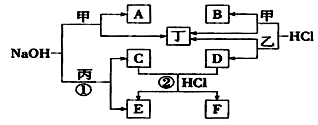
请回答:
(1)组成丙的元素在元素周期表中的位置 为_________ ;利用反应①,工业上常制备____ (填产品名称)。
(2)C的电子式为______ ;反应②的离子方程式为___________ 。
(3)将A、B的水溶液混合,反应的离子方程式为________ 。
(4)将B的稀溶液加水稀释,在图中画出溶液pH随加水体积的变化趋势曲线______ 。

(5)工业上冶炼金属甲的化学方程式为____________________ 。
(6)将等物质的量的A和NaOH混合溶于水,该溶液中各离子的物质的量浓度由大到小的顺序为______ 。
(7)检验F中阳离子的方法为____________________
在常温下为气态非金属单质,A~F为化合物(水均已略去)。

请回答:
(1)组成丙的元素在元素周期表中的位置 为
(2)C的电子式为
(3)将A、B的水溶液混合,反应的离子方程式为
(4)将B的稀溶液加水稀释,在图中画出溶液pH随加水体积的变化趋势曲线

(5)工业上冶炼金属甲的化学方程式为
(6)将等物质的量的A和NaOH混合溶于水,该溶液中各离子的物质的量浓度由大到小的顺序为
(7)检验F中阳离子的方法为
您最近一年使用:0次
解题方法
7 . Ⅰ、A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3两种化合物。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
①D元素在元素周期表中的位置是______________ 。
②A与D所形成的化合物的电子式为___________________ 。
③将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的化学方程式为_______________ 。
Ⅱ、由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。

(1)若A为金属钠, A与水反应的离子方程式为______________________ 。
(2)若A为过氧化钠, A与水反应的化学方程式为____________________ 。
(3)A不论是Na还是Na2O2,依据转化关系判断物质D是_______________ ,
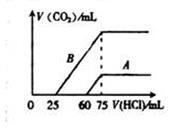
(4)向30ml某浓度的B溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况(不计CO2的溶解),则曲线B表明M中的溶质为______________ ;原NaOH溶液的物质的量浓度为__________ ;由曲线A、B可知,两次实验通入的CO2的体积比为___________ 。
(5)请你设计一实验证明Na2CO3溶液碱性比NaHCO3溶液的碱性强:__________________ 。
①D元素在元素周期表中的位置是
②A与D所形成的化合物的电子式为
③将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的化学方程式为
Ⅱ、由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。

(1)若A为金属钠, A与水反应的离子方程式为
(2)若A为过氧化钠, A与水反应的化学方程式为
(3)A不论是Na还是Na2O2,依据转化关系判断物质D是
(4)向30ml某浓度的B溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况(不计CO2的溶解),则曲线B表明M中的溶质为

(5)请你设计一实验证明Na2CO3溶液碱性比NaHCO3溶液的碱性强:
您最近一年使用:0次
解题方法
8 . 将钛铁矿( )、磷灰石矿
)、磷灰石矿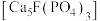 与锂灰石矿三矿耦合,按“原子经济”的绿色工艺技术路线生产磷酸铁锂,同时充分利用伴生元素。工艺流程如图。
与锂灰石矿三矿耦合,按“原子经济”的绿色工艺技术路线生产磷酸铁锂,同时充分利用伴生元素。工艺流程如图。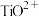 ;
;
②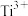 溶液为紫色;常温时,有关电对的电极电势
溶液为紫色;常温时,有关电对的电极电势
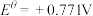 ;
;
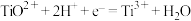
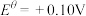 。一般标准电极电势越高,氧化剂的氧化性越强。
。一般标准电极电势越高,氧化剂的氧化性越强。
③25℃时,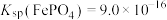 。
。
回答下列问题:
(1)Ti在元素周期表中的位置为______ 。“试剂X”为______ (填化学式)。
(2)“酸解”反应的化学方程式为______ 。
(3)“水解”过程中通过观察溶液保持紫色,判断无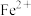 被氧化,该方法的依据是
被氧化,该方法的依据是______ 。
(4)循环利用“滤液2”的操作单元名称为______ 。“气体1”为______ (填化学式)。
(5)“沉淀”反应的化学方程式为______ 。若将铁离子恰好沉淀完全(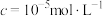 )时,
)时,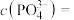
______  。
。
 )、磷灰石矿
)、磷灰石矿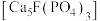 与锂灰石矿三矿耦合,按“原子经济”的绿色工艺技术路线生产磷酸铁锂,同时充分利用伴生元素。工艺流程如图。
与锂灰石矿三矿耦合,按“原子经济”的绿色工艺技术路线生产磷酸铁锂,同时充分利用伴生元素。工艺流程如图。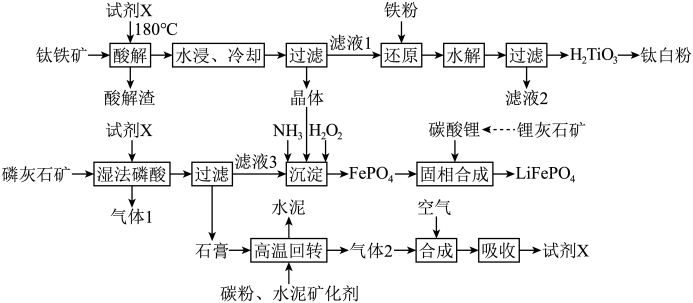
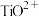 ;
;②
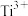 溶液为紫色;常温时,有关电对的电极电势
溶液为紫色;常温时,有关电对的电极电势
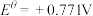 ;
;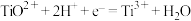
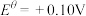 。一般标准电极电势越高,氧化剂的氧化性越强。
。一般标准电极电势越高,氧化剂的氧化性越强。③25℃时,
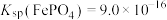 。
。回答下列问题:
(1)Ti在元素周期表中的位置为
(2)“酸解”反应的化学方程式为
(3)“水解”过程中通过观察溶液保持紫色,判断无
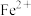 被氧化,该方法的依据是
被氧化,该方法的依据是(4)循环利用“滤液2”的操作单元名称为
(5)“沉淀”反应的化学方程式为
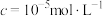 )时,
)时,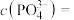
 。
。
您最近一年使用:0次
名校
解题方法
9 . 苯基环丁烯酮(PCBO)是一种十分活泼的反应物,可利用它的开环反应合成一系列多官能团化合物。近期我国科学家报道用PCBO与醛或酮发生[4+2]环加成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如下:
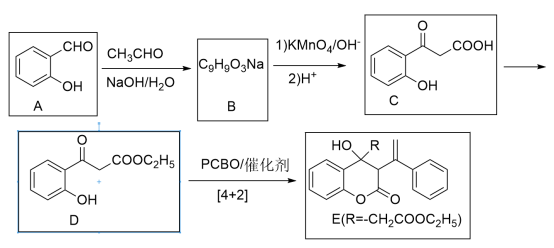
已知如下信息: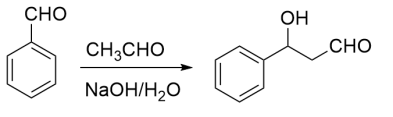
回答下列问题:
(1)A分子中官能团的名称是_______ 。
(2)写出A→B的化学反应方程式_______ 。
(3)C→D的反应类型是_______ 反应;该步反应中,若反应温度过高,C易发生脱羧反应,生成分子式为C8H8O2的副产物,依据其结构推断lmol的该副产物在合适条件下最多消耗_______ mol的氢气。
(4)指出化合物E中的手性碳,并用*在图中对应碳原子的上方位置标出_______ 。
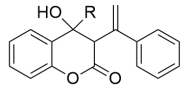
(5)M为C的一种同分异构体,属于芳香族化合物,分子中只有一个取代基。已知1molM可与2mol钠反应能放出1mol氢气;2molM分子间发生取代反应,生成含3个六元环的酯。M的结构简式为_______ 。
(6)以苯甲醛、CH3CHO为原料,其它无机试剂和催化剂任选,写出制备M的转化关系式_______ 。

已知如下信息:

回答下列问题:
(1)A分子中官能团的名称是
(2)写出A→B的化学反应方程式
(3)C→D的反应类型是
(4)指出化合物E中的手性碳,并用*在图中对应碳原子的上方位置标出

(5)M为C的一种同分异构体,属于芳香族化合物,分子中只有一个取代基。已知1molM可与2mol钠反应能放出1mol氢气;2molM分子间发生取代反应,生成含3个六元环的酯。M的结构简式为
(6)以苯甲醛、CH3CHO为原料,其它无机试剂和催化剂任选,写出制备M的转化关系式
您最近一年使用:0次
名校
10 . 电镀污泥(主要含Cr、Cu、Zn、Ni、Fe、Si)中金属大多以氢氧化物的形式存在,硅以SiO2形式存在。某科研团队用萃取——沉淀法回收电镀污泥中金属的技术路线如图所示。
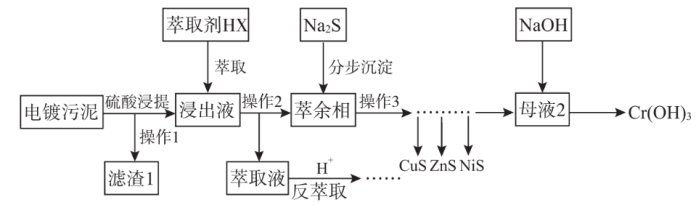
已知:①萃取反应可简单表示为nHX+Mn+ MXn+nH+
MXn+nH+
②相关资料显示,分步沉淀工序中投加硫化钠生成沉淀时,可以认为水溶液中的H2S饱和,饱和c(H2S)=1.0mol·L-1。
回答下列问题:
(1)铁元素在元素周期表中位置为___ ;滤渣1的主要成分是___ 。
(2)操作2的名称为___ 。
(3)萃取浸出液除去的元素为___ (填元素符号),由于该元素在分步沉淀工序中与硫化钠发生氧化还原反应生成多种沉淀难以分离,故该元素不可在分步沉淀工序中除去,写出此反应的化学方程式___ 。
(4)反萃取工序发生的离子方程式为____ 。
(5)萃余相中的Ni元素恰好完全转化为沉淀的pH为___ [通常认为溶液中离子浓度小于10-5mol·L-1为沉淀完全,Ksp(NiS)=1×10-19,考虑H2S的二级电离Ka1(H2S)=1×10-7,Ka2(H2S)=1×10-15]。

已知:①萃取反应可简单表示为nHX+Mn+
 MXn+nH+
MXn+nH+②相关资料显示,分步沉淀工序中投加硫化钠生成沉淀时,可以认为水溶液中的H2S饱和,饱和c(H2S)=1.0mol·L-1。
回答下列问题:
(1)铁元素在元素周期表中位置为
(2)操作2的名称为
(3)萃取浸出液除去的元素为
(4)反萃取工序发生的离子方程式为
(5)萃余相中的Ni元素恰好完全转化为沉淀的pH为
您最近一年使用:0次
2021-09-23更新
|
278次组卷
|
2卷引用:山东省潍坊市第一中学2022届高三10月月考化学试题



