1 .  、
、 、
、 、
、 、
、 、
、 是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。 的焰色试验为黄色,且
的焰色试验为黄色,且 为化合物,回答下列问题:
为化合物,回答下列问题:
1. 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
2.若 为强还原性的非金属单质,通常为黑色粉末,则
为强还原性的非金属单质,通常为黑色粉末,则 的电子式为
的电子式为_______ 。
3.若 为一种造成温室效应的气体,则鉴别等浓度的
为一种造成温室效应的气体,则鉴别等浓度的 、
、 溶液,可选择的试剂为_______。
溶液,可选择的试剂为_______。
4.若 为
为 ,则
,则 与
与 反应的化学方程式为
反应的化学方程式为_______ ,并写出 的一种用途
的一种用途_______ 。
若 为黄绿色气体单质,具有很强的氧化性。
为黄绿色气体单质,具有很强的氧化性。
5.组成物质 的元素在元素周期表中的位置是
的元素在元素周期表中的位置是_______ 。
6. 的水溶液放置一段时间后,溶液的酸性
的水溶液放置一段时间后,溶液的酸性_______ (填“增强”、“减弱”或“不变”)。
7.若 为强电解质,则
为强电解质,则 可能为_______。
可能为_______。
8.请写出 与冷的石灰乳反应的化学方程式:
与冷的石灰乳反应的化学方程式:_______ 。
 、
、 、
、 、
、 、
、 、
、 是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。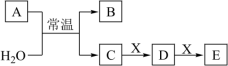
 的焰色试验为黄色,且
的焰色试验为黄色,且 为化合物,回答下列问题:
为化合物,回答下列问题:1.
 与
与 反应的离子方程式为
反应的离子方程式为2.若
 为强还原性的非金属单质,通常为黑色粉末,则
为强还原性的非金属单质,通常为黑色粉末,则 的电子式为
的电子式为3.若
 为一种造成温室效应的气体,则鉴别等浓度的
为一种造成温室效应的气体,则鉴别等浓度的 、
、 溶液,可选择的试剂为_______。
溶液,可选择的试剂为_______。| A.酚酞溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
 为
为 ,则
,则 与
与 反应的化学方程式为
反应的化学方程式为 的一种用途
的一种用途若
 为黄绿色气体单质,具有很强的氧化性。
为黄绿色气体单质,具有很强的氧化性。5.组成物质
 的元素在元素周期表中的位置是
的元素在元素周期表中的位置是6.
 的水溶液放置一段时间后,溶液的酸性
的水溶液放置一段时间后,溶液的酸性7.若
 为强电解质,则
为强电解质,则 可能为_______。
可能为_______。A. | B. | C. | D. |
 与冷的石灰乳反应的化学方程式:
与冷的石灰乳反应的化学方程式:
您最近一年使用:0次
2 .  、
、 、
、 、
、 、
、 、
、 是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
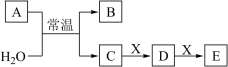
(1)若 的焰色试验为黄色,且
的焰色试验为黄色,且 为化合物,回答下列问题:
为化合物,回答下列问题:
① 的电子式为
的电子式为___________ , 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
②若 为强还原性的非金属单质,通常为黑色粉末,则
为强还原性的非金属单质,通常为黑色粉末,则 的电子式为
的电子式为___________ 。
③若 为一种造成温室效应的气体,则鉴别等浓度的
为一种造成温室效应的气体,则鉴别等浓度的 、
、 溶液,可选择的试剂为
溶液,可选择的试剂为_____ (填代号)。
a.酚酞溶液b. 溶液c.
溶液c. 溶液d.
溶液d. 溶液
溶液
④若 为
为 ,则
,则 与
与 反应的化学方程式为
反应的化学方程式为________ ,写出 的一种用途
的一种用途______ 。
(2)若 为黄绿色气体单质,具有很强的氧化性,则:
为黄绿色气体单质,具有很强的氧化性,则:
①组成物质 的元素在元素周期表中的位置是
的元素在元素周期表中的位置是___________ 。
② 的水溶液放置一段时间后,溶液的酸性
的水溶液放置一段时间后,溶液的酸性___________ (填“增强”、“减弱”或“不变”)。
③若 为强电解质,则
为强电解质,则 可能为
可能为___________ (填代号)。
a. b.
b. c.
c. d.
d.
④请写出 与冷的石灰乳反应的化学方程式:
与冷的石灰乳反应的化学方程式:___________ 。
 、
、 、
、 、
、 、
、 、
、 是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
(1)若
 的焰色试验为黄色,且
的焰色试验为黄色,且 为化合物,回答下列问题:
为化合物,回答下列问题:①
 的电子式为
的电子式为 与
与 反应的离子方程式为
反应的离子方程式为②若
 为强还原性的非金属单质,通常为黑色粉末,则
为强还原性的非金属单质,通常为黑色粉末,则 的电子式为
的电子式为③若
 为一种造成温室效应的气体,则鉴别等浓度的
为一种造成温室效应的气体,则鉴别等浓度的 、
、 溶液,可选择的试剂为
溶液,可选择的试剂为a.酚酞溶液b.
 溶液c.
溶液c. 溶液d.
溶液d. 溶液
溶液④若
 为
为 ,则
,则 与
与 反应的化学方程式为
反应的化学方程式为 的一种用途
的一种用途(2)若
 为黄绿色气体单质,具有很强的氧化性,则:
为黄绿色气体单质,具有很强的氧化性,则:①组成物质
 的元素在元素周期表中的位置是
的元素在元素周期表中的位置是②
 的水溶液放置一段时间后,溶液的酸性
的水溶液放置一段时间后,溶液的酸性③若
 为强电解质,则
为强电解质,则 可能为
可能为a.
 b.
b. c.
c. d.
d.
④请写出
 与冷的石灰乳反应的化学方程式:
与冷的石灰乳反应的化学方程式:
您最近一年使用:0次
2023-12-26更新
|
183次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期12月考试化学试题
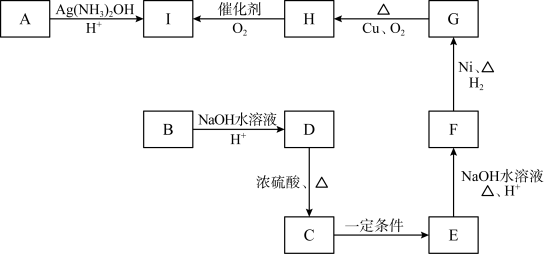
3 . 三种有机物A、B、C互为同分异构体,均由C、H、O三种元素组成,且分子中C、H、O元素的质量比为15:2:8,其相对分子质量通过质谱法测得为100。又知化合物A能发生银镜反应,属于直链结构,分子中有3种不同化学环境的氢,且原子个数比为1:1:2。B为五元环酯。C的红外光谱表明其分子中存在甲基。其它物质的转化关系如下:
完成下列填空:
(1)A的分子式是______________ ,A分子中的官能团名称是_________________ 。
(2)B和G的结构简式分别是_____________ 、_____________ 。
(3)D→C反应的化学方程式为_________________________________________ 。
(4)由单体F发生加聚反应生成的产物的结构简式是___________ 。
(5)试设计一条以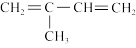 为主要原料制备
为主要原料制备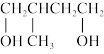 的合成路线
的合成路线_____ ,(合成路线常用的表示方式为:甲 乙
乙
 目标产物)
目标产物)
完成下列填空:
(1)A的分子式是
(2)B和G的结构简式分别是
(3)D→C反应的化学方程式为
(4)由单体F发生加聚反应生成的产物的结构简式是
(5)试设计一条以
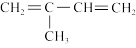 为主要原料制备
为主要原料制备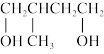 的合成路线
的合成路线 乙
乙
 目标产物)
目标产物)
您最近一年使用:0次
名校
4 . 聚丙烯腈纤维俗名人造羊毛,由丙烯腈聚合而得。用丙烯合成丙烯腈的反应如下: 2C3H6(g)+2NH3(g)+3O2(g)  2C3H3N(g)+6H2O(g)+1030kJ
2C3H3N(g)+6H2O(g)+1030kJ
(1)碳在元素周期表中的位置是_______ ;C、N、O三种元素的原子半径由小到大的顺序为_______ ;
(2)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。
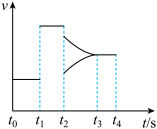
t1时刻表示体系改变的反应条件为_______ ; t2时刻表示体系改变了另一反应条件,此时平衡_______ 移动(填“正向”、“逆向”或“不”)。
丙烯的转化率与反应温度的关系如图示:

(3)有利于提高丙烯平衡转化率的反应条件有_______ ;
(4)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率_______ (填“是”或“不是”)所对应温度下的平衡转化率,理由是_______ 。
(5)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为_______ mol∙L−1∙min−1。
 2C3H3N(g)+6H2O(g)+1030kJ
2C3H3N(g)+6H2O(g)+1030kJ(1)碳在元素周期表中的位置是
(2)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。

t1时刻表示体系改变的反应条件为
丙烯的转化率与反应温度的关系如图示:

(3)有利于提高丙烯平衡转化率的反应条件有
(4)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率
(5)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为
您最近一年使用:0次
2023-04-14更新
|
559次组卷
|
4卷引用:上海市静安区2022-2023学年高三下学期二模测试化学试题
上海市静安区2022-2023学年高三下学期二模测试化学试题(已下线)上海市静安区2022-2023学年高三下学期二模变式题(原理综合题)(已下线)【知识图鉴】单元讲练测选择性必修1第2单元02基础练河北省衡水市饶阳中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
5 . 回答以下关于元素及其化合物的问题。
(1)Na原子核外有________ 种不同能量的电子,其离子最外层电子的轨道表示式________ 。
(2)相同压强下,部分元素氟化物的熔点见下表:
①试解释上表中氟化物熔点差异的原因:___________ 。
② 分子的空间构型为
分子的空间构型为___________ , 中Si—F键间的键角是
中Si—F键间的键角是___________ 。
(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的___________ (填“金属性”或“非金属性”)越强。写出能说明O、F两元素该性质强弱的化学方程式___________ 。
②根据图B预测,整个周期表中位置最低的元素应位于___________ (放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,则该元素原子核外电子排布式为___________ 。
③图C表示的意义是___________ 。
(4)元素周期表中,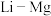 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
(1)Na原子核外有
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |  |  |  |
| 熔点/℃ | 1266 | 1534 | 183 |
②
 分子的空间构型为
分子的空间构型为 中Si—F键间的键角是
中Si—F键间的键角是(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的
②根据图B预测,整个周期表中位置最低的元素应位于
③图C表示的意义是
(4)元素周期表中,
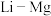 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。A. 易溶于水 易溶于水 | B. |
C. 熔点高 熔点高 | D.晶体硼为分子晶体 |
您最近一年使用:0次
解题方法
6 . 含氯物质在生产、生活中有重要作用。工业上常用次氯酸钠处理含有NO等氮氧化物的尾气,反应方程式如下:NaClO + NO + H2O —— NaCl + HNO3 (未配平)。完成下列填空。
(1)氯在元素周期表中的位置是______________________________ ,其所在主族的元素中,最高价氧化物对应的水化物酸性最强的是_______________ (填化学式)。
(2)配平上述反应方程式_______ 。
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为____________ L。
(3)NaClO溶液中存在如下关系:c(OH-)_____ c(HClO)(填“>”、“=”、或“<”)。
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。
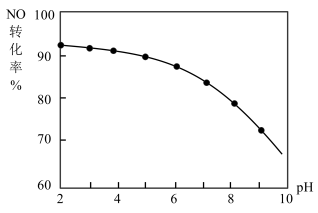
(4)NaClO溶液的初始pH越大,NO的转化率越________________ (填“高”或“低”),其原因是_____________________ 。取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
(1)氯在元素周期表中的位置是
(2)配平上述反应方程式
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为
(3)NaClO溶液中存在如下关系:c(OH-)
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。

(4)NaClO溶液的初始pH越大,NO的转化率越
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
滴加KI溶液 | 再滴加CCl4,振荡、静置 | 结论 | |
A试管 | 溶液变为棕黄色 | 溶液分层,下层显 | 氧化性强弱:(填“>”或“<”) KClO3 |
B试管 | 无现象 | 溶液分层,均无色 |
您最近一年使用:0次
7 . 苹果酸(MLA)的键线式结构为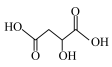 ,苹果酸经聚合生成聚苹果酸(PMLA)。
,苹果酸经聚合生成聚苹果酸(PMLA)。
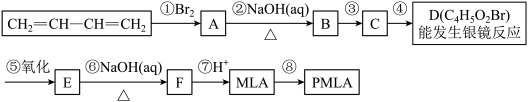
(1)写出物质的结构简式:A_______ ,D_______ 。
(2)指出合成路线中③的反应类型:③_______ 。检验D中溴元素的实验方法是_______ 。
(3)写出所有与MLA具有相同官能团的同分异构体的结构简式_______ 。
(4)写出E→F转化的化学方程式_______ 。
(5)上述转化关系中步骤③和④的顺序能否颠倒?_______ (填“能”或“不能”)。说明理由:_______ 。
(6)已知 , 设计一条从CH2=CH-CH=CH2合成阻燃剂
, 设计一条从CH2=CH-CH=CH2合成阻燃剂 的合成路线
的合成路线______ (其他无机试剂任选)。 (合成路线常用的表示方式为:A B……
B…… 目标产物)
目标产物)
 ,苹果酸经聚合生成聚苹果酸(PMLA)。
,苹果酸经聚合生成聚苹果酸(PMLA)。
(1)写出物质的结构简式:A
(2)指出合成路线中③的反应类型:③
(3)写出所有与MLA具有相同官能团的同分异构体的结构简式
(4)写出E→F转化的化学方程式
(5)上述转化关系中步骤③和④的顺序能否颠倒?
(6)已知
 , 设计一条从CH2=CH-CH=CH2合成阻燃剂
, 设计一条从CH2=CH-CH=CH2合成阻燃剂 的合成路线
的合成路线 B……
B…… 目标产物)
目标产物)
您最近一年使用:0次
名校
8 . 回答以下关于常见元素及其化合物的问题。
(1)碘元素在元素周期表中位置_____ ,碘基态原子价电子的电子排布式为_____ 。价电子共占据_____ 个轨道。
(2) 是一种与
是一种与 性质相似的气体,在
性质相似的气体,在 中C显
中C显 价,N是
价,N是 价,氮元素显负价的原因
价,氮元素显负价的原因_____ 。该分子中每个原子都达到了8电子稳定结构,写出 的电子式
的电子式_____ 。
(3)请比较氮元素与氧元素的非金属性强弱:N_____ O(填“>”、“<”或“=”),用一个化学方程式说明强弱关系_____ 。
(4)在常压下,甲醇的沸点(65℃)比甲醛的沸点(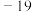 ℃)高。主要原因是
℃)高。主要原因是_____ 。
(5)一定条件下,向 溶液中滴加碱性
溶液中滴加碱性 溶液,溶液中的
溶液,溶液中的 (B元素的化合价为
(B元素的化合价为 )与
)与 反应生成纳米铁粉、
反应生成纳米铁粉、 和
和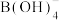 ,其离子方程式为
,其离子方程式为_____ 。
(1)碘元素在元素周期表中位置
(2)
 是一种与
是一种与 性质相似的气体,在
性质相似的气体,在 中C显
中C显 价,N是
价,N是 价,氮元素显负价的原因
价,氮元素显负价的原因 的电子式
的电子式(3)请比较氮元素与氧元素的非金属性强弱:N
(4)在常压下,甲醇的沸点(65℃)比甲醛的沸点(
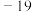 ℃)高。主要原因是
℃)高。主要原因是(5)一定条件下,向
 溶液中滴加碱性
溶液中滴加碱性 溶液,溶液中的
溶液,溶液中的 (B元素的化合价为
(B元素的化合价为 )与
)与 反应生成纳米铁粉、
反应生成纳米铁粉、 和
和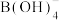 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
9 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要作用。自我国科学家发现聚集诱导发光效应(AIE)以来,AIE在发光材料、生物医药领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
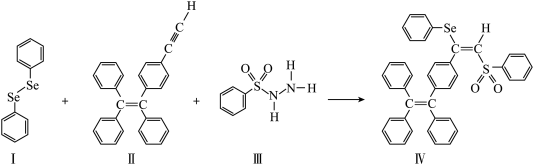
(1)基态Se原子中能量最高的电子所在的能级为___________ ,该原子轨道的形状为___________ 。Se元素在周期表中的位置是___________ 。
(2)H2Se的沸点___________ H2O的沸点(选填“>”或“<”),原因是___________ 。
(3)Se的两种含氧酸的酸性强弱为H2SeO4___________ H2SeO3(选填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒症状。 的空间结构为
的空间结构为___________ 形。
(4)关于Ⅰ、Ⅱ、Ⅲ三种反应物,下列说法正确的是___________。
(5)化合物X是潜在的热电材料之一,其晶胞结构如图1,沿x,y,z轴方向的投影均为图2。
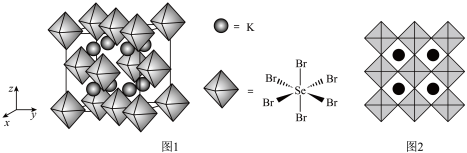
①X的化学式为________ ,其晶体类型是________ ,原子团的配位数是_________ 。
②设X的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,则X中相邻2个K之间的距离为________ nm。(列出表达式,NA为阿伏加德罗常数的值)

(1)基态Se原子中能量最高的电子所在的能级为
(2)H2Se的沸点
(3)Se的两种含氧酸的酸性强弱为H2SeO4
 的空间结构为
的空间结构为(4)关于Ⅰ、Ⅱ、Ⅲ三种反应物,下列说法正确的是___________。
| A.Ⅰ中仅有σ键 |
| B.Ⅱ易溶于水 |
| C.Ⅱ中原子的杂化类型只有sp和sp2 |
| D.Ⅰ、Ⅱ、Ⅲ所含元素中,O第一电离能最大 |
(5)化合物X是潜在的热电材料之一,其晶胞结构如图1,沿x,y,z轴方向的投影均为图2。

①X的化学式为
②设X的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,则X中相邻2个K之间的距离为
您最近一年使用:0次
10 . 分子式为C8H13O2Cl的有机物A在不同条件下分别转化为B、D或者E、C,具体转化关系如下图所示:
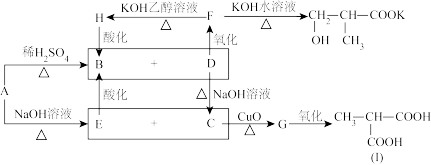
(1)用化学方程式表示下列反应:
①A与NaOH溶液共热:_______ 。
②F与KOH醇溶液共热:_______ 。
(2)检验G是否完全氧化的方法是_______ 。
(3)I与C在一定条件下反应生成环状化合物的化学方程式:_______ 。I与C在一定条件下反应生成高分子化合物的结构简式_______ 。
(4)已知J与I互为同分异构体,写出符合下列条件的J可能的结构简式_______ 。
①J不与金属钠反应,但能发生银镜反应
②1molJ能与2molNaOH发生反应
③分子中只含2种环境不同的氢原子
(5)已知: ,CH2=CHCH2OH
,CH2=CHCH2OH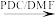 CH2=CHCOOH,写出以1,3-丁二烯和
CH2=CHCOOH,写出以1,3-丁二烯和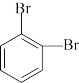 为原料制备
为原料制备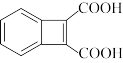 的合成路线流程图(无机试剂任选)
的合成路线流程图(无机试剂任选)_______ 。

(1)用化学方程式表示下列反应:
①A与NaOH溶液共热:
②F与KOH醇溶液共热:
(2)检验G是否完全氧化的方法是
(3)I与C在一定条件下反应生成环状化合物的化学方程式:
(4)已知J与I互为同分异构体,写出符合下列条件的J可能的结构简式
①J不与金属钠反应,但能发生银镜反应
②1molJ能与2molNaOH发生反应
③分子中只含2种环境不同的氢原子
(5)已知:
 ,CH2=CHCH2OH
,CH2=CHCH2OH CH2=CHCOOH,写出以1,3-丁二烯和
CH2=CHCOOH,写出以1,3-丁二烯和 为原料制备
为原料制备 的合成路线流程图(无机试剂任选)
的合成路线流程图(无机试剂任选)
您最近一年使用:0次



