解题方法
1 . 已知短周期元素 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示:
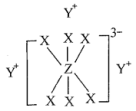
回答下列问题:
(1) 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是___________ ,写出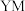 的电子式:
的电子式:___________ 。
(2) 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)在 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:___________ 。
(4)镓 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓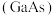 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是___________ 。
a. 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族
b. 为新型无机非金属材料
为新型无机非金属材料
c. 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为___________ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
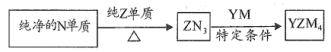
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
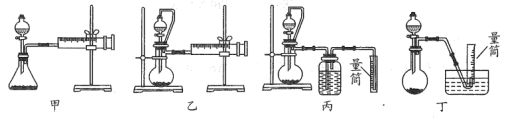
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为___________ (用代数式表示)。
 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示: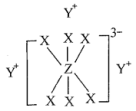
回答下列问题:
(1)
 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是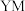 的电子式:
的电子式:(2)
 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):(3)在
 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓
 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a.
 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族b.
 为新型无机非金属材料
为新型无机非金属材料c.
 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强d.酸性:

②废弃的含
 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品
 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为
您最近一年使用:0次
解题方法
2 . X、Y、Z为短周期主族元素,且原子序数依次增大,Y、Z位于相邻主族,这三种元素形成的化合物甲为 ,化合物甲受热分解产生的物质及后续有关物质的转化关系如下图所示:
,化合物甲受热分解产生的物质及后续有关物质的转化关系如下图所示:
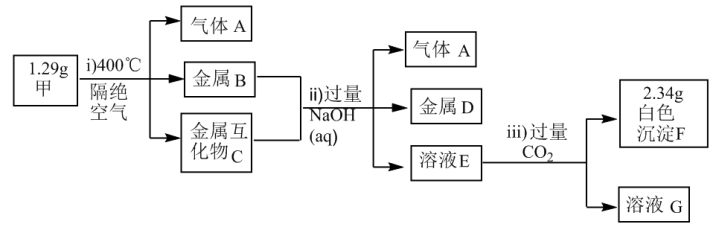
已知:金属互化物是由两种或两种以上的金属组成,其组成金属具有单质的性质。
回答下列问题:
(1)Y在元素周期表中的位置是___________ 。
(2)F受热分解生成两性氧化物,则F与烧碱溶液反应的离子方程式是___________ 。
(3)若溶液G中只有一种溶质,则该溶液中阴离子的浓度由大到小的顺序是___________ 。
(4)1.29g甲在隔绝空气的条件下,加热到400℃,完全分解产生的气体A的体积(标准状况)为___________ L。
 ,化合物甲受热分解产生的物质及后续有关物质的转化关系如下图所示:
,化合物甲受热分解产生的物质及后续有关物质的转化关系如下图所示:
已知:金属互化物是由两种或两种以上的金属组成,其组成金属具有单质的性质。
回答下列问题:
(1)Y在元素周期表中的位置是
(2)F受热分解生成两性氧化物,则F与烧碱溶液反应的离子方程式是
(3)若溶液G中只有一种溶质,则该溶液中阴离子的浓度由大到小的顺序是
(4)1.29g甲在隔绝空气的条件下,加热到400℃,完全分解产生的气体A的体积(标准状况)为
您最近一年使用:0次
名校
解题方法
3 . A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
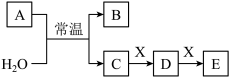
(1)若A为常见的金属单质,焰色试验呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:__ 。证明D已经氧化变质的方法是:取少量D固体溶于水中,__ 。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强。该元素在元素周期表中的位置为__ ,则X可能为__ (填代号)。
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为__ 。若X为一种最常见的造成温室效应的气体。若鉴别等浓度的D、E两种溶液,可选择的试剂为__ (填代号)。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为__ ,E是__ (填化学式)。

(1)若A为常见的金属单质,焰色试验呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强。该元素在元素周期表中的位置为
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为
您最近一年使用:0次
名校
4 . B、D、C、A、E 五种元素的原子序数顺序依次增大,其中只有E为金属元素,D、C 元素在元素周期表中位置相邻,在一定条件下,B 的单质可以分别和A、C、D 的单质化合生成甲、乙、丙化合物,C 的单质和D 的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10 个电子,下图为相互转化关系:
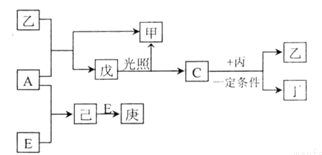
请回答下列问题:
(1)写出E 的原子结构示意图_____________ 。
(2)写出C、D 氢化物的稳定性由强到弱的顺序_________ (用化学式表示)。
(3)A、B、D 三种元素形成的化合物中其中一种可用作化肥,写该化合物的电子式__________ 。
(4)写出C与丙反应的化学反应方程式________________ 。
(5)写出工业上从海水中制取A 的离子反应方程式_______________ 。
(6)工业上通过如下转化可制得含A 元素的钾盐KAO3 晶体:
NaA溶液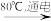 NaAO3
NaAO3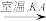 KAO3晶体
KAO3晶体
Ⅰ Ⅱ
①完成Ⅰ中反应的总化学方程式:___________________ 。
NaA+□H2O □NaAO3+□
□NaAO3+□
②Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出的原因是_____________ 。

请回答下列问题:
(1)写出E 的原子结构示意图
(2)写出C、D 氢化物的稳定性由强到弱的顺序
(3)A、B、D 三种元素形成的化合物中其中一种可用作化肥,写该化合物的电子式
(4)写出C与丙反应的化学反应方程式
(5)写出工业上从海水中制取A 的离子反应方程式
(6)工业上通过如下转化可制得含A 元素的钾盐KAO3 晶体:
NaA溶液
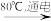 NaAO3
NaAO3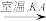 KAO3晶体
KAO3晶体Ⅰ Ⅱ
①完成Ⅰ中反应的总化学方程式:
NaA+□H2O
 □NaAO3+□
□NaAO3+□ ②Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出的原因是
您最近一年使用:0次
解题方法
5 . 五种短周期主族元素的原子半径与常见化合价的关系如图所示,E原子能量最高电子层为 M 层。

回答下列问题:
(1)A元素在元素周期表中的位置为___________ 。
(2) A、D的简单氢化物之间反应生成M,M的电子式为______ 。
(3)B分别与C、E组成的两种化合物之间能发生化合反应同时又是氧化还原反应,写出该反应的化学方程式:___________ 。
(4)在酚酞溶液中加入化合物 EDB粉末,可能观察到的现象是______ 。
(5)A和B 可组成多种化合物,其中一种化合物显红棕色,该化合物是___________ (填化学式)。
(6)向E2C溶液中通入足量D的单质,在反应后的溶液中滴加D的氢化物水溶液和BaCl2溶液,产生白色沉淀。写出E2C溶液和足量D的单质反应的离子方程式:___________ 。

回答下列问题:
(1)A元素在元素周期表中的位置为
(2) A、D的简单氢化物之间反应生成M,M的电子式为
(3)B分别与C、E组成的两种化合物之间能发生化合反应同时又是氧化还原反应,写出该反应的化学方程式:
(4)在酚酞溶液中加入化合物 EDB粉末,可能观察到的现象是
(5)A和B 可组成多种化合物,其中一种化合物显红棕色,该化合物是
(6)向E2C溶液中通入足量D的单质,在反应后的溶液中滴加D的氢化物水溶液和BaCl2溶液,产生白色沉淀。写出E2C溶液和足量D的单质反应的离子方程式:
您最近一年使用:0次
6 . 甲醇作为一种重要的化工产品广泛应用于多个领域,具有广阔的市场需求和发:展前景。目前甲醇制备的“主流”合成工艺是以合成气(CO、 、
、 )为原料,在一定温度、压力等条件下经过特定催化剂作用而制取。合成过程中的部分反应如下:
)为原料,在一定温度、压力等条件下经过特定催化剂作用而制取。合成过程中的部分反应如下:
(ⅰ)

(ⅱ)
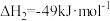
(1)制备过程中副反应 的
的
_______  。
。
(2)甲醇合成的反应机理如图所示(有催化剂M或Cu的部分,表示被M或Cu吸附的原子或原子团)。下列说法正确的是_______。
(3)通过共沉淀法制备多组添加 助剂改性的Cu-ZnO-
助剂改性的Cu-ZnO- (CZA)基甲醇合成催化剂,利用恒压反应器实验考察不同助剂添加量对合成气制甲醇催化性能的影响。分三个阶段进行评价实验,每阶段实验中合成气组分均为(体积分数):80%
(CZA)基甲醇合成催化剂,利用恒压反应器实验考察不同助剂添加量对合成气制甲醇催化性能的影响。分三个阶段进行评价实验,每阶段实验中合成气组分均为(体积分数):80%  ,13% CO、2%
,13% CO、2%  ,和5%
,和5%  。阶段Ⅰ:230℃,恒温25h;阶段Ⅱ:提高反应器温度至320℃,恒温25h;阶段Ⅲ:将温度降至230℃,恒温25h。测得各实验阶段不同CZA催化剂样品情况下,折合成相同外界条件下的CO转化率平均值如下表:
。阶段Ⅰ:230℃,恒温25h;阶段Ⅱ:提高反应器温度至320℃,恒温25h;阶段Ⅲ:将温度降至230℃,恒温25h。测得各实验阶段不同CZA催化剂样品情况下,折合成相同外界条件下的CO转化率平均值如下表:
从表中数据可知:
①CZA中助剂与基质质量比的最佳值是_______ 。其比值超过该值后,催化效果逐渐降低的原因是______________ 。
②各质量比一定的条件下,阶段Ⅲ中CO的转化率低于阶段1的原因是___ 。若阶段Ⅰ中合成气的总体积为V L,则质量比为0/10时,该阶段的v(CO)=_____ mL/h(结果保留两位小数)。
(4)在密闭容器中充有1mol CO与2mol ,在催化剂作用下反应生成甲醇。CO的平衡转化率(
,在催化剂作用下反应生成甲醇。CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示。
)与温度(T)、压强(p)的关系如图所示。_______ 。
②若A点对应容器的体积为2L,则B点对应反应状态的平衡常数K=_______  。
。
(5)ZnO其中的一种晶体结构与金刚石类似。晶胞中4个Zn占据晶胞内部4个碳原子的位置。若该晶胞参数a=n pm,则该晶胞的密度为__  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 、
、 )为原料,在一定温度、压力等条件下经过特定催化剂作用而制取。合成过程中的部分反应如下:
)为原料,在一定温度、压力等条件下经过特定催化剂作用而制取。合成过程中的部分反应如下:(ⅰ)


(ⅱ)

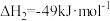
(1)制备过程中副反应
 的
的
 。
。(2)甲醇合成的反应机理如图所示(有催化剂M或Cu的部分,表示被M或Cu吸附的原子或原子团)。下列说法正确的是_______。
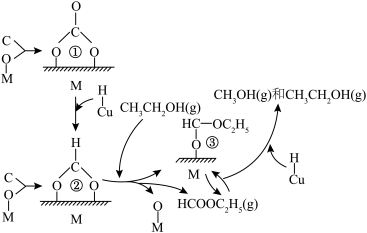
A.示意图完整表示了CO和 合成甲醇的过程 合成甲醇的过程 | B.Cu促进了原子团①到原子团②的转化 |
| C.乙醇在图示的变化过程中起到了催化剂的作用 | D.1mol 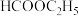 ,转化成为产物,需要2mol H ,转化成为产物,需要2mol H |
(3)通过共沉淀法制备多组添加
 助剂改性的Cu-ZnO-
助剂改性的Cu-ZnO- (CZA)基甲醇合成催化剂,利用恒压反应器实验考察不同助剂添加量对合成气制甲醇催化性能的影响。分三个阶段进行评价实验,每阶段实验中合成气组分均为(体积分数):80%
(CZA)基甲醇合成催化剂,利用恒压反应器实验考察不同助剂添加量对合成气制甲醇催化性能的影响。分三个阶段进行评价实验,每阶段实验中合成气组分均为(体积分数):80%  ,13% CO、2%
,13% CO、2%  ,和5%
,和5%  。阶段Ⅰ:230℃,恒温25h;阶段Ⅱ:提高反应器温度至320℃,恒温25h;阶段Ⅲ:将温度降至230℃,恒温25h。测得各实验阶段不同CZA催化剂样品情况下,折合成相同外界条件下的CO转化率平均值如下表:
。阶段Ⅰ:230℃,恒温25h;阶段Ⅱ:提高反应器温度至320℃,恒温25h;阶段Ⅲ:将温度降至230℃,恒温25h。测得各实验阶段不同CZA催化剂样品情况下,折合成相同外界条件下的CO转化率平均值如下表:| CZA中助剂与基质质量比 | 0/10 | 0.5/10 | 1.0/10 | 2.0/10 | 3.0/10 | |
| CO转化率(%) | 阶段Ⅰ | 72.5 | 74.2 | 67.0 | 66.8 | 56.3 |
| 阶段Ⅱ | 19.68 | 20.26 | 19.31 | 19.16 | 16.76 | |
| 阶段Ⅲ | 62.5 | 64.2 | 57.5 | 51.3 | 35.1 | |
①CZA中助剂与基质质量比的最佳值是
②各质量比一定的条件下,阶段Ⅲ中CO的转化率低于阶段1的原因是
(4)在密闭容器中充有1mol CO与2mol
 ,在催化剂作用下反应生成甲醇。CO的平衡转化率(
,在催化剂作用下反应生成甲醇。CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示。
)与温度(T)、压强(p)的关系如图所示。
②若A点对应容器的体积为2L,则B点对应反应状态的平衡常数K=
 。
。(5)ZnO其中的一种晶体结构与金刚石类似。晶胞中4个Zn占据晶胞内部4个碳原子的位置。若该晶胞参数a=n pm,则该晶胞的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
7 . 我国科学家相继发明了具有重要工业应用价值的新型非线性光学晶体BBO、LBO,又陆续发展了具有重要应用前景的深紫外非线性光学晶体KBBF、SBBO等,为我国光学事业做出了卓越贡献。
请回答下列问题:
(1)KBBF的化学式为KBe2BO3F2,KBBF晶体的棱镜耦合技术在国际上首次实现了Nd:YVO4激光的6倍频谐波光输出。
①B的价电子层排布式为___________ 。
②Y的原子序数为39,其在元素周期表中的位置为___________ 。
③KBe2BO3F2中各元素的第一电离能由小到大的顺序为___________ 。
④KBF4是合成KBBF的原料之一,其阴离子的空间构型为___________ ,与该阴离子互为等电子体的离子为___________ 。
(2)BBO晶体和LBO晶体是我国首次走向国际,并被国际上广泛应用的两种晶体。LBO晶体由Li、B、O三种元素组成,晶胞结构及沿b、c轴的投影图如图甲所示(O原子略去),晶体结构中存在(B3O7)5-基团,Li+分布在基团骨架空隙中,如图乙所示。

①LBO晶体化合物的化学式为___________ 。
②该晶体中含有的化学键有___________ ,晶体类型为___________ ,其中B采取___________ 杂化。
③已知该晶体的晶胞参数分别为apm、bpm、cpm,α=β=y=90°,则该晶体的密度ρ=___________ g·cm-3。(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)
请回答下列问题:
(1)KBBF的化学式为KBe2BO3F2,KBBF晶体的棱镜耦合技术在国际上首次实现了Nd:YVO4激光的6倍频谐波光输出。
①B的价电子层排布式为
②Y的原子序数为39,其在元素周期表中的位置为
③KBe2BO3F2中各元素的第一电离能由小到大的顺序为
④KBF4是合成KBBF的原料之一,其阴离子的空间构型为
(2)BBO晶体和LBO晶体是我国首次走向国际,并被国际上广泛应用的两种晶体。LBO晶体由Li、B、O三种元素组成,晶胞结构及沿b、c轴的投影图如图甲所示(O原子略去),晶体结构中存在(B3O7)5-基团,Li+分布在基团骨架空隙中,如图乙所示。

①LBO晶体化合物的化学式为
②该晶体中含有的化学键有
③已知该晶体的晶胞参数分别为apm、bpm、cpm,α=β=y=90°,则该晶体的密度ρ=
您最近一年使用:0次
名校
解题方法
8 . 离子液体在 的化学转化、有机合成、物质的分离提纯、电化学等领域有广泛的应用。某离子液体的结构如图所示,W、X、Y、Z是原子序数依次递增的短周期主族元素,X与Y处于同一周期,Y的原子序数等于W、X的原子序数之和,Z原子的最外层电子数与Y原子的核外电子数相等。下列说法错误的是
的化学转化、有机合成、物质的分离提纯、电化学等领域有广泛的应用。某离子液体的结构如图所示,W、X、Y、Z是原子序数依次递增的短周期主族元素,X与Y处于同一周期,Y的原子序数等于W、X的原子序数之和,Z原子的最外层电子数与Y原子的核外电子数相等。下列说法错误的是

 的化学转化、有机合成、物质的分离提纯、电化学等领域有广泛的应用。某离子液体的结构如图所示,W、X、Y、Z是原子序数依次递增的短周期主族元素,X与Y处于同一周期,Y的原子序数等于W、X的原子序数之和,Z原子的最外层电子数与Y原子的核外电子数相等。下列说法错误的是
的化学转化、有机合成、物质的分离提纯、电化学等领域有广泛的应用。某离子液体的结构如图所示,W、X、Y、Z是原子序数依次递增的短周期主族元素,X与Y处于同一周期,Y的原子序数等于W、X的原子序数之和,Z原子的最外层电子数与Y原子的核外电子数相等。下列说法错误的是
| A.原子半径:Z>X>Y>W |
| B.简单氢化物的稳定性:Y>X |
| C.X是p区元素,位于元素周期表中第14列 |
| D.氯碱工业上是通过电解某熔融盐得到Z的单质和其他产品 |
您最近一年使用:0次
名校
解题方法
9 . 有八种短周期主族元素 ,其中
,其中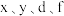 随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。
随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。 的最高价氧化物对应水化物溶液(浓度均为
的最高价氧化物对应水化物溶液(浓度均为 )的
)的 与原子序数的关系如图2所示。
与原子序数的关系如图2所示。

根据上述信息回答下列问题:
(1)g在元素周期表中的位置是___________ 。
(2)比较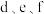 的简单离子半径大小为
的简单离子半径大小为____________________ (用离子符号表示); 的最高价氧化物对应的水化物酸性较强的是
的最高价氧化物对应的水化物酸性较强的是___________ (用化学式表示)。
(3)下列可作为比较e和f金属性强弱的依据是___________ (填字母)。
A.测等浓度相应氯化物水溶液的 B.测两种元素单质的硬度和熔、沸点
B.测两种元素单质的硬度和熔、沸点
C.比较单质作还原剂时失去的电子数目的多少D.比较单质与同浓度盐酸反应的剧烈程度
(4)由元素 组成的剧毒化合物
组成的剧毒化合物 不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为
不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为___________ 。
 ,其中
,其中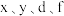 随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。
随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。 的最高价氧化物对应水化物溶液(浓度均为
的最高价氧化物对应水化物溶液(浓度均为 )的
)的 与原子序数的关系如图2所示。
与原子序数的关系如图2所示。
根据上述信息回答下列问题:
(1)g在元素周期表中的位置是
(2)比较
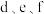 的简单离子半径大小为
的简单离子半径大小为 的最高价氧化物对应的水化物酸性较强的是
的最高价氧化物对应的水化物酸性较强的是(3)下列可作为比较e和f金属性强弱的依据是
A.测等浓度相应氯化物水溶液的
 B.测两种元素单质的硬度和熔、沸点
B.测两种元素单质的硬度和熔、沸点C.比较单质作还原剂时失去的电子数目的多少D.比较单质与同浓度盐酸反应的剧烈程度
(4)由元素
 组成的剧毒化合物
组成的剧毒化合物 不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为
不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为
您最近一年使用:0次
2021-07-25更新
|
210次组卷
|
3卷引用:河南省濮阳市第一高级中学2022-2023学年高三上学期第三次质量检测考试化学试题
河南省濮阳市第一高级中学2022-2023学年高三上学期第三次质量检测考试化学试题陕西省咸阳市2021届高三上学期高考模拟检测(一)化学试题(已下线)第五章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测
名校
10 . 芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如图转化关系:
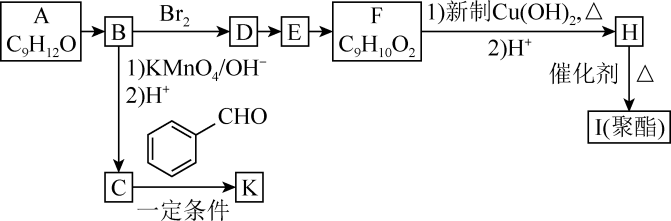
已知:
①A是芳香族化合物且苯环侧链上有两种处于不同环境下的氢原子;
②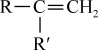
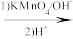
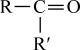 +CO2;
+CO2;
③RCOCH3+R′CHO RCOCH=CHR′+H2O。
RCOCH=CHR′+H2O。
回答下列问题:
(1)B的分子式为____ ,F具有的官能团名称是____ 。
(2)由D生成E的反应类型为____ ,由E生成F所需试剂及反应条件为____ 。
(3)K的结构简式为____ 。
(4)由H生成I的化学方程式为____ 。
(5)化合物F的同分异构体中能同时满足以下三个条件的有____ 种(不考虑立体异构)。
①能与FeCl3溶液发生显色反应;②能发生银镜反应;③苯环上有两个取代基。
其中核磁共振氢谱有6组峰,峰面积比为3:2:2:1:1:1的化合物的结构简式为____ 。
(6)糠叉丙酮( )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛( )为原料制备糠叉丙酮的合成路线
)为原料制备糠叉丙酮的合成路线____ (无机试剂任用,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。

已知:
①A是芳香族化合物且苯环侧链上有两种处于不同环境下的氢原子;
②
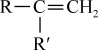
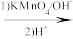
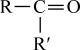 +CO2;
+CO2;③RCOCH3+R′CHO
 RCOCH=CHR′+H2O。
RCOCH=CHR′+H2O。回答下列问题:
(1)B的分子式为
(2)由D生成E的反应类型为
(3)K的结构简式为
(4)由H生成I的化学方程式为
(5)化合物F的同分异构体中能同时满足以下三个条件的有
①能与FeCl3溶液发生显色反应;②能发生银镜反应;③苯环上有两个取代基。
其中核磁共振氢谱有6组峰,峰面积比为3:2:2:1:1:1的化合物的结构简式为
(6)糠叉丙酮(
 )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛( )为原料制备糠叉丙酮的合成路线
)为原料制备糠叉丙酮的合成路线
您最近一年使用:0次
2022-03-19更新
|
735次组卷
|
6卷引用:河南省平顶山市许昌市济源市2021-2022学年高三下学期3月第二次质量检测理科综合化学试题



