名校
解题方法
1 . 乙二胺四乙酸铁钠可用于感光材料冲洗药品及漂白剂,化学式为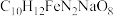 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下:
(1)基态氯原子的价层电子排布图为___________ 。
(2)下列氮原子能量最高的是___________(填标号)。
(3)EDTA的组成元素中C、N、O的第一电离能由大到小顺序为___________ (填元素符号)。碳原子的杂化轨道类型为___________ 。
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为___________ 。
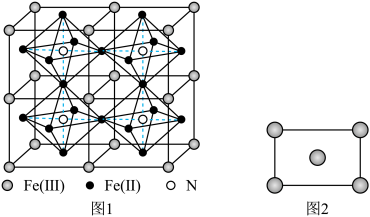
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为___________ 。___________ 区(填“s”“p”“d”或“ds”)。铁的某种晶胞沿面对角线的位置切下之后可以得到如图2所示的截面。假设铁的原子半径为a nm,则该铁晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
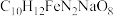 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下: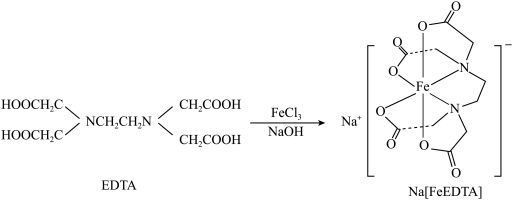
(1)基态氯原子的价层电子排布图为
(2)下列氮原子能量最高的是___________(填标号)。
A.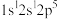 | B. | C. | D.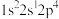 |
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为
 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023-04-23更新
|
906次组卷
|
8卷引用:福建省百校联盟2023届高三第三次模拟考试化学试题
福建省百校联盟2023届高三第三次模拟考试化学试题福建省百校联盟2023届高三下学期第三次模拟考试化学试题(已下线)押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)广西壮族自治区南宁市第二中学2023届高三下学期收网考理科综合化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题2023届广西钦州市灵山县那隆中学高三下学期5月考前冲刺保温卷理综试卷-高中化学北京市第二中学2022-2023学年高二下学期期末考试化学试题
2 . 氮及其化合物在工农业生产、生活中被广泛使用,造福人类。
I.元素 X、Y、Z 位于同一周期且原子序数依次增大,它们和氢元素、硫元素组成的含氮化合物(结构如图)常用作丝绸漂白剂。回答下列问题:
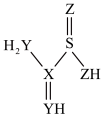
(1)硫元素在元素周期表中的位置为______ ;Y 的元素符号为______ 。
(2)下列说法错误的是______ (选填序号)。
A.原子半径:X>Y>Z
B.简单气态氢化物稳定性:Y<Z
C.该化合物可溶于水
D.该化合物中所有原子均为 8 电子稳定结构
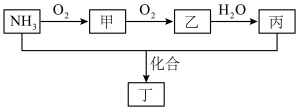
II.工业上用氨气来制造硝酸,NH3转化关系如图所示。
(3)NH3的电子式为______ 。
(4)图中,乙转化为丙的离子方程式为______ 。
(5)检验化合物丁中阳离子的方法:取少量待测液于试管中,______ ,将湿润的 红色石蕊试纸置于试管口,试纸变蓝。
(6)工业上常使用 NH3处理甲,生成无污染的 N2,则 NH3与甲完全反应的物质的量之比为______ 。
I.元素 X、Y、Z 位于同一周期且原子序数依次增大,它们和氢元素、硫元素组成的含氮化合物(结构如图)常用作丝绸漂白剂。回答下列问题:

(1)硫元素在元素周期表中的位置为
(2)下列说法错误的是
A.原子半径:X>Y>Z
B.简单气态氢化物稳定性:Y<Z
C.该化合物可溶于水
D.该化合物中所有原子均为 8 电子稳定结构
II.工业上用氨气来制造硝酸,NH3转化关系如图所示。

(3)NH3的电子式为
(4)图中,乙转化为丙的离子方程式为
(5)检验化合物丁中阳离子的方法:取少量待测液于试管中,
(6)工业上常使用 NH3处理甲,生成无污染的 N2,则 NH3与甲完全反应的物质的量之比为
您最近一年使用:0次
名校
解题方法
3 . A、B、C、X是中学化学常见化合物或单质,均由短周期元素组成,转化关系如图。请据图回答下列问题:

(1)若A、B、C中均含同一种常见金属元素R,R在C中以阴离子形式存在,B为白色胶状沉淀。
①R在元素周期表中的位置为______________ 。
②若A的溶液中混有Fe3+,当向该混合液中加入氨水,生成R(OH)n及Fe(OH)3共沉淀时,溶液中c(Fe3+)/ c(Rn+)=____ 。[已知:Fe(OH)3的 Ksp=4.00×10-38,沉淀B的Ksp=1.32×10-33 ]
(2)若A、B、C的焰色反应均为黄色,水溶液均呈碱性。
①A中含有的化学键是________________________ 。
②将672 mL(标准状况下)X通入100 mL 0.4mol·L- 1 A的溶液后,溶液中离子浓度由大到小的顺序为_______________________ 。
③自然界中存在B、C和H2O按一定比例形成的固体。取一定量该固体制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol·L-1。若取相同质量的固体加热至恒重,剩余固体的质量为_______ 。
(3)若A、B、C中均含同一种常见非金属元素,其中A为黑色固体单质。已知298K下,1mol A、1 mol B完全燃烧生成稳定氧化物放出的热量分别为393.5 kJ,283 kJ。写出该温度下A与C反应生成B的热化学方程式:______________________ 。

(1)若A、B、C中均含同一种常见金属元素R,R在C中以阴离子形式存在,B为白色胶状沉淀。
①R在元素周期表中的位置为
②若A的溶液中混有Fe3+,当向该混合液中加入氨水,生成R(OH)n及Fe(OH)3共沉淀时,溶液中c(Fe3+)/ c(Rn+)=
(2)若A、B、C的焰色反应均为黄色,水溶液均呈碱性。
①A中含有的化学键是
②将672 mL(标准状况下)X通入100 mL 0.4mol·L- 1 A的溶液后,溶液中离子浓度由大到小的顺序为
③自然界中存在B、C和H2O按一定比例形成的固体。取一定量该固体制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol·L-1。若取相同质量的固体加热至恒重,剩余固体的质量为
(3)若A、B、C中均含同一种常见非金属元素,其中A为黑色固体单质。已知298K下,1mol A、1 mol B完全燃烧生成稳定氧化物放出的热量分别为393.5 kJ,283 kJ。写出该温度下A与C反应生成B的热化学方程式:
您最近一年使用:0次
解题方法
4 . 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图(反应条件省略)

(1)若甲为气态非金属单质,丙能与人体血液中的血红蛋白结合而使人中毒,则乙的电子式为_______________ 。
(2)若甲为黄绿色气体,X为常见的金属,则X在元素周期表中的位置是_________ ,丙的水溶液呈___ (填酸性、碱性或中性),原因是:______________ (用离子方程式表示)。含amol乙的溶液溶解了一定量X后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的乙的物质的量是________ mol。
(3)若X为酸性氧化物且具有漂白性,甲溶液的焰色反应呈黄色,则标准状况下8.96 L 气体X与2 L 0.25 mol/L的甲溶液反应生成的溶液中乙和丙的物质的量浓度之比为(不考虑离子的水解)___________ 。另有和丙具有相同元素组成的物质丁,丙和丁能反应生成气体,写出该反应的离子方程式______________________ 。
(4)若X为强碱溶液,乙为白色胶状沉淀,则甲与丙反应的离子方程式为____________ 。

(1)若甲为气态非金属单质,丙能与人体血液中的血红蛋白结合而使人中毒,则乙的电子式为
(2)若甲为黄绿色气体,X为常见的金属,则X在元素周期表中的位置是
(3)若X为酸性氧化物且具有漂白性,甲溶液的焰色反应呈黄色,则标准状况下8.96 L 气体X与2 L 0.25 mol/L的甲溶液反应生成的溶液中乙和丙的物质的量浓度之比为(不考虑离子的水解)
(4)若X为强碱溶液,乙为白色胶状沉淀,则甲与丙反应的离子方程式为
您最近一年使用:0次
5 . 甲、乙、丙三种物质均由短周期元素组成,一定条件下,存在下列转化关系:甲+乙→丙+H20
(1)若丙为Na2C03,反应的化学方程式为______ (任写一个)。
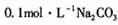 溶液中,所含的离子按物质的量浓度由大到小的顺序排列为
溶液中,所含的离子按物质的量浓度由大到小的顺序排列为______ 。
(2)若甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数。25℃、101 kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为_________ ;利用该反应设计的燃料电池中,通入甲的电极为电池的_____ (填“正极”或“负极”)。
(3)若甲、乙是同主族元素的化合物,丙为单质。
①丙所含元素在元素周期表中的位置为_______ ;
②甲与水相比,热稳定性较强的是________ (填化学式)。
(1)若丙为Na2C03,反应的化学方程式为
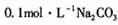 溶液中,所含的离子按物质的量浓度由大到小的顺序排列为
溶液中,所含的离子按物质的量浓度由大到小的顺序排列为(2)若甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数。25℃、101 kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为
(3)若甲、乙是同主族元素的化合物,丙为单质。
①丙所含元素在元素周期表中的位置为
②甲与水相比,热稳定性较强的是
您最近一年使用:0次
2016-12-09更新
|
304次组卷
|
3卷引用:2015届福建省普通高中高三4月质量检查理综化学试卷
11-12高三上·福建泉州·期中
6 . 图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。

回答下列问题:
(1)元素X在元素周期表中的位置为第________ 周期________ 族。
(2)一定条件下,Z能与H2反应生成ZH4,写出Z与NaOH反应的化学方程式____________
(3)写出由Y与NO、H2O生成D反应的化学方程式:_______________ 。
(4)X在高温下能与水蒸气反应,请写出该反应的化学方程式:_____________
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
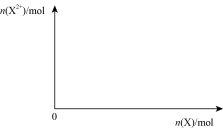
________________

回答下列问题:
(1)元素X在元素周期表中的位置为第
(2)一定条件下,Z能与H2反应生成ZH4,写出Z与NaOH反应的化学方程式
(3)写出由Y与NO、H2O生成D反应的化学方程式:
(4)X在高温下能与水蒸气反应,请写出该反应的化学方程式:
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。

您最近一年使用:0次
7 . X、W、Y、Z、M、Q、R、L是元素周期表前四周期元素,且原子序数依次增大,其相关信息如表:
请用化学用语填空:
(1)X元素在元素周期表的位置:_______ 。
(2)请写出Q元素基态原子核外电子排布式:_______ 。
(3)X、Y、Z、M四种元素的原子半径由小到大的顺序是_______ (用元素符号表示)。
(4)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是_______ 。
(5)与M元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:_______ ;M、Z晶体都是由金属原子密置层在三维空间堆积而成(最密堆积),M的熔点(930K)比Z的熔点(371K)高,原因是_______ ;已知T元素和Q元素的电负性分别为1.5和3.0,则它们形成的化合物是_______ (填“离子化合物”或“共价化合物”)。
(6)硒(Se)是人体必需的微量元素,与Y为同一主族元素,Se原子比Y原子多两个电子层,则Se的原子序数为_______ ,其最高价氧化物对应的水化物化学式为_______ 。
(7)X射线衍射法可以测定某些分子结构,NH3分子结构为_______ ;其电子式为_______ ,中心原子的杂化类型_______ 。
(8)L的基态原子价电子轨道表示式为_______ ;在周期表中该原子排在_______ 区。
(9)水在液态时,几个水分子可以形成缔合水分子(H2O)n的原因是水分子之间存在_______ 。
(10)三氟乙酸乙酯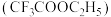 是制备某种抗新冠病毒药物的原料,合成该分子所需的原料三氟乙酸的酸性
是制备某种抗新冠病毒药物的原料,合成该分子所需的原料三氟乙酸的酸性_______ 乙酸的酸性(填“大于”或“小于”),请理论解释原因_______ 。
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期元素中最大 |
| M | 逐级电离能 依次为578、1817、2745、11575、14830、18376 依次为578、1817、2745、11575、14830、18376 |
| Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| L | 基态原子核外有四个电子层,最外层只有一个电子,其它电子层均排满电子 |
(1)X元素在元素周期表的位置:
(2)请写出Q元素基态原子核外电子排布式:
(3)X、Y、Z、M四种元素的原子半径由小到大的顺序是
(4)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是
(5)与M元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:
(6)硒(Se)是人体必需的微量元素,与Y为同一主族元素,Se原子比Y原子多两个电子层,则Se的原子序数为
(7)X射线衍射法可以测定某些分子结构,NH3分子结构为
(8)L的基态原子价电子轨道表示式为
(9)水在液态时,几个水分子可以形成缔合水分子(H2O)n的原因是水分子之间存在
(10)三氟乙酸乙酯
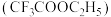 是制备某种抗新冠病毒药物的原料,合成该分子所需的原料三氟乙酸的酸性
是制备某种抗新冠病毒药物的原料,合成该分子所需的原料三氟乙酸的酸性
您最近一年使用:0次
名校
解题方法
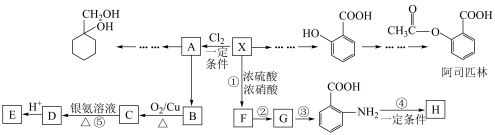
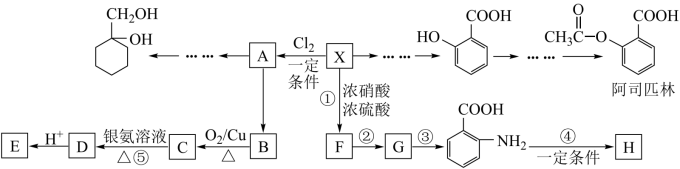
8 . 某芳香烃X(C7H8)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
已知:Ⅰ.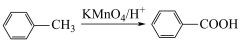
Ⅱ.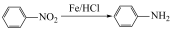 (苯胺,易被氧化)
(苯胺,易被氧化)
回答下列问题:
(1)X的结构简式为___________ ;F的名称为___________ 。
(2)反应②的反应类型属于___________ 。
(3)反应④的化学方程式为___________ 。
(4)阿司匹林(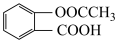 )有多种同分异构体,其中属于二元酸的芳香族化合物中核磁共振氢谱有4组峰,峰值面积比为3∶2∶2∶1的结构简式为
)有多种同分异构体,其中属于二元酸的芳香族化合物中核磁共振氢谱有4组峰,峰值面积比为3∶2∶2∶1的结构简式为___________ (写一种即可)。
(5)用以下合成反应流程图表示出由有机物A和其他无机物合成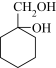 的方案。
的方案。
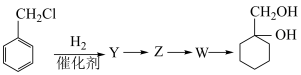
Z的结构简式为___________ ;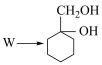 所需要的试剂和条件是
所需要的试剂和条件是___________ 。

已知:Ⅰ.
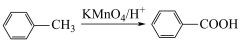
Ⅱ.
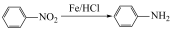 (苯胺,易被氧化)
(苯胺,易被氧化)回答下列问题:
(1)X的结构简式为
(2)反应②的反应类型属于
(3)反应④的化学方程式为
(4)阿司匹林(
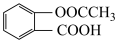 )有多种同分异构体,其中属于二元酸的芳香族化合物中核磁共振氢谱有4组峰,峰值面积比为3∶2∶2∶1的结构简式为
)有多种同分异构体,其中属于二元酸的芳香族化合物中核磁共振氢谱有4组峰,峰值面积比为3∶2∶2∶1的结构简式为(5)用以下合成反应流程图表示出由有机物A和其他无机物合成
 的方案。
的方案。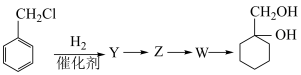
Z的结构简式为
 所需要的试剂和条件是
所需要的试剂和条件是
您最近一年使用:0次
名校
9 . 某芳香烃X(C7H8)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
(1)X的结构简式为_______ ;F的名称为_______ 。
(2)反应②的反应类型属于_______ 。C中官能团的名称是_______ 。
(3)反应④的化学方程式为_______ 。
(4)阿司匹林(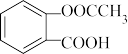 )有多种同分异构体,其中属于二元酸的芳香族化合物共有
)有多种同分异构体,其中属于二元酸的芳香族化合物共有_______ 种;核磁共振氢谱有4组峰,峰值面积比为3∶2∶2∶1的结构简式为_______ (写一种即可)。
(5)请用合成反应流程图表示出由有机物A和其他无机物合成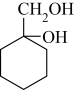 最合理的方案(不超过4步),合成路线为
最合理的方案(不超过4步),合成路线为_______ 。
已知:I.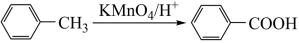
Ⅱ. 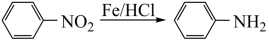 (苯胺,易被氧化)
(苯胺,易被氧化)
(1)X的结构简式为
(2)反应②的反应类型属于
(3)反应④的化学方程式为
(4)阿司匹林(
 )有多种同分异构体,其中属于二元酸的芳香族化合物共有
)有多种同分异构体,其中属于二元酸的芳香族化合物共有(5)请用合成反应流程图表示出由有机物A和其他无机物合成
 最合理的方案(不超过4步),合成路线为
最合理的方案(不超过4步),合成路线为
您最近一年使用:0次
2022-04-18更新
|
545次组卷
|
3卷引用:福建省龙岩第一中学2022届高三下学期第一次模拟考试化学试题
福建省龙岩第一中学2022届高三下学期第一次模拟考试化学试题(已下线)专项18 有机化学基础综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)2024届宁夏银川市唐徕中学高三下学期三模理科综合试题-高中化学
10 . 已知短周期主族元素X、Y、Z、W在周期表中的位置关系如图所示,其中W元素的原子半径是同周期中最小的。回答下列问题:
(1)W在元素周期表中的位置___ 。
(2)上述4种元素中最高价氧化物对应的水化物酸性最强的是___ (填化学式)。
(3)X的简单气态氢化物的电子式为___ 。
(4)由Na和Y可形成具有漂白作用的物质,该物质中含有的化学键类型为___ 。
(5)取0.1mol·L-1的Na2Z溶液进行下列实验:
①用玻璃棒蘸取Na2Z溶液滴在pH试纸上,试纸呈蓝色,原因是___ (用离子方程式表示)。
②某温度下,将0.1mol·L-1的Na2Z溶液逐滴加入10mL0.1mol·L-1的CuW2溶液中,滴加过程中溶液中的Cu2+浓度与加入的Na2Z溶液的体积(V)关系如图所示。b点溶液中Na+、Z2-、W-、OH-离子浓度由大到小的顺序是___ (离子用元素符号表示);
该温度下,Ksp(CuZ)=___ 。

| X | Y | |
| Z | W |
(1)W在元素周期表中的位置
(2)上述4种元素中最高价氧化物对应的水化物酸性最强的是
(3)X的简单气态氢化物的电子式为
(4)由Na和Y可形成具有漂白作用的物质,该物质中含有的化学键类型为
(5)取0.1mol·L-1的Na2Z溶液进行下列实验:
①用玻璃棒蘸取Na2Z溶液滴在pH试纸上,试纸呈蓝色,原因是
②某温度下,将0.1mol·L-1的Na2Z溶液逐滴加入10mL0.1mol·L-1的CuW2溶液中,滴加过程中溶液中的Cu2+浓度与加入的Na2Z溶液的体积(V)关系如图所示。b点溶液中Na+、Z2-、W-、OH-离子浓度由大到小的顺序是
该温度下,Ksp(CuZ)=

您最近一年使用:0次



