解题方法
1 . 铜碘杂化团簇化合物具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如图:SbCl3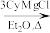 SbCy3(Cy代表—C6H11)
SbCy3(Cy代表—C6H11)

(1)已知Sb的原子序数为51,它在元素周期表中的位置是第五周期第ⅤA族,属于___ (填“s”、“p”、“d”或“ds”)区元素。
(2)SbCy3只能与一个Cu+配位的原因是___ 。
(3)已知SbCl3(三氯化锑)是易挥发的物质,由此判断SbCl3是___ 晶体,预测SbCl3的VSEPR模型名称为___ 。
(4)Et2O(即CH3CH2OCH2CH3,乙醚)中氧原子以及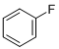 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是___ , ___ 。
(5)已知上述铜硬杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式___ ,设阿伏加德罗常数的值为NA,已知SbCy3的相对分子质量是371,则该铜碘杂化团簇的密度___ g/cm3。
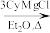 SbCy3(Cy代表—C6H11)
SbCy3(Cy代表—C6H11)
(1)已知Sb的原子序数为51,它在元素周期表中的位置是第五周期第ⅤA族,属于
(2)SbCy3只能与一个Cu+配位的原因是
(3)已知SbCl3(三氯化锑)是易挥发的物质,由此判断SbCl3是
(4)Et2O(即CH3CH2OCH2CH3,乙醚)中氧原子以及
 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(5)已知上述铜硬杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式
您最近一年使用:0次
名校
解题方法
2 . 已知A、B、C、D、E、F为原子序数依次增大的前36号元素,A的一种同位素原子无中子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D的基态原子2p轨道中含有两种不同自旋方向的电子,且电子数之比为3:1;E为短周期中电负性最小的元素;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。含有Y元素的某种钙盐是漂白粉的有效成分。Z元素正三价阳离子的3d轨道为半充满状态。用于回答下列问题(用元素符号或化学式表示):
(1)F在元素周期表中位置为___________ 区。基态原子与F元素同周期且最外层电子数相等元素还有___________ (填元素符号)。元素Z与F的第二电离能 的原因是
的原因是___________ 。
(2)D和E可形成一种既含有共价键又含有离子键的化合物,该化合物的电子式为___________ 。
(3)比较B、C、D最简单气态氢化物的稳定性大到小顺序为:___________ (用分子式表示)。
(4) 分子可与
分子可与 离子结合成
离子结合成 离子,这个过程中发生改变是
离子,这个过程中发生改变是___________ 。(填字母)。
a.微粒的空间构型 b.C原子的杂化类型
c.A-C-A的键角 d.微粒的电子数
(5)某F与Y形成的化合物的晶胞如图所示(黑点代表F原子)。___________ 。
②已知该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中F原子和Y原子之间的最短距离为
,则该晶体中F原子和Y原子之间的最短距离为___________ cm(只写计算式)(F原子位于体对角线上)。
(6)E的一种晶体如图甲、乙所示,若按甲虚线方向切乙得到的截面图是___________(填字母)。
(1)F在元素周期表中位置为
 的原因是
的原因是(2)D和E可形成一种既含有共价键又含有离子键的化合物,该化合物的电子式为
(3)比较B、C、D最简单气态氢化物的稳定性大到小顺序为:
(4)
 分子可与
分子可与 离子结合成
离子结合成 离子,这个过程中发生改变是
离子,这个过程中发生改变是a.微粒的空间构型 b.C原子的杂化类型
c.A-C-A的键角 d.微粒的电子数
(5)某F与Y形成的化合物的晶胞如图所示(黑点代表F原子)。

②已知该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中F原子和Y原子之间的最短距离为
,则该晶体中F原子和Y原子之间的最短距离为(6)E的一种晶体如图甲、乙所示,若按甲虚线方向切乙得到的截面图是___________(填字母)。

A.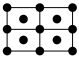 | B.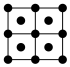 | C.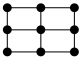 | D. |
您最近一年使用:0次
名校
解题方法
3 . 1869年门捷列夫根据当时已有的元素编制出第一张元素周期表,他在适当的位置预留下空格,并预言了新元素的性质。后来锗与镓的发现对元素周期律有力的证明。锗、镓元素能形成一些无机化合物(如Na2GeO3、GaCl3、GaN等),回答下列问题:
(1)基态锗原子价层电子排布式为___________ ,Na2GeO3中锗原子的杂化方式为___________ 。
(2)GaCl3分子的空间结构为___________ ,与其互为等电子体的一种常见离子是___________ 。(填化学式)
(3)化学家利用图丁反应首次成功合成纯碳环C18。下列说法正确的是___________(填字母标号)。
(4)在药物化学中,某些饱和碳上的氢原子被甲基替换后,对分子的药性、代谢等产生显著影响作用,这种现象被称为“甲基化效应”,例如:

以上A、B两种分子结构中属于手性分子的是___________ (填字母序号)
(5)GaN被誉为21世纪引领5 G时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,其晶胞参数: ,
,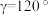 。已知:该晶体的密度为
。已知:该晶体的密度为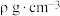 ,晶胞底边边长为acm,高为bcm,则阿伏加德罗常数为
,晶胞底边边长为acm,高为bcm,则阿伏加德罗常数为___________  (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
(1)基态锗原子价层电子排布式为
(2)GaCl3分子的空间结构为
(3)化学家利用图丁反应首次成功合成纯碳环C18。下列说法正确的是___________(填字母标号)。

| A.C24O6和C18均为非极性分子 |
| B.C22O4分子中碳原子的杂化方式有3种 |
| C.C20O2晶体中所含σ键类型为p-pσ键和s-pσ键有 |
| D.图丁中涉及的物质都是分子晶体 |
(4)在药物化学中,某些饱和碳上的氢原子被甲基替换后,对分子的药性、代谢等产生显著影响作用,这种现象被称为“甲基化效应”,例如:

以上A、B两种分子结构中属于手性分子的是
(5)GaN被誉为21世纪引领5 G时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,其晶胞参数:
 ,
,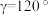 。已知:该晶体的密度为
。已知:该晶体的密度为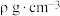 ,晶胞底边边长为acm,高为bcm,则阿伏加德罗常数为
,晶胞底边边长为acm,高为bcm,则阿伏加德罗常数为 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
4 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置___________ ;C元素和F元素的电负性比较,较小的是___________ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为___________ ,B元素所形成的单质分子中σ键与π键数目之比为___________ 。
(3)F元素原子的价电子的轨道表示式是___________ ;G的高价阳离子的溶液与H单质反应的离子方程式为___________ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性,试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式___________ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为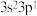 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为
(3)F元素原子的价电子的轨道表示式是
您最近一年使用:0次
5 . Ⅰ.我国科学家在铁基高温超导体的研究上取得重大突破,发现了该超导体是由Fe、Ba、As三种元素组成,这为进一步理解超导配对机理及其与电荷密度波的关系提供了重要实验证据。回答下列问题:
(1)As元素属于元素周期表的________ 区元素,其价电子排布式是________ 。
(2)基态Fe原子核外电子排布式为________ 。 的稳定性强于
的稳定性强于 ,从微观角度解释其原因为
,从微观角度解释其原因为________ 。
Ⅱ.某元素原子的最外电子层只有一个电子,该电子的电子层数n=4。请回答下列问题:
(3)符合上述条件的元素共有________ 种。
(4)在符合上述条件的元素中,原子序数最小的在元素周期表中的________ 区(用符号填空),原子序数最大的在周期表位置________ 。
(5)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为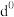 或
或 排布时,无颜色,为
排布时,无颜色,为 排布时,有颜色,如
排布时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,
________ (填“无”或“有”)颜色。
(1)As元素属于元素周期表的
(2)基态Fe原子核外电子排布式为
 的稳定性强于
的稳定性强于 ,从微观角度解释其原因为
,从微观角度解释其原因为Ⅱ.某元素原子的最外电子层只有一个电子,该电子的电子层数n=4。请回答下列问题:
(3)符合上述条件的元素共有
(4)在符合上述条件的元素中,原子序数最小的在元素周期表中的
(5)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为
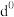 或
或 排布时,无颜色,为
排布时,无颜色,为 排布时,有颜色,如
排布时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,
您最近一年使用:0次
名校
解题方法
6 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置_______ ;C元素和F元素的电负性比较,较小的是_______ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为_______ ,B元素所形成的单质分子中σ键与π键数目之比为_______ 。
(3)F元素原子的价电子的轨道表示式是_______ ;G的高价阳离子的溶液与H单质反应的离子方程式为_______ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性。试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式_______ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为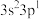 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为
(3)F元素原子的价电子的轨道表示式是
您最近一年使用:0次
2023-04-04更新
|
125次组卷
|
2卷引用:福建省德化第一中学2022-2023学年高二下学期第一次月考化学试题
7 . 已知A、B、C、D、E、F为原子序数依次增大的前36号元素,A的一种同位素原子无中子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D的基态原子2p轨道中含有两种不同自旋方向的电子,且电子数之比为3∶1;E为短周期中电负性最小的元素;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。回答下列问题(用元素符号或化学式表示):
(1)F在元素周期表中位置为_______ ;_______ 区(填s、p、d、f或ds)。
(2)D和E可形成一种既含有共价键又含有离子键的化合物,该化合物的电子式为_______ 。
(3)比较B、C、D最简单气态氢化物的稳定性大到小顺序为:_______ (用分子式表示)
(4)CA3分子可以与A+离子结合成CA 离子,这个过程中发生改变的是
离子,这个过程中发生改变的是_______ 。(填字母)。
a.微粒的空间构型 b.C原子的杂化类型
c.A-C-A的键角 d.微粒的电子数
(1)F在元素周期表中位置为
(2)D和E可形成一种既含有共价键又含有离子键的化合物,该化合物的电子式为
(3)比较B、C、D最简单气态氢化物的稳定性大到小顺序为:
(4)CA3分子可以与A+离子结合成CA
 离子,这个过程中发生改变的是
离子,这个过程中发生改变的是a.微粒的空间构型 b.C原子的杂化类型
c.A-C-A的键角 d.微粒的电子数
您最近一年使用:0次
名校
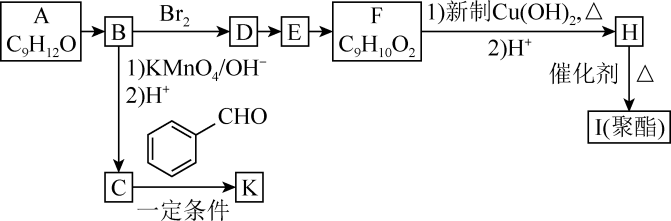
8 . 芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如图转化关系:
已知:
①A是芳香族化合物且苯环侧链上有两种处于不同环境下的氢原子;
②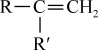
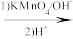
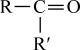 +CO2;
+CO2;
③RCOCH3+R′CHO RCOCH=CHR′+H2O。
RCOCH=CHR′+H2O。
回答下列问题:
(1)B的分子式为____ ,F具有的官能团名称是____ 。
(2)由D生成E的反应类型为____ ,由E生成F所需试剂及反应条件为____ 。
(3)K的结构简式为____ 。
(4)由H生成I的化学方程式为____ 。
(5)化合物F的同分异构体中能同时满足以下三个条件的有____ 种(不考虑立体异构)。
①能与FeCl3溶液发生显色反应;②能发生银镜反应;③苯环上有两个取代基。
其中核磁共振氢谱有6组峰,峰面积比为3:2:2:1:1:1的化合物的结构简式为____ 。
(6)糠叉丙酮( )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛( )为原料制备糠叉丙酮的合成路线
)为原料制备糠叉丙酮的合成路线____ (无机试剂任用,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。

已知:
①A是芳香族化合物且苯环侧链上有两种处于不同环境下的氢原子;
②
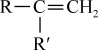
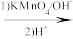
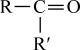 +CO2;
+CO2;③RCOCH3+R′CHO
 RCOCH=CHR′+H2O。
RCOCH=CHR′+H2O。回答下列问题:
(1)B的分子式为
(2)由D生成E的反应类型为
(3)K的结构简式为
(4)由H生成I的化学方程式为
(5)化合物F的同分异构体中能同时满足以下三个条件的有
①能与FeCl3溶液发生显色反应;②能发生银镜反应;③苯环上有两个取代基。
其中核磁共振氢谱有6组峰,峰面积比为3:2:2:1:1:1的化合物的结构简式为
(6)糠叉丙酮(
 )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛( )为原料制备糠叉丙酮的合成路线
)为原料制备糠叉丙酮的合成路线
您最近一年使用:0次
2022-03-19更新
|
735次组卷
|
6卷引用:福建省福建师范大学附属中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
9 . 某油脂厂废弃的油脂加氢镍催化剂 主要含金属 、
、 、
、 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(
及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
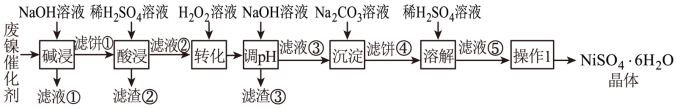
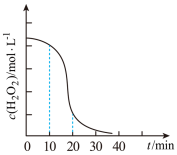
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是①溶解铝及其氧化物,②___________ 。
(2)“转化”过程中反应的离子方程式为___________ ,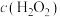 随时间t的变化关系如图所示,反应开始10~20min内
随时间t的变化关系如图所示,反应开始10~20min内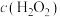 迅速减小,原因可能是
迅速减小,原因可能是___________ (不考虑溶液温度变化)。
(3)为除去溶液中的 、
、 元素,“转化”后加入适量NaOH溶液调节pH,也可以用___________(从下面四个选项选择)代替。
元素,“转化”后加入适量NaOH溶液调节pH,也可以用___________(从下面四个选项选择)代替。
(4)利用上述表格数据,计算 的
的
___________ 。如果“转化”后的溶液中 浓度为
浓度为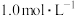 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是___________ 。
(5)硫酸镍结晶水合物的形态与温度的关系如下表。
从滤液⑤中获得稳定 晶体的操作1依次是蒸发浓缩、
晶体的操作1依次是蒸发浓缩、___________ 、过滤、洗涤、干燥。
(6)分离出 晶体后的剩余液体要循环使用,则应该回流到流程中滤液
晶体后的剩余液体要循环使用,则应该回流到流程中滤液___________ 的位置(填②、③、⑤),其目的是___________ 。
 、
、 、
、 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(
及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
金属离子 |
|
|
|
|
开始沉淀时( | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时( | 8.7 | 4.7 | 3.2 | 9.0 |

回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是①溶解铝及其氧化物,②
(2)“转化”过程中反应的离子方程式为
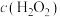 随时间t的变化关系如图所示,反应开始10~20min内
随时间t的变化关系如图所示,反应开始10~20min内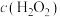 迅速减小,原因可能是
迅速减小,原因可能是(3)为除去溶液中的
 、
、 元素,“转化”后加入适量NaOH溶液调节pH,也可以用___________(从下面四个选项选择)代替。
元素,“转化”后加入适量NaOH溶液调节pH,也可以用___________(从下面四个选项选择)代替。A. | B. | C. | D.氨水 |
 的
的
 浓度为
浓度为 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是(5)硫酸镍结晶水合物的形态与温度的关系如下表。
温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
晶体形态 |
|
| 多种结晶水合物 |
|
 晶体的操作1依次是蒸发浓缩、
晶体的操作1依次是蒸发浓缩、(6)分离出
 晶体后的剩余液体要循环使用,则应该回流到流程中滤液
晶体后的剩余液体要循环使用,则应该回流到流程中滤液
您最近一年使用:0次
2022-12-25更新
|
364次组卷
|
2卷引用:福建省福州市福建师范大学附属中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
10 . D是一种催眠药,F是一种香料,它们的合成路线如下:
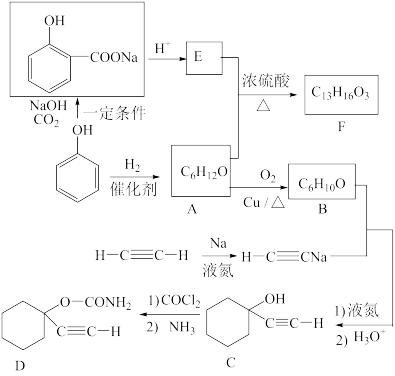
(1)A的化学名称是_________ ,C中含氧官能团的名称为_______________ 。
(2)F的结构简式为_______________ ,A和E生成F的反应类型为_______________ 。
(3)B与乙炔钠合成C的反应类型(酸化前)是______________ ;写出由C合成D的第二个反应的化学方程式___________________________________ 。
(4)同时满足下列条件的E的同分异构体有__________ 种(不含立体异构)。
①遇FeCl3溶液发生显色反应; ②能发生银镜反应
(5)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_________

(1)A的化学名称是
(2)F的结构简式为
(3)B与乙炔钠合成C的反应类型(酸化前)是
(4)同时满足下列条件的E的同分异构体有
①遇FeCl3溶液发生显色反应; ②能发生银镜反应
(5)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
您最近一年使用:0次
2020-05-03更新
|
211次组卷
|
2卷引用:福建省龙岩市武平县第一中学2020-2021学年高二上学期10月月考化学试题


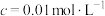 )的pH
)的pH )的pH
)的pH



