名校
解题方法
1 . 我国科学家在铁基高温超导体的研究上取得重大突破,发现了该超导体是由Fe、Al、S、Se、Mn等元素组成,这为进一步理解超导配对机理提供了重要实验证据。回答下列问题:
(1)基态S原子的原子核外有共有_____ 种能量不同的电子,其能量最高的电子电子云轮廓图为_____ 形。
(2)铁在元素周期表中的位置是________ ,其价电子排布式是________ 。
(3)在第四周期中未成对电子数最多的元素是________ (填元素名称)。 也是第四周期元素,与O同族,是动物和人体所必需的微量元素之一,写出O、Se元素对应简单氢化物热稳定性的关系
也是第四周期元素,与O同族,是动物和人体所必需的微量元素之一,写出O、Se元素对应简单氢化物热稳定性的关系______ (用化学式表示)。
(4)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+_____ (填“无”或“有”)颜色。
(5)与Al元素成“对角线规则”关系的短周期元素Be的最高价氧化物的水化物具有两性,写出该两性物质与氢氧化钠溶液反应的化学方程式:___________ 。
(1)基态S原子的原子核外有共有
(2)铁在元素周期表中的位置是
(3)在第四周期中未成对电子数最多的元素是
 也是第四周期元素,与O同族,是动物和人体所必需的微量元素之一,写出O、Se元素对应简单氢化物热稳定性的关系
也是第四周期元素,与O同族,是动物和人体所必需的微量元素之一,写出O、Se元素对应简单氢化物热稳定性的关系(4)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+
(5)与Al元素成“对角线规则”关系的短周期元素Be的最高价氧化物的水化物具有两性,写出该两性物质与氢氧化钠溶液反应的化学方程式:
您最近一年使用:0次
名校
2 . 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下:
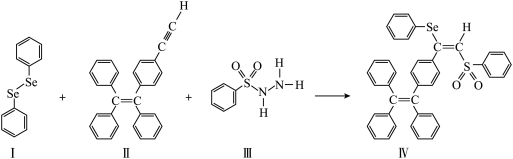
(1) 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为___________ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是___________ 。
(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有___________ 。
A.Ⅰ中仅有 键 B.Ⅰ中的
键 B.Ⅰ中的 键为非极性共价键 C.Ⅱ易溶于水
键为非极性共价键 C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型只有 与
与 E.Ⅰ~Ⅲ含有的元素中,O电负性最大
E.Ⅰ~Ⅲ含有的元素中,O电负性最大
(4) 的杂化类型为
的杂化类型为___________ 。
(5)硒的两种化合物的键角大小为SeO3___________ SeO (填“>”或“<”或者“=”),原因是:
(填“>”或“<”或者“=”),原因是:___________ 。
(6)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是___________ 。

以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为(1, ,
, ),b点锰原子坐标为(0,
),b点锰原子坐标为(0, ,0),则c点锰原子坐标为
,0),则c点锰原子坐标为___________ 。MnS的密度为ρg/cm3,摩尔质量为M g/mol,NA表示阿伏加德罗常数的值,则晶胞中S原子距离相等且最近的S原子的距离为___________ nm(列式表示)。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下:
(1)
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有
A.Ⅰ中仅有
 键 B.Ⅰ中的
键 B.Ⅰ中的 键为非极性共价键 C.Ⅱ易溶于水
键为非极性共价键 C.Ⅱ易溶于水D.Ⅱ中原子的杂化轨道类型只有
 与
与 E.Ⅰ~Ⅲ含有的元素中,O电负性最大
E.Ⅰ~Ⅲ含有的元素中,O电负性最大(4)
 的杂化类型为
的杂化类型为(5)硒的两种化合物的键角大小为SeO3
 (填“>”或“<”或者“=”),原因是:
(填“>”或“<”或者“=”),原因是:(6)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是

以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为(1,
 ,
, ),b点锰原子坐标为(0,
),b点锰原子坐标为(0, ,0),则c点锰原子坐标为
,0),则c点锰原子坐标为
您最近一年使用:0次
3 . 以芳香烃X(C7H8)为初始原料设计了如下转化关系(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为 。
。

已知:Ⅰ.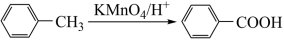
Ⅱ.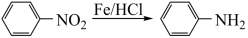 (苯胺,易被氧化)
(苯胺,易被氧化)
回答下列问题:
(1)X的名称为_______ ;C的结构简式为_______ 。
(2)A→B的反应条件和试剂是_______ ;G中官能团的名称是_______ 。
(3)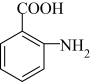
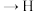 的化学方程式为
的化学方程式为_______ 。
(4)阿司匹林的同分异构体中属于二元羧酸的芳香族化合物有_______ 种(不含立体异构),其中核磁共振氢谱有5组峰,峰值面积比为2∶2∶2∶1∶1的结构简式为_______ (写一种即可)。
(5)请用合成反应流程图表示出由有机物A和其他无机物合成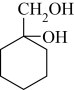 最合理的方案(不超过4步),合成路线为
最合理的方案(不超过4步),合成路线为_______ 。
 。
。
已知:Ⅰ.
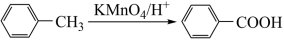
Ⅱ.
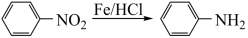 (苯胺,易被氧化)
(苯胺,易被氧化)回答下列问题:
(1)X的名称为
(2)A→B的反应条件和试剂是
(3)

 的化学方程式为
的化学方程式为(4)阿司匹林的同分异构体中属于二元羧酸的芳香族化合物有
(5)请用合成反应流程图表示出由有机物A和其他无机物合成
 最合理的方案(不超过4步),合成路线为
最合理的方案(不超过4步),合成路线为
您最近一年使用:0次
名校
解题方法
4 . 现有部分短周期主族元素的性质或原子结构如表所示:
A、B、D三种单质(单质分别由X、Y、Z元素组成)和甲、乙、丙、丁四种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种高能燃料,常用于火箭推进剂,1个丁分子中含有18个电子,其组成元素与丙相同。
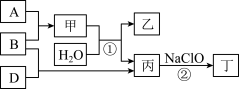
请回答:
(1)元素X在周期表中的位置是_______ ,元素Y的原子结构示意图为_______ 。
(2)单质B电子式为_______ ,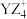 中心原子杂化类型为
中心原子杂化类型为_______ ,空间结构为_______ 。
(3)分子中的大π键可以用符号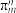 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则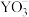 中中心原子价层电子对数为
中中心原子价层电子对数为_______ ,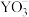 的大π键可表示为
的大π键可表示为_______ 。
(4)丙中所包含的化学键类型有_______ (填字母序号)。
A.离子键 B.极性共价键 C.非极性共价键
(5)反应①的化学方程式为_______ 。
(6)反应②中,0.5molNaClO参加反应时,转移1mol电子,反应②的离子方程式为:_______ 。
| 元素编号 | 元素性质或原子结构 |
| X | 其电子层上M层与K层上的电子数相等 |
| Y | 其最简单氢化物丙的水溶液呈碱性 |
| Z | 其原子半径在所有原子中最小 |

请回答:
(1)元素X在周期表中的位置是
(2)单质B电子式为
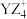 中心原子杂化类型为
中心原子杂化类型为(3)分子中的大π键可以用符号
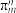 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则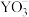 中中心原子价层电子对数为
中中心原子价层电子对数为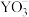 的大π键可表示为
的大π键可表示为(4)丙中所包含的化学键类型有
A.离子键 B.极性共价键 C.非极性共价键
(5)反应①的化学方程式为
(6)反应②中,0.5molNaClO参加反应时,转移1mol电子,反应②的离子方程式为:
您最近一年使用:0次
2023-01-13更新
|
167次组卷
|
2卷引用:重庆西南大学附属中学校2022-2023学年高二上学期1月线上定时检测化学试题
名校
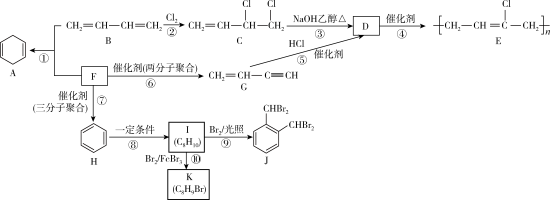
5 . 有机物之间的转化关系如图所示:
已知: +NaOH
+NaOH
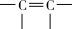 +NaX+H2O(X=Cl或Br)
+NaX+H2O(X=Cl或Br)
按要求回答问题:
(1)B中所含官能团的名称是____ ,由C生成D的化学方程式为____ 。
(2)E的链节(顺式结构)为____ ,若E的平均相对分子质量为35400,则其平均聚合度n=____ 。
(3)已知F与H的含碳量相同,F的分子式为____ 。2,3—二甲基—1,3—丁二烯和丙炔在一定条件下发生与反应①原理相似的反应,形成六元环状化合物,写出该产物的结构简式____ 。
(4)I的化学名称是____ ,其分子中最多有____ 个原子共面。
(5)⑩的反应类型为____ ,K的结构有____ 种。在反应⑨的副产物中,与J互为同分异构体的化合物的结构简式为____ 。
(6)为合成异丙烯基苯甲酸,某化学兴趣小组设计了如图合成路线:

 L
L
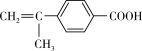
写出L的结构简式:____ ,设置步骤(Ⅰ)、(Ⅱ)的目的是:____ 。

已知:
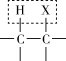 +NaOH
+NaOH
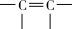 +NaX+H2O(X=Cl或Br)
+NaX+H2O(X=Cl或Br)按要求回答问题:
(1)B中所含官能团的名称是
(2)E的链节(顺式结构)为
(3)已知F与H的含碳量相同,F的分子式为
(4)I的化学名称是
(5)⑩的反应类型为
(6)为合成异丙烯基苯甲酸,某化学兴趣小组设计了如图合成路线:

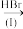

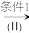 L
L

写出L的结构简式:
您最近一年使用:0次
名校
6 . X、Y、Z、W为原子序数递增的四种短周期元素,X原子最外层电子数是内层电子数的2倍。X、W为同一主族元素。Z为金属元素,X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是
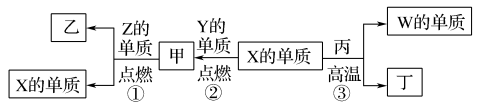

| A.Z位于元素周期表第三周期ⅡA族 | B.反应③可用于工业上制取W的单质 |
| C.甲、丙、丁均为酸性化合物 | D.乙为离子化合物 |
您最近一年使用:0次
名校
7 . 图中 为单质,其它为化合物,它们之间存在如图转化关系(部分产物已略去)。其中,
为单质,其它为化合物,它们之间存在如图转化关系(部分产物已略去)。其中, 俗称磁性氧化铁;
俗称磁性氧化铁; 是不溶于水的酸性氧化物,能与氢氟酸反应。回答下列问题:
是不溶于水的酸性氧化物,能与氢氟酸反应。回答下列问题:

(1)组成单质 的元素在周期表中的位置是
的元素在周期表中的位置是_______ 。
(2) 中存在的化学键类型为
中存在的化学键类型为_______ 。
(3)已知 与
与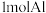 反应转化为
反应转化为 时(所有物质均为固体),放出
时(所有物质均为固体),放出 的热量,写出该反应的热化学方程式
的热量,写出该反应的热化学方程式_______ 。
(4)写出 和
和 的稀溶液反应生成
的稀溶液反应生成 的离子方程式当有
的离子方程式当有 参加反应时,转移的电子数为
参加反应时,转移的电子数为_______ 。
(5)向含有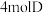 的稀溶液中,逐渐加入
的稀溶液中,逐渐加入 粉末至过量,假设生成的气体只有
粉末至过量,假设生成的气体只有 一种,请在坐标系中画出
一种,请在坐标系中画出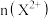 随
随 变化的示意图,并标出的
变化的示意图,并标出的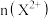 的最大值
的最大值_______ 。

 为单质,其它为化合物,它们之间存在如图转化关系(部分产物已略去)。其中,
为单质,其它为化合物,它们之间存在如图转化关系(部分产物已略去)。其中, 俗称磁性氧化铁;
俗称磁性氧化铁; 是不溶于水的酸性氧化物,能与氢氟酸反应。回答下列问题:
是不溶于水的酸性氧化物,能与氢氟酸反应。回答下列问题:
(1)组成单质
 的元素在周期表中的位置是
的元素在周期表中的位置是(2)
 中存在的化学键类型为
中存在的化学键类型为(3)已知
 与
与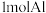 反应转化为
反应转化为 时(所有物质均为固体),放出
时(所有物质均为固体),放出 的热量,写出该反应的热化学方程式
的热量,写出该反应的热化学方程式(4)写出
 和
和 的稀溶液反应生成
的稀溶液反应生成 的离子方程式当有
的离子方程式当有 参加反应时,转移的电子数为
参加反应时,转移的电子数为(5)向含有
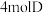 的稀溶液中,逐渐加入
的稀溶液中,逐渐加入 粉末至过量,假设生成的气体只有
粉末至过量,假设生成的气体只有 一种,请在坐标系中画出
一种,请在坐标系中画出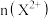 随
随 变化的示意图,并标出的
变化的示意图,并标出的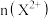 的最大值
的最大值
您最近一年使用:0次
2022-09-01更新
|
118次组卷
|
2卷引用:重庆市南开中学校2022-2023学年高二上学期培优班开学练习化学试题
名校
8 . 芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:

已知以下信息:
①A的苯环上只有一个支链,支链上只有两种不同化学环境的氢原子,且A能发生酯化反应;
② +CO2;
+CO2;
③RCOCH3+R′CHO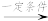 RCOCH=CHR′+H2O。
RCOCH=CHR′+H2O。
回答下列问题:
(1)A生成B的反应类型为________ ,由E生成F的反应方程式为__________________
(2)K中含有两个六元环,则K的结构简式为_____________________ 。
(3)由F生成H的过程中第1步的化学方程式为_____________________ 。
(4)H有多种同分异构体,满足下列条件的有_________ 种,写出其中任意一种的结构简式:________ 。
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③具有4组核磁共振氢谱峰
(5)糠叉丙酮( )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛( )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。__________________________ 。

已知以下信息:
①A的苯环上只有一个支链,支链上只有两种不同化学环境的氢原子,且A能发生酯化反应;
②
 +CO2;
+CO2;③RCOCH3+R′CHO
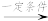 RCOCH=CHR′+H2O。
RCOCH=CHR′+H2O。回答下列问题:
(1)A生成B的反应类型为
(2)K中含有两个六元环,则K的结构简式为
(3)由F生成H的过程中第1步的化学方程式为
(4)H有多种同分异构体,满足下列条件的有
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③具有4组核磁共振氢谱峰
(5)糠叉丙酮(
 )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛( )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。
您最近一年使用:0次
名校
解题方法
9 . 已知A—F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
(1)化合物A属于_______ 类(按官能团种类分类)
(2)化合物B在一定条件下,可以与NaOH溶液发生反应,1mol化合物B最多消耗____ mol NaOH。
(3)化合物C与D在一定条件下发生如图转化得到高分子化合物Z,部分产物已略去。
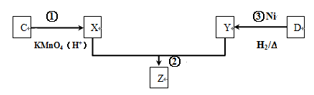
反应③中D与H2按物质的量1:1反应生成Y,则生成Z的结构简式为___________ 。
(4)化合物D与银氨溶液反应的化学方程式_________ (有机物用结构简式表示)。
(5)写出符合下列条件的E的同分异构体有_________ 种。
a.能发生水解反应 b.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
(6)化合物F是合成“克矽平”(一种治疗矽肺病的药物)的原料之一,其合成路线如下:(说明:克矽平中氮氧键是一种特殊的共价键;反应均在一定条件下进行。)
a.反应①是原子利用率100%的反应,则该反应的化学方程式为______________ ;
b.上述转化关系中没有涉及的反应类型是(填代号)_________ 。
①加成反应 ②消去反应 ③还原反应 ④氧化反应 ⑤加聚反应 ⑥取代反应
| 化合物 | A | B | C |
| 结构简式 | 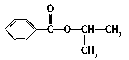 |  |  |
| 化合物 | D | E | F |
| 结构简式 | 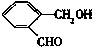 |  |  |
(2)化合物B在一定条件下,可以与NaOH溶液发生反应,1mol化合物B最多消耗
(3)化合物C与D在一定条件下发生如图转化得到高分子化合物Z,部分产物已略去。

反应③中D与H2按物质的量1:1反应生成Y,则生成Z的结构简式为
(4)化合物D与银氨溶液反应的化学方程式
(5)写出符合下列条件的E的同分异构体有
a.能发生水解反应 b.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
(6)化合物F是合成“克矽平”(一种治疗矽肺病的药物)的原料之一,其合成路线如下:(说明:克矽平中氮氧键是一种特殊的共价键;反应均在一定条件下进行。)
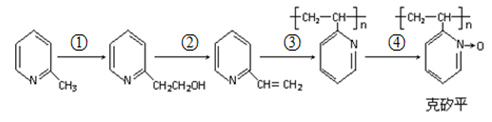
a.反应①是原子利用率100%的反应,则该反应的化学方程式为
b.上述转化关系中没有涉及的反应类型是(填代号)
①加成反应 ②消去反应 ③还原反应 ④氧化反应 ⑤加聚反应 ⑥取代反应
您最近一年使用:0次
10 . (Ⅰ)俄美科学家联合小组宣布合成出114号元素(Fl)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中位于第___________ 周期,___________ 族,属于金属元素还是非金属元素? ___________ 。
(2)该原子核内中子数为___________ ;
(3)如果该元素存在最高价氧化物对应的水化物,请写出其化学式___________ ;
(Ⅱ)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:

(1)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是___________ (填化学式)。
(2)10种元素中,原子半径最小的是___________ (填序号)。
(3)元素⑦的氢化物与⑧的单质反应的离子方程式为___________ ;
(4)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为___________ ;
(5)元素⑩的原子序数为___________ ,其单质与⑦的氢化物高温下反应的化学方程式为___________ ;
(6)单质⑨易溶于⑥与⑧形成的化合物中,所得溶液颜色为___________ 色。
(Ⅲ)判断以下叙述正确的是___________
部分短周期元素的原子半径及主要化合价
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E.T与R形成的TR2、TR3均为共价化合物
F. Q与M的单质均能与盐酸、NaOH溶液反应放出氢气
(1)该元素在周期表中位于第
(2)该原子核内中子数为
(3)如果该元素存在最高价氧化物对应的水化物,请写出其化学式
(Ⅱ)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:

(1)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是
(2)10种元素中,原子半径最小的是
(3)元素⑦的氢化物与⑧的单质反应的离子方程式为
(4)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为
(5)元素⑩的原子序数为
(6)单质⑨易溶于⑥与⑧形成的化合物中,所得溶液颜色为
(Ⅲ)判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E.T与R形成的TR2、TR3均为共价化合物
F. Q与M的单质均能与盐酸、NaOH溶液反应放出氢气
您最近一年使用:0次



