名校
1 . 已知冰醋酸能与 在
在 催化下发生反应生成
催化下发生反应生成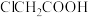 和HCl。对实验过程进行监测,发现反应过程中出现了C―I键,下列有关说法错误的是
和HCl。对实验过程进行监测,发现反应过程中出现了C―I键,下列有关说法错误的是
 在
在 催化下发生反应生成
催化下发生反应生成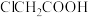 和HCl。对实验过程进行监测,发现反应过程中出现了C―I键,下列有关说法错误的是
和HCl。对实验过程进行监测,发现反应过程中出现了C―I键,下列有关说法错误的是| A.实验中C―I键的产生,可通过红外光谱结果证明 |
B.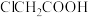 中存在 中存在 键 键 |
| C.C―I键比C―Cl键更易形成,且键能更大 |
D.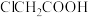 的酸性比 的酸性比 强 强 |
您最近一年使用:0次
名校
2 . 钒(V)固氮酶种类众多,其中一种结构如图所示。说法错误的是
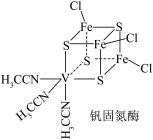

A.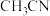 中所含σ键与π键数目之比为5∶1 中所含σ键与π键数目之比为5∶1 |
B.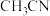 中碳的杂化类型为 中碳的杂化类型为 和sp 和sp |
| C.根据价电子排布可推测V的化合价可能有+5 |
| D.可通过向硫化钠溶液中通入少量氯气来证明非金属性Cl>S |
您最近一年使用:0次
2022-12-15更新
|
271次组卷
|
2卷引用:重庆市第八中学校2022-2023学年高二上学期第二次月考化学试题
3 . 下列说法中不正确的是
A. 该X分子中存在顺反异构 该X分子中存在顺反异构 |
| B.相同碳原子数的醇,其羟基数目越多,则其沸点更高,水溶性更好 |
| C.一氯甲烷、乙烯、苯、乙醇都为含有官能团的有机化合物 |
| D.乙醇不能发生电离,证明乙醇分子中的氢比水分子中的氢活性小 |
您最近一年使用:0次
名校
4 . 小组同学探究盐溶液对反应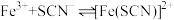 (血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
(血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略。
ⅱ. (黄色)
(黄色)
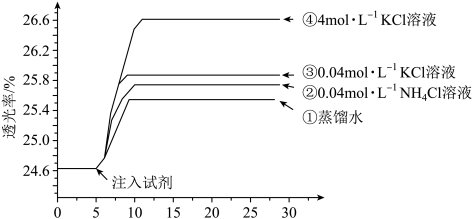
下列说法不正确的是
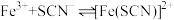 (血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
(血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略。
ⅱ.
 (黄色)
(黄色)
下列说法不正确的是
A.注入试剂①后溶液透光率增大,一定是由于 平衡逆向移动引起的 平衡逆向移动引起的 |
| B.透光率③比②高,可能是阳离子种类或溶液pH导致的 |
C.透光率④比③高,可能发生了反应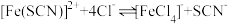 |
D.若要证明试剂③中Cl—对平衡体系有影响,还应使用与试剂③等体积的0.04mol/L的KNO3溶液进行对比实验(已知NO 对实验无影响) 对实验无影响) |
您最近一年使用:0次
2023-01-13更新
|
657次组卷
|
9卷引用:重庆市第一中学2022-2023学年高二上学期期末考试化学试题
名校
5 . Ⅰ.将50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:
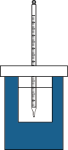
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______ 。
(2)中和热测定实验中,下列说法不正确的是_______。
(3)他们记录的实验数据如下:
(已知: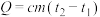 ,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为
,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为 )
)
①根据实验结果计算出NaOH溶液与HCl溶液反应的中和热
_______  。
。
②若实验过程中,内筒未加杯盖,求得的中和反应反应热数值_______ (填“偏大”“偏小”或“无影响”)。
③若用醋酸代替HCl做实验,对测定结果_______ (填“偏大”“偏小”或“无影响”)。
Ⅱ.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
请回答下列问题:
(4)装置A中的烧瓶内固体不可选用_______(填字母)。
(5)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B、D、E从左至右依次选择的装置顺序为_______ 。
(6)氯气和氨气在常温下混合就能发生反应,现象为产生白烟,则C中反应的化学方程式为_______ 。
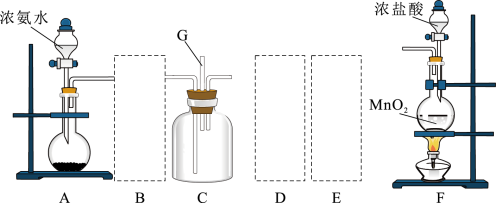
(7)某研究小组设计了一套制备及检验 部分性质的装置:
部分性质的装置:
实验过程中观察到装置B中的现象是_______ ,反应的离子方程式为_______ ,C装置证明 具有
具有_______ 性。
(8)E中的化学反应方程式为_______ 。
(9)D装置的作用是_______ 。

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)中和热测定实验中,下列说法不正确的是_______。
| A.改用60mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,求出的中和热数值和原来不同 |
| B.酸碱混合时,量筒中NaOH溶液应分三次倒入小烧杯中 |
| C.所加NaOH溶液过量,目的是保证盐酸完全被中和 |
| D.装置中隔热层的作用是保温隔热、减少热量损失 |
| 实验用品 | 溶液温度 | 中和热 | |||
 |  |  | |||
| ① | 50mL  NaOH溶液 NaOH溶液 | 50mL  HCl 溶液 HCl 溶液 | 20℃ | 23.3℃ | |
| ② | 50mL  NaOH溶液 NaOH溶液 | 50mL  HCl 溶液 HCl 溶液 | 20℃ | 23.5℃ | |
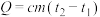 ,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为
,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为 )
)①根据实验结果计算出NaOH溶液与HCl溶液反应的中和热

 。
。②若实验过程中,内筒未加杯盖,求得的中和反应反应热数值
③若用醋酸代替HCl做实验,对测定结果
Ⅱ.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。

请回答下列问题:
(4)装置A中的烧瓶内固体不可选用_______(填字母)。
| A.碱石灰 | B.烧碱 | C.生石灰 | D.五氧化二磷 |
| 备选装置 | ||
 |  |  |
| Ⅰ | Ⅱ | Ⅲ |
(6)氯气和氨气在常温下混合就能发生反应,现象为产生白烟,则C中反应的化学方程式为
(7)某研究小组设计了一套制备及检验
 部分性质的装置:
部分性质的装置:
实验过程中观察到装置B中的现象是
 具有
具有(8)E中的化学反应方程式为
(9)D装置的作用是
您最近一年使用:0次
2022-05-18更新
|
530次组卷
|
2卷引用:重庆缙云教育联盟2023-2024学年高二上学期9月月考化学试题
名校
解题方法
6 . 下图为NaCl在不同状态下的导电实验(X、Y均为石墨电极),下列说法错误的是
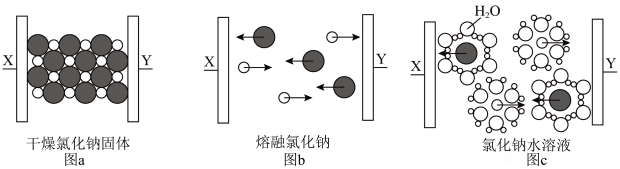

A.图示中“ ”代表的离子的电子式为 ”代表的离子的电子式为 |
| B.图a中放入的是氯化钠固体,该条件下氯化钠不导电 |
| C.图b和图c中发生的化学反应完全相同 |
| D.图b能证明氯化钠为离子化合物 |
您最近一年使用:0次
7 . 常温下,将0.025molBaSO4粉末置于盛有蒸馏水的烧杯中形成1L悬浊液,然后向烧杯中加入Na2CO3固体(忽略溶液体积的变化)并充分搅拌。加入Na2CO3固体的过程中溶液中几种离子的浓度变化曲线如图所示,下列说法中错误的是
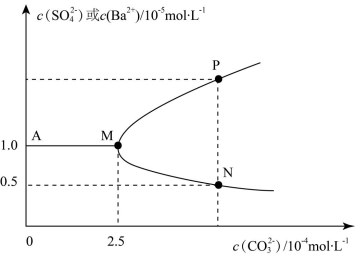

| A.常温下,Ksp(BaCO3)=2.5×10-9 |
| B.P点对应纵坐标的数据为2.5 |
| C.若要使BaSO4全部转化为BaCO3至少要加入0.65molNa2CO3 |
| D.该实验证明,溶解度较小的沉淀在一定条件下,也可能转化为溶解度较大的沉淀 |
您最近一年使用:0次
8 . 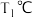 时,
时, 、
、 在水中的溶解平衡曲线如图所示(X表示Cl或Br),已知
在水中的溶解平衡曲线如图所示(X表示Cl或Br),已知 。下列说法错误的是
。下列说法错误的是

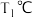 时,
时, 、
、 在水中的溶解平衡曲线如图所示(X表示Cl或Br),已知
在水中的溶解平衡曲线如图所示(X表示Cl或Br),已知 。下列说法错误的是
。下列说法错误的是
A.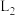 代表 代表 在水中的溶解平衡曲线 在水中的溶解平衡曲线 |
B.其他条件不变,增大 ,N点会向P点移动 ,N点会向P点移动 |
C. 在水中的溶解度和在氯化钠溶液中的溶解度不同 在水中的溶解度和在氯化钠溶液中的溶解度不同 |
D.向   溶液中加入3~4滴 溶液中加入3~4滴  溶液,得到白色沉淀,再滴加3~4滴 溶液,得到白色沉淀,再滴加3~4滴  溶液,出现浅黄色沉淀,可以证明 溶液,出现浅黄色沉淀,可以证明 |
您最近一年使用:0次
2022-12-23更新
|
393次组卷
|
2卷引用:重庆市巴蜀中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
9 . 工业上由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备高纯碳酸锰。其主要工艺流程如下:

下列有关说法不正确 的是

下列有关说法
| A.可以通过搅拌的方式提高“酸浸”时粗锰粉的浸取率 |
B.向酸浸后的滤液中加入 ,反应的离子方程式为: ,反应的离子方程式为: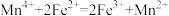 |
C.除铁时加入的物质X可以为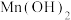 ,使 ,使 转化为 转化为 沉淀而除去 沉淀而除去 |
D.取除铁后的滤液,加入几滴KSCN溶液,无明显现象证明 已除尽 已除尽 |
您最近一年使用:0次
2022-01-23更新
|
217次组卷
|
3卷引用:重庆市缙云教育联盟2021-2022学年高二下学期4月质量检测化学试题
名校
10 . 下列有关实验的说法正确的是
| A.用pH试纸测定NaClO溶液的pH为10 |
B.证明 是弱电解质,可以用 是弱电解质,可以用 溶液做导电性实验,观察灯泡是否明亮 溶液做导电性实验,观察灯泡是否明亮 |
C.证明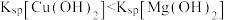 ,向含 ,向含 、 、 混合溶液中滴加少量NaOH溶液,产生蓝色沉淀 混合溶液中滴加少量NaOH溶液,产生蓝色沉淀 |
| D.测定中和反应的反应热时,将碱分次倒入酸中,所测反应热ΔH偏大 |
您最近一年使用:0次



