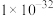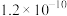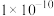名校
1 . 某小组以废铁屑(久置但未生锈)为原料制备Fe(NO3)3,并利用配制的Fe(NO3)3标准溶液对“硫酸亚铁补铁剂”中铁元素的含量进行测定,实验过程如下:
【实验Ⅰ】Fe(NO3)3·9H2O的制备___________ ;稀硝酸要足量的目的有:①确保铁元素转化成Fe3+,②___________ 。
(2)操作A为在足量稀硝酸存在下蒸发浓缩、冷却结晶、过滤、洗涤、干燥。操作A需要用到的玻璃仪器有烧杯、漏斗、酒精灯、干燥器、___________ 。
【实验Ⅱ】标准Fe(NO3)3溶液的配制。
准确称取0.8080g Fe(NO3)3·9H2O配成100mL 0.02000mol/L溶液。
(3)下列操作会导致所配Fe(NO3)3溶液浓度偏低的是___________(填字母)。
【实验Ⅲ】绘制Fe3+标准溶液与吸光度A(对特定波长光的吸收程度,数值与有色物质的浓度大小有关)的标准曲线。
①分别向6个100mL容量瓶中加入0.50、0.75、1.00、1.25、1.50、2.00mL实验Ⅱ中标定的浓度为0.0200mol·L-1的Fe(NO3)3标准溶液,然后分别加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
②将配好的溶液加入10mL比色皿中,分别测定其吸光度,所得数据如下表所示:
___________ ,b=___________ 。
【实验Ⅳ】“硫酸亚铁补铁剂”中铁元素含量的测定
①取1.000g补铁剂样品,溶解后再加入足量H2O2溶液充分反应后配成100mL溶液。
②取1.0mL上一步所配溶液于100mL容量瓶中,加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
③将最终配好的溶液加到10mL比色皿中,在与【实验Ⅲ】步骤②中相同条件下测得溶液吸光度A=0.35。
(5)“硫酸亚铁补铁剂”中铁元素的质量分数为___________ %。
(6)下列操作中有利于更准确测得补铁剂中的铁元素含量的有___________(填字母)。
【实验Ⅰ】Fe(NO3)3·9H2O的制备

(2)操作A为在足量稀硝酸存在下蒸发浓缩、冷却结晶、过滤、洗涤、干燥。操作A需要用到的玻璃仪器有烧杯、漏斗、酒精灯、干燥器、
【实验Ⅱ】标准Fe(NO3)3溶液的配制。
准确称取0.8080g Fe(NO3)3·9H2O配成100mL 0.02000mol/L溶液。
(3)下列操作会导致所配Fe(NO3)3溶液浓度偏低的是___________(填字母)。
| A.溶液未恢复室温就注入容量瓶定容 |
| B.定容时俯视液面 |
| C.摇匀后发现液面低于刻度线,于是加水至刻度线 |
| D.容量瓶底部残留少量的蒸馏水而未做干燥处理 |
【实验Ⅲ】绘制Fe3+标准溶液与吸光度A(对特定波长光的吸收程度,数值与有色物质的浓度大小有关)的标准曲线。
①分别向6个100mL容量瓶中加入0.50、0.75、1.00、1.25、1.50、2.00mL实验Ⅱ中标定的浓度为0.0200mol·L-1的Fe(NO3)3标准溶液,然后分别加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
②将配好的溶液加入10mL比色皿中,分别测定其吸光度,所得数据如下表所示:
| 比色管编号 | S1 | S2 | S3 | S4 | S₅ | S6 |
| Fe(NO3)3溶液/mL | 0.50 | 0.75 | 1.00 | 1.25 | 1.50 | 2.00 |
| c(Fe3+)/(10-4mol·L-1) | 1 | 1.5 | 2 | 2.5 | 3 | 4 |
| 吸光度A | 0.12 | 0.17 | 0.22 | 0.27 | 0.32 | 0.42 |

【实验Ⅳ】“硫酸亚铁补铁剂”中铁元素含量的测定
①取1.000g补铁剂样品,溶解后再加入足量H2O2溶液充分反应后配成100mL溶液。
②取1.0mL上一步所配溶液于100mL容量瓶中,加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
③将最终配好的溶液加到10mL比色皿中,在与【实验Ⅲ】步骤②中相同条件下测得溶液吸光度A=0.35。
(5)“硫酸亚铁补铁剂”中铁元素的质量分数为
(6)下列操作中有利于更准确测得补铁剂中的铁元素含量的有___________(填字母)。
| A.提前除去【实验Ⅰ】溶解铁屑所用硝酸中的Fe3+杂质 |
| B.用浓硝酸溶液代替【实验Ⅳ】中所用的H2O2溶液 |
| C.整个实验中均采用相同浓度的KSCN溶液 |
| D.对每一份溶液平行测定多次吸光度A,取平均值作结果 |
您最近半年使用:0次
名校
解题方法
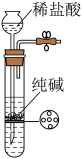
2 . 冰晶石— 熔体电解法仍然是目前工业生产金属铝的唯一方法。实验室利用以下装置能达到实验目的的是
熔体电解法仍然是目前工业生产金属铝的唯一方法。实验室利用以下装置能达到实验目的的是
 熔体电解法仍然是目前工业生产金属铝的唯一方法。实验室利用以下装置能达到实验目的的是
熔体电解法仍然是目前工业生产金属铝的唯一方法。实验室利用以下装置能达到实验目的的是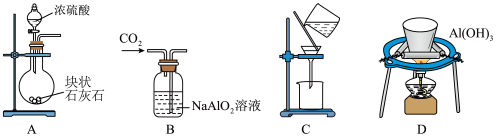
A.制取 | B.制取 | C.分离 | D.制取 |
您最近半年使用:0次
2024-04-18更新
|
458次组卷
|
2卷引用:广东省广州市天河区普通高中2023-2024学年高三毕业班综合测试(二)化学试题
名校
3 . 下列实验装置正确,且能完成相应实验的是
| 装置 |
|
|
| 目的 | A.制备少量氧化碳二气体 | B.证明酸性强弱: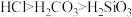 |
| 装置 |
|
|
| 目的 | C.验证浓 分解生成 分解生成 | D.对 进行尾气处理 进行尾气处理 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
4 . 下列实验装置,相关使用正确的是

| A.利用装置①进行蒸发结晶操作时,将水全部蒸干后停止加热 |
| B.装置②可以用于从海水中获得蒸馏水 |
| C.装置③可以用作实验室制备氧气的发生装置 |
| D.利用装置④进行反应:Na2CO3+ 2HCl = 2NaCl+ H2O+CO2↑ |
您最近半年使用:0次
解题方法
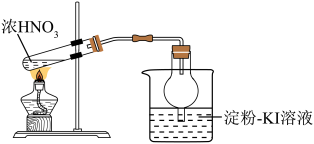
5 . 下列实验原理和装置能达到实验目的的是
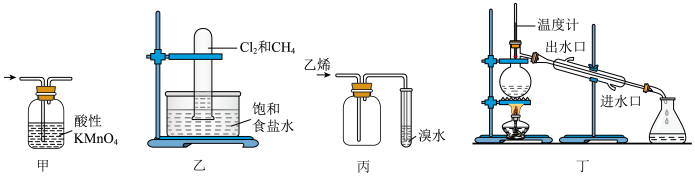

A.实验甲:除去乙烯中的 气体 气体 | B.在光照条件下制取纯净的一氯甲烷 |
| C.收集乙烯并验证它与溴水发生加成反应 | D.分馏石油获得汽油 |
您最近半年使用:0次
6 . 实验室利用如图左侧装置测量锌的相对原子质量。 纯锌与
纯锌与 反应(设锌全部参加反应,产生气体在量程范围内,气体的密度为0.0893g/L)。请回答下列问题。
反应(设锌全部参加反应,产生气体在量程范围内,气体的密度为0.0893g/L)。请回答下列问题。

(1)检验该装置的气密性的方法是___________ 。
(2)实验结束,恢复到室温后测定C中收集到液体的体积为 ,则锌的相对原子质量表达式为
,则锌的相对原子质量表达式为___________ 。如果锌的质量是准确的,用如图左侧所示的装置测得锌的相对原子质量可能偏小,请说明原因:___________ 。
(3)若气体测量装置部分改为如图右侧甲、乙管的装置,要保证容器内气压与大气压一致的操作是___________ ,读数时注意视线___________ 。
 纯锌与
纯锌与 反应(设锌全部参加反应,产生气体在量程范围内,气体的密度为0.0893g/L)。请回答下列问题。
反应(设锌全部参加反应,产生气体在量程范围内,气体的密度为0.0893g/L)。请回答下列问题。
(1)检验该装置的气密性的方法是
(2)实验结束,恢复到室温后测定C中收集到液体的体积为
 ,则锌的相对原子质量表达式为
,则锌的相对原子质量表达式为(3)若气体测量装置部分改为如图右侧甲、乙管的装置,要保证容器内气压与大气压一致的操作是
您最近半年使用:0次
解题方法
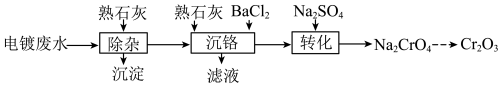
7 . 以电镀废水(主要成分为 及少量
及少量 )为原料获得
)为原料获得 的过程如下:
的过程如下:
已知:①常温下, 易溶于水。
易溶于水。
部分难溶物的溶度积常数如下表:
|
|
|
| |
|
|
|
|
|
②Cr(Ⅵ)在酸性条件下主要以 (橙红色)的形式存在,pH增大转化为
(橙红色)的形式存在,pH增大转化为 (黄色)。
(黄色)。 ,Cr(Ⅵ)较易还原生成
,Cr(Ⅵ)较易还原生成 (绿色)。
(绿色)。
③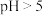 时
时 完全转化为
完全转化为 ,
, 时
时 开始转化为
开始转化为 。
。
(1)“除杂”时调节废水pH将其中
 除去(浓度小于
除去(浓度小于 mol⋅L
mol⋅L ),需加入熟石灰控制废水pH大于
),需加入熟石灰控制废水pH大于(2)“沉铬”时先加入
 调节废水pH,再加入
调节废水pH,再加入 使废水中的Cr(Ⅵ)转化为
使废水中的Cr(Ⅵ)转化为 。调节后的废水pH对Cr(Ⅵ)沉淀率的影响如图所示。
。调节后的废水pH对Cr(Ⅵ)沉淀率的影响如图所示。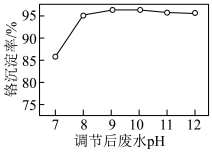
①沉铬过程中将 转化为
转化为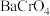 反应的化学方程式为
反应的化学方程式为
②废水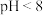 时,铬沉淀率随pH减小而下降的原因是
时,铬沉淀率随pH减小而下降的原因是
③在废水中加入 沉淀前后废水pH
沉淀前后废水pH
(3)“转化”时将
 转化为
转化为 。
。 的转化率随着
的转化率随着 浓度的变化如图所示。当
浓度的变化如图所示。当 浓度超过0.450 mol⋅L
浓度超过0.450 mol⋅L 时,Cr(Ⅵ)的转化率随
时,Cr(Ⅵ)的转化率随 浓度增大变化不明显,其原因是
浓度增大变化不明显,其原因是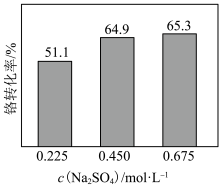
(4)请补充完整由
 溶液制取
溶液制取 的实验方案:向
的实验方案:向 溶液中,
溶液中, 。(可选用的仪器与药品:
。(可选用的仪器与药品: 、稀
、稀 、NaOH溶液)
、NaOH溶液)
您最近半年使用:0次
2024-03-26更新
|
415次组卷
|
2卷引用:江苏省苏锡常镇四市2024届高三一模考试化学试题
解题方法
8 . 化学小组用双液原电池原理研究酸碱性对物质氧化性、还原性强弱的影响。通过改溶液酸碱性,观察电压表读数的变化,读数越大,则对应物质的氧化性(或还原性)越强。
已知:①电压高低主要与电极反应有关,还与溶液的温度、离子的浓度、pH值等因素有关。
② 的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为
的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为 ;在中性和弱碱性溶液中,被还原为
;在中性和弱碱性溶液中,被还原为 ;在强碱性溶液中,被还原为
;在强碱性溶液中,被还原为 。
。

(1)连接电压表,形成闭合回路,测得初始电压为 。实验装置要置于水浴内的原因:
。实验装置要置于水浴内的原因:_____ 。
实验操作和读数记录如下:
(2)同学甲根据实验③推导出酸性增强, 的氧化性增强,实验②可以得出:
的氧化性增强,实验②可以得出:_______ 。
(3)同学乙认为实验①中,加入酸后,还原剂转化成了_______ (填化学式)。
(4)同学丙认为实验设计不够严谨,以实验①②为例,应该往左边烧杯中加入_______ ,测得电压为 ,以此作为实验①②的初始电压。
,以此作为实验①②的初始电压。
(5)同学丁认为,实验③加入5mL 溶液后,右边烧杯内的电极反应为:
溶液后,右边烧杯内的电极反应为:_______ 。实验④加入5mLNaOH溶液后,右边烧杯内的电极反应为:_______ 。
已知:①电压高低主要与电极反应有关,还与溶液的温度、离子的浓度、pH值等因素有关。
②
 的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为
的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为 ;在中性和弱碱性溶液中,被还原为
;在中性和弱碱性溶液中,被还原为 ;在强碱性溶液中,被还原为
;在强碱性溶液中,被还原为 。
。
(1)连接电压表,形成闭合回路,测得初始电压为
 。实验装置要置于水浴内的原因:
。实验装置要置于水浴内的原因:实验操作和读数记录如下:
左烧杯( / / ) ) | 右烧杯( ,调pH=4) ,调pH=4) | 电压表读数变化 | |
| ① | 逐滴加入5mL0.05mol/L | 由 逐渐降低 逐渐降低 | |
| ② | 逐滴加入5mL0.1mol/LNaOH | 由 逐渐升高 逐渐升高 | |
| ③ | 逐滴加入5mL0.05mol/L | 由 逐渐升高 逐渐升高 | |
| ④ | 加入少量0.1mol/LNaOH | 由 略微下降 略微下降 | |
| 继续逐滴加入NaOH至5mL | 再迅速下降 |
(2)同学甲根据实验③推导出酸性增强,
 的氧化性增强,实验②可以得出:
的氧化性增强,实验②可以得出:(3)同学乙认为实验①中,加入酸后,还原剂转化成了
(4)同学丙认为实验设计不够严谨,以实验①②为例,应该往左边烧杯中加入
 ,以此作为实验①②的初始电压。
,以此作为实验①②的初始电压。(5)同学丁认为,实验③加入5mL
 溶液后,右边烧杯内的电极反应为:
溶液后,右边烧杯内的电极反应为:
您最近半年使用:0次
名校
解题方法
9 . “消洗灵”(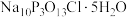 )具有消毒、杀菌、漂白和洗涤等综合功效,是一种广谱、高效、低毒的消毒洗涤剂。某兴趣小组实验室中利用反应
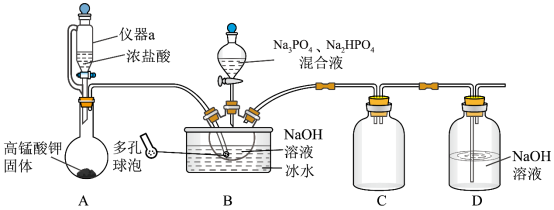
)具有消毒、杀菌、漂白和洗涤等综合功效,是一种广谱、高效、低毒的消毒洗涤剂。某兴趣小组实验室中利用反应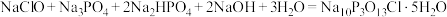 制备“消洗灵”,反应装置如图所示(夹持装置略)。
制备“消洗灵”,反应装置如图所示(夹持装置略)。
已知: 与
与 溶液在加热的条件下反应生成
溶液在加热的条件下反应生成 和
和 ;
;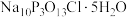 中的Cl显+1价。
中的Cl显+1价。
回答下列问题:
(1)仪器a的名称是___________ ,装置A中发生反应的离子方程式为___________ 。
(2)装置B中采用多孔球泡的目的是___________ 。
(3)打开仪器a的活塞及活塞K,制备 碱性溶液;关闭仪器a的活塞及活塞K,打开装置B中分液漏斗活塞;一段时间后,装置B中溶液经“系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及活塞K,打开装置B中分液漏斗活塞;一段时间后,装置B中溶液经“系列操作”,得到粗产品。
①上述装置存在一处缺陷,会使“消洗灵”(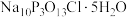 )的产率降低,改进的方法是
)的产率降低,改进的方法是___________ 。
②装置B用冰水浴的原因是___________ 。
(4)利用滴定法测定产品的纯度(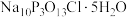 的摩尔质量为
的摩尔质量为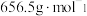 )。实验方案如下:
)。实验方案如下:
I.取 产品试样溶于蒸馏水中配成
产品试样溶于蒸馏水中配成 溶液;
溶液;
Ⅱ.量取 。待测液于锥形瓶中,加入
。待测液于锥形瓶中,加入 硫酸溶液、
硫酸溶液、 溶液(过量),暗处静置
溶液(过量),暗处静置 ;
;
Ⅲ.滴加2-3滴淀粉溶液,用 标准溶液滴定,发生反应
标准溶液滴定,发生反应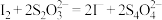 。平行滴定三次,平均消耗
。平行滴定三次,平均消耗 标准溶液。
标准溶液。
① 标准溶液应放在
标准溶液应放在___________ (填“碱”或“酸”)式滴定管中。
②该产品的纯度为___________ (保留三位有效数字)。
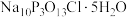 )具有消毒、杀菌、漂白和洗涤等综合功效,是一种广谱、高效、低毒的消毒洗涤剂。某兴趣小组实验室中利用反应
)具有消毒、杀菌、漂白和洗涤等综合功效,是一种广谱、高效、低毒的消毒洗涤剂。某兴趣小组实验室中利用反应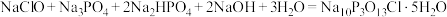 制备“消洗灵”,反应装置如图所示(夹持装置略)。
制备“消洗灵”,反应装置如图所示(夹持装置略)。
已知:
 与
与 溶液在加热的条件下反应生成
溶液在加热的条件下反应生成 和
和 ;
;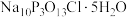 中的Cl显+1价。
中的Cl显+1价。回答下列问题:
(1)仪器a的名称是
(2)装置B中采用多孔球泡的目的是
(3)打开仪器a的活塞及活塞K,制备
 碱性溶液;关闭仪器a的活塞及活塞K,打开装置B中分液漏斗活塞;一段时间后,装置B中溶液经“系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及活塞K,打开装置B中分液漏斗活塞;一段时间后,装置B中溶液经“系列操作”,得到粗产品。①上述装置存在一处缺陷,会使“消洗灵”(
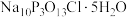 )的产率降低,改进的方法是
)的产率降低,改进的方法是②装置B用冰水浴的原因是
(4)利用滴定法测定产品的纯度(
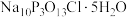 的摩尔质量为
的摩尔质量为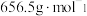 )。实验方案如下:
)。实验方案如下:I.取
 产品试样溶于蒸馏水中配成
产品试样溶于蒸馏水中配成 溶液;
溶液;Ⅱ.量取
 。待测液于锥形瓶中,加入
。待测液于锥形瓶中,加入 硫酸溶液、
硫酸溶液、 溶液(过量),暗处静置
溶液(过量),暗处静置 ;
;Ⅲ.滴加2-3滴淀粉溶液,用
 标准溶液滴定,发生反应
标准溶液滴定,发生反应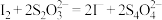 。平行滴定三次,平均消耗
。平行滴定三次,平均消耗 标准溶液。
标准溶液。①
 标准溶液应放在
标准溶液应放在②该产品的纯度为
您最近半年使用:0次
名校
解题方法
10 . 硫脲[ ]在药物制备、农业用肥等方面有广泛应用。如图所示,实验室采用
]在药物制备、农业用肥等方面有广泛应用。如图所示,实验室采用 与
与 (氰氨化钙)在85℃下合成
(氰氨化钙)在85℃下合成 。
。

已知: 易溶于水;
易溶于水; 易溶于水,易被氧化,受热时部分异构化生成化合物X。
易溶于水,易被氧化,受热时部分异构化生成化合物X。
回答下列问题:
(1)下列有关说法正确的是___________(填序号)。
(2)硫脲的制备步骤如下:
①检查装置气密性后加入药品,打开 ,通
,通 一段时间后,关闭
一段时间后,关闭 。
。
②打开 ,向A中滴加足量的稀盐酸,关闭
,向A中滴加足量的稀盐酸,关闭 ,充分反应一段时间,待D中变澄清,再次打开
,充分反应一段时间,待D中变澄清,再次打开 ,通
,通 一段时间。目的是
一段时间。目的是___________ 。
③将D中温度调整至85℃,打开 ,滴加
,滴加 溶液,充分反应生成硫脲和一种常见的碱,该反应的化学方程式为
溶液,充分反应生成硫脲和一种常见的碱,该反应的化学方程式为___________ 。
(3)取装置D中溶液,减压蒸发,降温结晶,过滤、离心脱水干燥后得到粗产品,并对硫脲的纯度进行测定,步骤如下:
步骤I:称取mg产品溶解并转移到500mL容量瓶中定容后得溶液A;
步骤II:吸取10.00mL溶液A于碘量瓶中,准确加入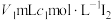 水和一定量的NaOH溶液于暗处放置[发生反应:
水和一定量的NaOH溶液于暗处放置[发生反应: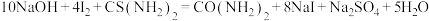 ];
];
步骤III:充分反应后,向碘量瓶中滴加几滴淀粉溶液作指示剂,用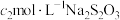 标准溶液滴定,至终点时消耗标准溶液
标准溶液滴定,至终点时消耗标准溶液 。(已知:
。(已知: )。
)。
减压蒸发的目的是________ ;步骤III中到达滴定终点的现象为________ ,若产品中的杂质不参加反应,则产品中 的质量分数为
的质量分数为________ (列出含 、
、 、
、 、
、 、m的计算式)。
、m的计算式)。
 ]在药物制备、农业用肥等方面有广泛应用。如图所示,实验室采用
]在药物制备、农业用肥等方面有广泛应用。如图所示,实验室采用 与
与 (氰氨化钙)在85℃下合成
(氰氨化钙)在85℃下合成 。
。
已知:
 易溶于水;
易溶于水; 易溶于水,易被氧化,受热时部分异构化生成化合物X。
易溶于水,易被氧化,受热时部分异构化生成化合物X。回答下列问题:
(1)下列有关说法正确的是___________(填序号)。
| A.A中ZnS固体可替换为FeS固体 |
| B.为加快反应速率,可将稀盐酸换为浓硫酸 |
| C.为保证稀盐酸能顺利流下,必须将分液漏斗上部的玻璃塞打开 |
| D.B中应为饱和NaHS溶液,E中可为烧碱溶液 |
①检查装置气密性后加入药品,打开
 ,通
,通 一段时间后,关闭
一段时间后,关闭 。
。②打开
 ,向A中滴加足量的稀盐酸,关闭
,向A中滴加足量的稀盐酸,关闭 ,充分反应一段时间,待D中变澄清,再次打开
,充分反应一段时间,待D中变澄清,再次打开 ,通
,通 一段时间。目的是
一段时间。目的是③将D中温度调整至85℃,打开
 ,滴加
,滴加 溶液,充分反应生成硫脲和一种常见的碱,该反应的化学方程式为
溶液,充分反应生成硫脲和一种常见的碱,该反应的化学方程式为(3)取装置D中溶液,减压蒸发,降温结晶,过滤、离心脱水干燥后得到粗产品,并对硫脲的纯度进行测定,步骤如下:
步骤I:称取mg产品溶解并转移到500mL容量瓶中定容后得溶液A;
步骤II:吸取10.00mL溶液A于碘量瓶中,准确加入
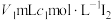 水和一定量的NaOH溶液于暗处放置[发生反应:
水和一定量的NaOH溶液于暗处放置[发生反应: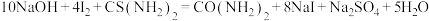 ];
];步骤III:充分反应后,向碘量瓶中滴加几滴淀粉溶液作指示剂,用
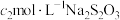 标准溶液滴定,至终点时消耗标准溶液
标准溶液滴定,至终点时消耗标准溶液 。(已知:
。(已知: )。
)。减压蒸发的目的是
 的质量分数为
的质量分数为 、
、 、
、 、
、 、m的计算式)。
、m的计算式)。
您最近半年使用:0次