名校
解题方法
1 . 某化学小组对 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。
(一)配制溶液
(1)配制 溶液前需检验固体是否变质,其操作方法为:取少量样品于试管中,加适量蒸馏水溶解,再加入
溶液前需检验固体是否变质,其操作方法为:取少量样品于试管中,加适量蒸馏水溶解,再加入___________ ,若无白色沉淀生成,则 未变质。
未变质。
(2)用离子方程式结合适当文字解释:配制氯化铁溶液时,先将氯化铁固体溶于稀盐酸,再稀释到所需浓度的原因___________ 。
(二)预测实验
(3)该小组同学预测 溶液与
溶液与 溶液混合时,溶液颜色由棕黄色变成浅绿色,他们预测的依据为(用离子方程式表示):
溶液混合时,溶液颜色由棕黄色变成浅绿色,他们预测的依据为(用离子方程式表示):___________ 。
(三)实施实验
向2mL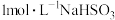 溶液中逐滴加入0.5mL
溶液中逐滴加入0.5mL 溶液
溶液
(4)查阅资料:溶液中 、
、 、
、 三种微粒会形成红色物质并存在如下转化:
三种微粒会形成红色物质并存在如下转化:
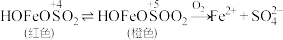
①用离子方程式解释0~1min的实验现象___________ 。
②从反应速率和化学平衡两个角度解释1~30min的实验现象___________ 。
(5)小组同学认为没有观察到预期的实验现象,是因为混合产生气体的反应干扰了氧化还原反应的发生,该同学通过如下实验证明了猜想的正确性。已知铁氰化钾溶液可与 反应生成蓝色沉淀。
反应生成蓝色沉淀。
①分析实验Ⅰ中电流计指针不偏转(没有形成原电池)的原因是___________ 。
②实验Ⅱ中右侧烧杯发生的电极反应式为___________ 。
 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。(一)配制溶液
(1)配制
 溶液前需检验固体是否变质,其操作方法为:取少量样品于试管中,加适量蒸馏水溶解,再加入
溶液前需检验固体是否变质,其操作方法为:取少量样品于试管中,加适量蒸馏水溶解,再加入 未变质。
未变质。(2)用离子方程式结合适当文字解释:配制氯化铁溶液时,先将氯化铁固体溶于稀盐酸,再稀释到所需浓度的原因
(二)预测实验
(3)该小组同学预测
 溶液与
溶液与 溶液混合时,溶液颜色由棕黄色变成浅绿色,他们预测的依据为(用离子方程式表示):
溶液混合时,溶液颜色由棕黄色变成浅绿色,他们预测的依据为(用离子方程式表示):(三)实施实验
向2mL
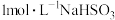 溶液中逐滴加入0.5mL
溶液中逐滴加入0.5mL 溶液
溶液| 装置 |  |
| 反应时间 | 实验现象 |
| 0~1min | 产生红褐色沉淀,有刺激性气味气体逸出 |
| 1~30min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 |
| 30min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
 、
、 、
、 三种微粒会形成红色物质并存在如下转化:
三种微粒会形成红色物质并存在如下转化: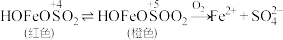
①用离子方程式解释0~1min的实验现象
②从反应速率和化学平衡两个角度解释1~30min的实验现象
(5)小组同学认为没有观察到预期的实验现象,是因为混合产生气体的反应干扰了氧化还原反应的发生,该同学通过如下实验证明了猜想的正确性。已知铁氰化钾溶液可与
 反应生成蓝色沉淀。
反应生成蓝色沉淀。| 装置 |  | |
| 实验步骤 | 操作 | 实验现象 |
| Ⅰ | 向烧杯中装好溶液、连接好装置、闭合开关 | 灵敏电流表指针未发生偏转 |
| Ⅱ | 向左侧烧杯中滴加少量饱和 溶液 溶液 | 灵敏电流表指针向左侧偏转 |
| Ⅲ | 向左侧烧杯中再滴加少量铁氰化钾溶液 | 左侧烧杯中产生蓝色沉淀,灵敏电流表指针向左侧偏转幅度更大 |
②实验Ⅱ中右侧烧杯发生的电极反应式为
您最近一年使用:0次
名校
2 . H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1mL。滴定过程中发生的一个反应为:5H2C2O4+2MnO +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。
②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为___________ 。
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用___________ 。
a.普通漏斗和滤纸
b.不需滤纸的微孔玻璃漏斗
(3)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因___________ 而导致KMnO4标准液的标定浓度偏高,在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是___________ 。
(4)KMnO4标准液滴定H2O2的离子方程式为___________ ;当滴定到___________ 可以认为已达到滴定终点。
(5)该医生消毒剂中H2O2的物质的量浓度为___________ mol·L-1。
(6)②中若用盐酸代替H2SO4测定结果将___________ (填“偏高”“偏低”或“无影响”)
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1mL。滴定过程中发生的一个反应为:5H2C2O4+2MnO
 +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用
a.普通漏斗和滤纸
b.不需滤纸的微孔玻璃漏斗
(3)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因
(4)KMnO4标准液滴定H2O2的离子方程式为
(5)该医生消毒剂中H2O2的物质的量浓度为
(6)②中若用盐酸代替H2SO4测定结果将
您最近一年使用:0次
名校
解题方法
3 . 砂质土壤分析中常用KarlFischer法是测定其中微量水含量,该方法是利用I2和SO2反应定量消耗水作为原理(假设土壤中其他成分不参加反应),据此回答下列问题:
步骤I:反应样品中的水
下图是某同学在实验室模拟KarlFischer法的实验装置图:
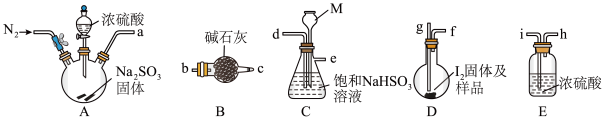
(1)装置连接的顺序为a→_____________ (填接口字母顺序);M仪器在实验过程中的作用是:_________________ ;
(2)操作步骤为:①连接装置并检查装置气密性,②装入药品,____________________ ;③关闭弹簧夹,打开分液漏斗塞子及活塞;④反应结束后,关闭分液漏斗活塞,继续通入N2,⑤取下D装置,……
步骤④中继续通入N2的目的是______________________
步骤II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(3)Na2S2O3标准液应装在_____________ (填“酸式”、“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是________________________ ;
(4)用Na2S2O3溶液滴定I2时,应用___________ 作为指示剂。滴定终点的现象是:___________
(5)滴定实验重复四次得到数据如下:
①若实验开始时,向D装置中加入10.00g土壤样品和10.16克I2(已知I2过量),则样品土壤中水的含量为_________ %。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将____________ (填“偏高”、“偏低”或“不变”)。
步骤I:反应样品中的水
下图是某同学在实验室模拟KarlFischer法的实验装置图:

(1)装置连接的顺序为a→
(2)操作步骤为:①连接装置并检查装置气密性,②装入药品,
步骤④中继续通入N2的目的是
步骤II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(3)Na2S2O3标准液应装在
(4)用Na2S2O3溶液滴定I2时,应用
(5)滴定实验重复四次得到数据如下:
| 实验 | ① | ② | ③ | ④ |
| 消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将
您最近一年使用:0次
12-13高二上·山东济宁·期中
名校
4 . 成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成份的存在,请你参与并协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入_________ ,溶液变蓝,则苹果中含有淀粉。
(2)用小试管取少量的苹果汁,加入新制Cu(OH)2悬浊液,并加热,产生砖红色的沉淀,则苹果中含有____________ (写分子式)。
(3)葡萄糖在一定条件下可以得到化学式为C2H6O的化合物A。
A + CH3COOH→有香味的产物
① 含A的体积分数为75%的水溶液可以用做_____________ 。
②写出化合物A与CH3COOH反应的化学方程式为______________________ ,该反应的类型为_____ 。
(4)苹果中含有苹果酸,测得其相对分子质量为134。取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过足量的无水CaCl2和碱石灰,两者分别增重1.08g 和 3.52g。则分子中C、H原子的个数比_______ 。苹果酸的分子式是___________ 。
(1)用小试管取少量的苹果汁,加入
(2)用小试管取少量的苹果汁,加入新制Cu(OH)2悬浊液,并加热,产生砖红色的沉淀,则苹果中含有
(3)葡萄糖在一定条件下可以得到化学式为C2H6O的化合物A。
A + CH3COOH→有香味的产物
① 含A的体积分数为75%的水溶液可以用做
②写出化合物A与CH3COOH反应的化学方程式为
(4)苹果中含有苹果酸,测得其相对分子质量为134。取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过足量的无水CaCl2和碱石灰,两者分别增重1.08g 和 3.52g。则分子中C、H原子的个数比
您最近一年使用:0次
2012-12-25更新
|
435次组卷
|
4卷引用:2012-2013学年福建省泉州一中高二上学期期中考试化学试卷
(已下线)2012-2013学年福建省泉州一中高二上学期期中考试化学试卷(已下线)2012-2013学年山东济宁鱼台一中高二上学期期中考试化学试卷江西省南昌市八一中学2019-2020学年高二下学期期末考试化学试题人教版高中化学必修二第三单元《有机化合物》测试卷
名校
5 . 四氮化四硫( ,S为+2价)是重要的硫一氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于
,S为+2价)是重要的硫一氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于 等有机溶剂,可用
等有机溶剂,可用 与
与 (红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
(红棕色液体)反应制备,反应装置如图所示(夹持装置略)。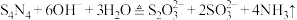 ,回答下列问题:
,回答下列问题:
(1)仪器a的名称为________ ;装置D的作用是________ 。
(2)四氮化四硫( )为双楔形笼状结构,如下图(a)所示。S和N原子交替构成一个假想的八元环,各S-N键长几乎相等。请回答以下问题:
)为双楔形笼状结构,如下图(a)所示。S和N原子交替构成一个假想的八元环,各S-N键长几乎相等。请回答以下问题: 的双楔形笼状结构可通过
的双楔形笼状结构可通过________ 实验测得。
② 分子中正、负电荷的重心完全重合,则为分子
分子中正、负电荷的重心完全重合,则为分子________ (填“极性”或“非极性”)。
③已知:多原子分子中相互平行的多条p轨道,连贯重叠构成一个整体,p电子在多个原子间运动形成大π键,如苯分子存在 型大π键。有研究者提出
型大π键。有研究者提出 的另一种平面八元环结构,如上图(b),S原子的杂化方式为
的另一种平面八元环结构,如上图(b),S原子的杂化方式为________ ;请写出平面 中的大π键类型
中的大π键类型________ 。
(3)装置C中生成 的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为
的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为________ ;证明 反应完全的现象是
反应完全的现象是________ 。
(4)分离产物后测定产品纯度:
i.取0.1000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热蒸出 ;
;
ii.将蒸出的 通入含甲基橙的
通入含甲基橙的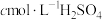 标准溶液中,消耗
标准溶液中,消耗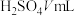 。
。
根据上述实验,计算样品中 的纯度
的纯度________ (列出表达式)。
 ,S为+2价)是重要的硫一氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于
,S为+2价)是重要的硫一氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于 等有机溶剂,可用
等有机溶剂,可用 与
与 (红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
(红棕色液体)反应制备,反应装置如图所示(夹持装置略)。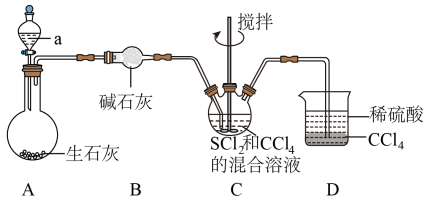
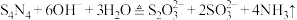 ,回答下列问题:
,回答下列问题:(1)仪器a的名称为
(2)四氮化四硫(
 )为双楔形笼状结构,如下图(a)所示。S和N原子交替构成一个假想的八元环,各S-N键长几乎相等。请回答以下问题:
)为双楔形笼状结构,如下图(a)所示。S和N原子交替构成一个假想的八元环,各S-N键长几乎相等。请回答以下问题: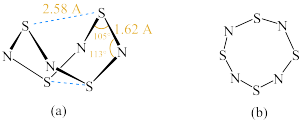
 的双楔形笼状结构可通过
的双楔形笼状结构可通过②
 分子中正、负电荷的重心完全重合,则为分子
分子中正、负电荷的重心完全重合,则为分子③已知:多原子分子中相互平行的多条p轨道,连贯重叠构成一个整体,p电子在多个原子间运动形成大π键,如苯分子存在
 型大π键。有研究者提出
型大π键。有研究者提出 的另一种平面八元环结构,如上图(b),S原子的杂化方式为
的另一种平面八元环结构,如上图(b),S原子的杂化方式为 中的大π键类型
中的大π键类型(3)装置C中生成
 的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为
的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为 反应完全的现象是
反应完全的现象是(4)分离产物后测定产品纯度:
i.取0.1000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热蒸出
 ;
;ii.将蒸出的
 通入含甲基橙的
通入含甲基橙的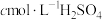 标准溶液中,消耗
标准溶液中,消耗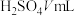 。
。根据上述实验,计算样品中
 的纯度
的纯度
您最近一年使用:0次
2024-04-11更新
|
126次组卷
|
2卷引用:福建省宁德市福安市第一中学2023-2024学年高二下学期3月月考化学试题
6 .  溶液常用作氧化还原反应滴定的标准液,由于
溶液常用作氧化还原反应滴定的标准液,由于 的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质
的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质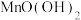 。
。
Ⅰ.配制 标准溶液的操作是:
标准溶液的操作是:
a.称取稍多于所需量的 固体溶于水,将溶液加热并保持微沸1h;
固体溶于水,将溶液加热并保持微沸1h;
b.用微孔玻璃漏斗过滤除去难溶的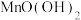 ;
;
c.过滤得到的 溶液贮存于棕色试剂瓶放在暗处;
溶液贮存于棕色试剂瓶放在暗处;
d.利用氧化还原滴定方法,在70°C-80°C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是___________ 。
(2)准确量取一定体积的 溶液用
溶液用___________ 。(填“酸式滴定管”或“碱式滴定管”)
(3)在下列物质中,用于标定 溶液的基准试剂最好选用___________。(填序号)
溶液的基准试剂最好选用___________。(填序号)
Ⅱ.氧化还原滴定原理与中和滴定原理相似:为测定某亚硝酸钠( )样品的纯度,进行如下实验:
)样品的纯度,进行如下实验:
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,再向瓶中滴加少量 酸化,用
酸化,用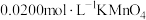 标准溶液进行滴定(还原产物为
标准溶液进行滴定(还原产物为 ,滴定至终点时消耗
,滴定至终点时消耗 溶液VmL。
溶液VmL。
(4)上述实验①所需玻璃仪器除玻璃棒、胶头滴管、烧杯之外还有___________ (填一种)。
(5)判断该实验达到滴定终点的现象是:___________ 。
(6)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为___________ mL。

(7)下列叙述正确的是___________ 。
A.滴定过程中发现溶液颜色变化立即读数,测定结果偏大
B.若用放置两周的 标准溶液滴定,测得的浓度值将偏小
标准溶液滴定,测得的浓度值将偏小
C.滴定前装有标准液的滴定管尖嘴处有气泡,滴定后气泡消失,测定结果偏大
D.装有标准液的滴定管滴定前读数正确,滴定后仰视滴定管读数,测定结果偏小
E.锥形瓶用蒸馏水洗涤后直接加入 溶液,用
溶液,用 溶液滴定,对实验无影响
溶液滴定,对实验无影响
(8)滴定过程中反应的离子方程式为:___________ ,该样品中 的质量分数为
的质量分数为___________ (用含字母a、V的最简式表示)。
 溶液常用作氧化还原反应滴定的标准液,由于
溶液常用作氧化还原反应滴定的标准液,由于 的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质
的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质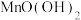 。
。Ⅰ.配制
 标准溶液的操作是:
标准溶液的操作是:a.称取稍多于所需量的
 固体溶于水,将溶液加热并保持微沸1h;
固体溶于水,将溶液加热并保持微沸1h;b.用微孔玻璃漏斗过滤除去难溶的
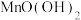 ;
;c.过滤得到的
 溶液贮存于棕色试剂瓶放在暗处;
溶液贮存于棕色试剂瓶放在暗处;d.利用氧化还原滴定方法,在70°C-80°C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是
(2)准确量取一定体积的
 溶液用
溶液用(3)在下列物质中,用于标定
 溶液的基准试剂最好选用___________。(填序号)
溶液的基准试剂最好选用___________。(填序号)A. | B. | C.浓盐酸 | D. |
Ⅱ.氧化还原滴定原理与中和滴定原理相似:为测定某亚硝酸钠(
 )样品的纯度,进行如下实验:
)样品的纯度,进行如下实验:①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,再向瓶中滴加少量
 酸化,用
酸化,用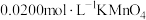 标准溶液进行滴定(还原产物为
标准溶液进行滴定(还原产物为 ,滴定至终点时消耗
,滴定至终点时消耗 溶液VmL。
溶液VmL。(4)上述实验①所需玻璃仪器除玻璃棒、胶头滴管、烧杯之外还有
(5)判断该实验达到滴定终点的现象是:
(6)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为

(7)下列叙述正确的是
A.滴定过程中发现溶液颜色变化立即读数,测定结果偏大
B.若用放置两周的
 标准溶液滴定,测得的浓度值将偏小
标准溶液滴定,测得的浓度值将偏小C.滴定前装有标准液的滴定管尖嘴处有气泡,滴定后气泡消失,测定结果偏大
D.装有标准液的滴定管滴定前读数正确,滴定后仰视滴定管读数,测定结果偏小
E.锥形瓶用蒸馏水洗涤后直接加入
 溶液,用
溶液,用 溶液滴定,对实验无影响
溶液滴定,对实验无影响(8)滴定过程中反应的离子方程式为:
 的质量分数为
的质量分数为
您最近一年使用:0次
7 . 如图所示装置是用燃烧法确定有机物化学式常用的装置,这种方法是电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。回答下列问题:

(1)C装置(燃烧管)中CuO的作用是_______ ;写出E装置中所盛放试剂的名称:_______ ;
(2)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为_______ 。
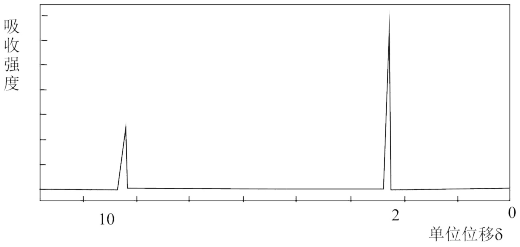
(3)若该有机物的核磁共振氢谱如下图所示,则其结构简式为_______ ;
(4)若符合下列条件,则该有机物的结构简式为_______ 。
①环状化合物 ②只有一种类型的氢原子
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个装置E,其主要目的是_______ 。

(1)C装置(燃烧管)中CuO的作用是
(2)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为
(3)若该有机物的核磁共振氢谱如下图所示,则其结构简式为

(4)若符合下列条件,则该有机物的结构简式为
①环状化合物 ②只有一种类型的氢原子
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个装置E,其主要目的是
您最近一年使用:0次
2022-04-10更新
|
172次组卷
|
4卷引用:福建省福清西山学校2021-2022学年高二下学期期中考试化学试题
名校
8 . 下列实验方案、现象和结论都正确的是:
| 实验目的 | 实验方案 | 现象和结论 | |
| A | 探究乙醇消去反应的 产物 | C2H5OH与浓硫酸(体积比约为 1 : 3)的混合液,放入几块碎瓷片, 170°C共热,将产生的气体通入酸性 KMnO4溶液中 | 若酸性KMnO4溶液褪色,则乙醇消去反应的产物为乙烯 |
| B | 探究乙酰水杨酸(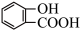 )样品中是否含有水杨酸 )样品中是否含有水杨酸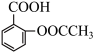 | 取少量样品,加入3mL蒸馏水和少量乙醇,振荡,再加入1-2滴FeCl3 溶液 | 若有紫色沉淀生成,则该样品中含有水杨酸 |
| C | 探究麦芽糖是否发生水解 | 取2mL20%的麦芽糖溶液于试管中,加入适量稀h2so4后水浴加热5min,冷却后加入适量新制Cu(OH)2悬浊液并加热煮沸 | 若没有砖红色沉淀生成,则麦芽糖没有水解 |
| D | 探究KI与FeCl3反应的限度 | 取5 mL 0.1 mol KI溶液于试管中,加入1 mL 0. 1 mol • L-1 FeCl3溶液,充分反应后滴入5滴15% KSCN溶液 | 若溶液变血红色,则 KI与FeCl3的反应有一定限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 草酸(乙二酸)存在于自然界的植物中,其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。草酸及其盐在生产生活中有重要用途。某兴趣小组计划制备草酸并研究其性质。
(1)制备草酸。用含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为3:2)溶液氧化淀粉水解液制备草酸,其装置如图一所示。[已知:硝酸氧化淀粉水解液过程中主要反应:C6H12O6+HNO3→H2C2O4+NO2↑+NO↑+H2O(未配平)]

①该反应的温度需控制在55~60℃,适宜的加热方式为___________ 。
②仪器c的名称为___________ 。a为冷凝水的___________ 口。(填“进水”、“出水”)
③碳酸钠溶液用于尾气吸收。当尾气中n(NO2):n(NO)=1:1时,写出对应的的化学方程式:___________
(2)研究草酸热稳定性。
写出草酸晶体(H2C2O4·2H2O)加热分解生成气态产物的化学方程式:___________ ,最合适的分解装置是___________ (填标号)。
a. b.
b. c.
c. d.
d.
(3)草酸及其盐可用于测定血钙的含量。方法是:取10.00mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,充分反应。将沉淀过滤洗涤后用稀硫酸溶解,并稀释至100mL,取出25.00mL用标准KMnO4溶液滴定。
①溶解CaC2O4沉淀时不能用盐酸,原因是:___________
②滴定终点的现象为___________
③若最终消耗了1.250×10-4mol/L的KMnO4溶液20.00mL,则该血液样品中含钙量为___________ mmol/L。
(1)制备草酸。用含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为3:2)溶液氧化淀粉水解液制备草酸,其装置如图一所示。[已知:硝酸氧化淀粉水解液过程中主要反应:C6H12O6+HNO3→H2C2O4+NO2↑+NO↑+H2O(未配平)]

①该反应的温度需控制在55~60℃,适宜的加热方式为
②仪器c的名称为
③碳酸钠溶液用于尾气吸收。当尾气中n(NO2):n(NO)=1:1时,写出对应的的化学方程式:
(2)研究草酸热稳定性。
写出草酸晶体(H2C2O4·2H2O)加热分解生成气态产物的化学方程式:
a.
 b.
b. c.
c. d.
d.
(3)草酸及其盐可用于测定血钙的含量。方法是:取10.00mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,充分反应。将沉淀过滤洗涤后用稀硫酸溶解,并稀释至100mL,取出25.00mL用标准KMnO4溶液滴定。
①溶解CaC2O4沉淀时不能用盐酸,原因是:
②滴定终点的现象为
③若最终消耗了1.250×10-4mol/L的KMnO4溶液20.00mL,则该血液样品中含钙量为
您最近一年使用:0次
2022-01-12更新
|
99次组卷
|
2卷引用:福建省厦门外国语学校石狮分校2021-2022学年高二下学期3月月考化学试题
10 . 莫尔盐[硫酸亚铁铵,(NH4)2Fe(SO4)2・6H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定,易溶于水,难溶于乙醇。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。

回答下列问题:
Ⅰ.制取莫尔盐
i.连接装置,检查装置气密性。将13.2g(NH4)2SO4晶体置于三颈烧瓶B中,将6.0g洁净铁屑加入锥形瓶中。
ii.打开仪器a瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。
iii.待大部分铁粉溶解后,打开K3、关闭K2,A中浅绿色溶液流入B。
iv.关闭活塞K2、K3,采用100℃水浴蒸发三颈烧瓶中水分,液面产生晶膜时,停止加热,冷却结晶、过滤、洗涤晶体。
(1)仪器a的名称是___ 。
(2)操作iii中浅绿色溶液会流入B的原因是___ 。
(3)操作iv中洗涤晶体所用试剂是___ (填标号)。
A.水B.无水乙醇C.硫酸溶液
Ⅱ.为测定所得莫尔盐晶体纯度,取mg该样品配制成1L溶液,分别设计如下两个实验方案,请回答:
方案一:取20.00mL所配硫酸亚铁铵溶液用0.1000mol·L-1的酸性K2Cr2O7溶液进行滴定。重复三次。(已知:Cr2O72-还原产物为Cr3+)
(4)写出此反应的离子方程式___ 。
(5)滴定时必须选用的仪器是___ 。(填标号)
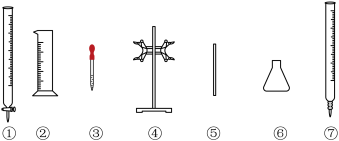
方案二:取20.00mL所配硫酸亚铁铵溶液进行如下实验。

(6)莫尔盐晶体纯度为___ 。(用含m、w的式子表示)
(7)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为__ 。

回答下列问题:
Ⅰ.制取莫尔盐
i.连接装置,检查装置气密性。将13.2g(NH4)2SO4晶体置于三颈烧瓶B中,将6.0g洁净铁屑加入锥形瓶中。
ii.打开仪器a瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。
iii.待大部分铁粉溶解后,打开K3、关闭K2,A中浅绿色溶液流入B。
iv.关闭活塞K2、K3,采用100℃水浴蒸发三颈烧瓶中水分,液面产生晶膜时,停止加热,冷却结晶、过滤、洗涤晶体。
(1)仪器a的名称是
(2)操作iii中浅绿色溶液会流入B的原因是
(3)操作iv中洗涤晶体所用试剂是
A.水B.无水乙醇C.硫酸溶液
Ⅱ.为测定所得莫尔盐晶体纯度,取mg该样品配制成1L溶液,分别设计如下两个实验方案,请回答:
方案一:取20.00mL所配硫酸亚铁铵溶液用0.1000mol·L-1的酸性K2Cr2O7溶液进行滴定。重复三次。(已知:Cr2O72-还原产物为Cr3+)
(4)写出此反应的离子方程式
(5)滴定时必须选用的仪器是

方案二:取20.00mL所配硫酸亚铁铵溶液进行如下实验。

(6)莫尔盐晶体纯度为
(7)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为
您最近一年使用:0次



