福建省泉州市2021届高三质量监测(一) 化学试题
福建
高三
阶段练习
2020-09-29
390次
整体难度:
适中
考查范围:
常见无机物及其应用、化学实验基础、认识化学科学、有机化学基础、化学与STSE、化学反应原理、物质结构与性质
福建省泉州市2021届高三质量监测(一) 化学试题
福建
高三
阶段练习
2020-09-29
390次
整体难度:
适中
考查范围:
常见无机物及其应用、化学实验基础、认识化学科学、有机化学基础、化学与STSE、化学反应原理、物质结构与性质
一、单选题 添加题型下试题
2. 下列化学用语正确的是
| A.溴苯的分子式:C6H6Br |
| B.乙醛的结构简式:CH3CHO |
C.乙烯的球棍模型: |
D.氯原子的结构示意图: |
您最近一年使用:0次
单选题
|
适中(0.65)
4. NA是阿伏加 德罗常数的值,下列说法正确的是
| A.0.1 mol Na2O2固体中含有的阴离子数为0.1NA |
| B.1 L 0.1 mol·L-1 K2S 溶液中含有的 S2−数目为 0.1NA |
| C.常温下,0.1 mol Cl2与足量 NaOH 溶液反应,转移的电子数为 0.2 NA |
| D.常温常压下,11.2 L 12C18O2中含有的中子数为 13NA |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
5. 25℃时,在 pH=1 的 HCl 溶液中,可以大量共存的离子组是
A.Na+、K+、MnO 、CO 、CO | B.Fe2+、K+、NO 、SO 、SO |
| C.Fe3+、Mg2+、SCN-、Cl- | D.K+、Na+、Br-、SO |
【知识点】 离子反应的发生条件解读 离子共存 限定条件下的离子共存解读
您最近一年使用:0次
2020-09-28更新
|
165次组卷
|
6卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
单选题
|
较易(0.85)
名校
解题方法
6. 用下列实验装置进行相应实验,能达到实验目的的是
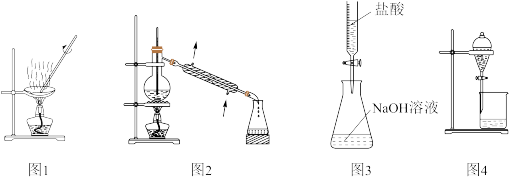

| A.利用图 1 装置可将干海带灼烧成灰 |
| B.利用图 2 装置可分离苯(沸点 80.1℃)和溴苯(沸点 156.2℃) |
| C.利用图 3 装置可进行盐酸溶液滴定 NaOH 溶液 |
| D.利用图 4 装置可分离 CH3CH2OH 和 CH3COOCH2CH3混合液 |
您最近一年使用:0次
2020-09-28更新
|
111次组卷
|
2卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
7. 过氧化钙晶体(CaO2·8H2O)常用作医药消毒剂。以轻质碳酸钙为原料,按如图方法制备:
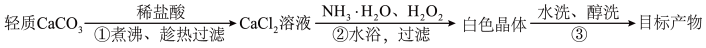
下列说法错误的是
下列说法错误的是
| A.步骤①,煮沸可以除去溶解的 CO2、HCl |
| B.步骤②,H2O2作氧化剂、氨水用以调节溶液的 pH |
| C.步骤①②,过滤时若用玻璃棒搅动,可能会导致滤纸破损 |
| D.步骤③,醇洗可减少晶体的损失且加速晶体干燥 |
您最近一年使用:0次
2020-09-28更新
|
212次组卷
|
3卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
福建省泉州市2021届高三质量监测(一) 化学试题(已下线)易错21 化学工艺流程类选择题-备战2021年高考化学一轮复习易错题吉林省通化市梅河口市第五中学2022-2023学年高三上学期10月期中考试化学试题
单选题
|
较易(0.85)
8. 下列物质间的转化均能实现的是
A.CO2 C C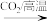 CO CO |
B.Fe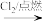 FeCl2 FeCl2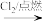 FeCl3 FeCl3 |
C.S SO3 SO3 H2SO4 H2SO4 |
D.SiO2 H2SiO3 H2SiO3 Na2SiO3 Na2SiO3 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
9. 铅蓄电池的反应式为:Pb+PbO2+4H++2SO
 2PbSO4+2H2O,如图为铅蓄电池示意图,某状态下测得两电极的质量都增加。在该状态下,下列说法正确的是
2PbSO4+2H2O,如图为铅蓄电池示意图,某状态下测得两电极的质量都增加。在该状态下,下列说法正确的是
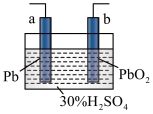

 2PbSO4+2H2O,如图为铅蓄电池示意图,某状态下测得两电极的质量都增加。在该状态下,下列说法正确的是
2PbSO4+2H2O,如图为铅蓄电池示意图,某状态下测得两电极的质量都增加。在该状态下,下列说法正确的是
| A.a 为铅蓄电池的正极 |
| B.铅蓄电池正在充电 |
| C.一段时间后,溶液的 pH 减小 |
D.b 的电极反应为 PbO2+4H++SO +2e-=PbSO4+2H2O +2e-=PbSO4+2H2O |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
10. 下列物质中杂质(括号内为杂质)的检验试剂、除杂试剂和除杂方法都正确的是
| 选项 | 物质及其杂质 | 杂质的检验试剂 | 除杂试剂与方法 |
| A | CO2(SO2) | 品红溶液 | NaOH 溶液、洗气 |
| B | MgCl2(AlCl3) | NaOH 溶液 | 氨水、过滤 |
| C | NaCl(I2) | 淀粉溶液 | 加热升华 |
| D | Cl2(HCl) | 湿润的 pH 试纸 | 饱和食盐水、洗气 |
| A.A | B.B | C.C | D.D |
【知识点】 物质的分离、提纯 物质的检验 化学实验方案的设计与评价
您最近一年使用:0次
单选题
|
较易(0.85)
名校
11. 探究硫酰氯(SO2Cl2,易水解液体)在催化剂作用下加热分解的产物,实验装置如图所示。下列说法错误的是
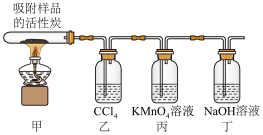

| A.装置甲中出现黄绿色证明分解产物中有 Cl2 |
| B.装置乙可除去 Cl2 |
| C.装置丙可证明分解产物含有 SO2 |
| D.SO2Cl2水解时生成 SO2 和 HCl |
【知识点】 二氧化硫与其他强氧化剂的反应解读 物质性质的探究解读
您最近一年使用:0次
2020-09-28更新
|
533次组卷
|
5卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
福建省泉州市2021届高三质量监测(一) 化学试题(已下线)易错19 实验装置类选择题-备战2021年高考化学一轮复习易错题山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题广东省深圳市新安中学2021-2022学年高三下学期开学测试化学试题(已下线)专题七实验装置图(讲)
单选题
|
适中(0.65)
解题方法
12. 对二乙烯苯(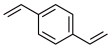 )可用作树脂、油漆及橡胶等的原料。下列说法正确的是
)可用作树脂、油漆及橡胶等的原料。下列说法正确的是
 )可用作树脂、油漆及橡胶等的原料。下列说法正确的是
)可用作树脂、油漆及橡胶等的原料。下列说法正确的是| A.分子中所有原子可能共平面 |
| B.苯环上的一氯代物有 2 种(不考虑立体异构) |
| C.不能使酸性高锰酸钾溶液褪色 |
| D.1 mol 该分子最多可与 2 mol H2加成 |
您最近一年使用:0次
2020-09-28更新
|
127次组卷
|
2卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
单选题
|
较易(0.85)
名校
13. 工业上可用如下反应制 H2:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH,在密闭容器中通入一定量的 CH4和 H2O(g),测得平衡时 H2的物质的量分数φ(H2)与温度及压强的关系如图所示。下列说法正确的是


| A.压强:p1<p2 |
| B.焓变:ΔH<0 |
| C.正反应速率:M>N |
| D.平衡常数:K(M)<K(N) |
【知识点】 化学平衡的移动及其影响因素 化学平衡常数 化学平衡图像分析
您最近一年使用:0次
2020-09-28更新
|
153次组卷
|
4卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
单选题
|
适中(0.65)
名校
14. 用氨水吸收工厂烟气中的SO2时,溶液中H2SO3、 、
、 的物质的量分数δ随pH的分布如图所示。下列叙述错误的是
的物质的量分数δ随pH的分布如图所示。下列叙述错误的是

 、
、 的物质的量分数δ随pH的分布如图所示。下列叙述错误的是
的物质的量分数δ随pH的分布如图所示。下列叙述错误的是
A.当溶液pH=6时,溶液中浓度最大的阴离子为 |
| B.Ka2(H2SO3)=10-7.2 |
| C.由图像可知,NaHSO3溶液显酸性 |
D.随着pH的变化,溶液中都有c( )+c(H+)=c( )+c(H+)=c( )+c( )+c( )+c(OH-) )+c(OH-) |
您最近一年使用:0次
2020-09-28更新
|
156次组卷
|
3卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
二、解答题 添加题型下试题
解答题-无机推断题
|
适中(0.65)
15. 氮及其化合物在工农业生产、生活中被广泛使用,造福人类。
I.元素 X、Y、Z 位于同一周期且原子序数依次增大,它们和氢元素、硫元素组成的含氮化合物(结构如图)常用作丝绸漂白剂。回答下列问题:
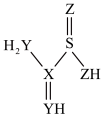
(1)硫元素在元素周期表中的位置为______ ;Y 的元素符号为______ 。
(2)下列说法错误的是______ (选填序号)。
A.原子半径:X>Y>Z
B.简单气态氢化物稳定性:Y<Z
C.该化合物可溶于水
D.该化合物中所有原子均为 8 电子稳定结构
II.工业上用氨气来制造硝酸,NH3转化关系如图所示。
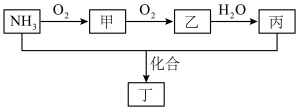
(3)NH3的电子式为______ 。
(4)图中,乙转化为丙的离子方程式为______ 。
(5)检验化合物丁中阳离子的方法:取少量待测液于试管中,______ ,将湿润的 红色石蕊试纸置于试管口,试纸变蓝。
(6)工业上常使用 NH3处理甲,生成无污染的 N2,则 NH3与甲完全反应的物质的量之比为______ 。
I.元素 X、Y、Z 位于同一周期且原子序数依次增大,它们和氢元素、硫元素组成的含氮化合物(结构如图)常用作丝绸漂白剂。回答下列问题:

(1)硫元素在元素周期表中的位置为
(2)下列说法错误的是
A.原子半径:X>Y>Z
B.简单气态氢化物稳定性:Y<Z
C.该化合物可溶于水
D.该化合物中所有原子均为 8 电子稳定结构
II.工业上用氨气来制造硝酸,NH3转化关系如图所示。

(3)NH3的电子式为
(4)图中,乙转化为丙的离子方程式为
(5)检验化合物丁中阳离子的方法:取少量待测液于试管中,
(6)工业上常使用 NH3处理甲,生成无污染的 N2,则 NH3与甲完全反应的物质的量之比为
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
16. 25℃时,三种弱酸的电离平衡常数如表所示。
(1)将 pH 和体积均相同的 CH3COOH 溶液和 HNO2溶液分别稀释,其 pH 随加水体积的变化如图所示。
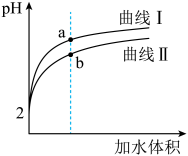
① 曲线Ⅰ代表______ 溶液(填“HNO2”或“CH3COOH”)。
② 图中,水的电离程度较小的是______ (填“a”或“b”)。
③ 若向上述CH3COOH 和HNO2 溶液中分别滴加等浓度的NaOH 溶液,恰好中和时消耗NaOH 溶液体积分别为V1 和 V2。则 V1______ V2(填“>”、“<”或“=”)。
(2)① H2C2O4的电离方程式为______ 。
② 25℃时,0.1 mol·L-1 NaHC2O4 溶液显______ 性(填“酸”、“碱”或“中”)。
(3)工业上脱硝常用 6%的稀硝酸吸收 NOx 生成 HNO2,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。

① 图中 b 应连接电源的______ 极(填“正”或“负”)。
② 阳极的电极反应式为______ 。
| 名称 | 醋酸 | 亚硝酸 | 草酸 |
| 化学式 | CH3COOH | HNO2 | H2C2O4 |
| 电离平衡常数 | 1.8×10-5 | 5.0×10-4 | Ka1=5.9×10-2 Ka2=6.5×10-5 |
(1)将 pH 和体积均相同的 CH3COOH 溶液和 HNO2溶液分别稀释,其 pH 随加水体积的变化如图所示。

① 曲线Ⅰ代表
② 图中,水的电离程度较小的是
③ 若向上述CH3COOH 和HNO2 溶液中分别滴加等浓度的NaOH 溶液,恰好中和时消耗NaOH 溶液体积分别为V1 和 V2。则 V1
(2)① H2C2O4的电离方程式为
② 25℃时,0.1 mol·L-1 NaHC2O4 溶液显
(3)工业上脱硝常用 6%的稀硝酸吸收 NOx 生成 HNO2,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。

① 图中 b 应连接电源的
② 阳极的电极反应式为
您最近一年使用:0次
17. 四氢铝钠(NaAlH4)是有机合成的重要还原剂。以铝合金厂的废边脚料为原料(主要成分为 Al,含有少量 Al2O3、Fe2O3、MgO 和 SiO2等杂质)制备 NaAlH4的工艺流程如图:
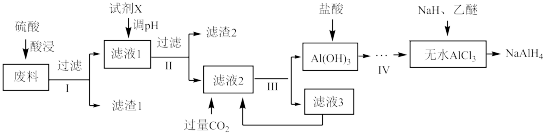
已知:NaH、NaAlH4 遇水发生剧烈反应。回答下列问题:
(1)酸浸时:
① H2SO4与 Al 反应的离子方程式为______ 。
② 相同条件下,铝元素浸出率与 c(H2SO4)的关系如图所示。当 c(H2SO4)大于 a mol·L-1时,浸出率降低的原因可能是______ 。

(2)“调 pH”所加入的试剂 X 为______ (选填序号)。
A.H2SO4 B.NaOH C.NH3·H2O D.Na2CO3
(3)滤渣 1 的主要成分为______ (填化学式)。
(4)滤液 2 中,通入过量 CO2反应生成 Al(OH)3的离子方程式为______ 。
(5)AlCl3制得 NaAlH4反应的化学方程式为______ ,该反应体系要保证干燥,其目的是______ 。

已知:NaH、NaAlH4 遇水发生剧烈反应。回答下列问题:
(1)酸浸时:
① H2SO4与 Al 反应的离子方程式为
② 相同条件下,铝元素浸出率与 c(H2SO4)的关系如图所示。当 c(H2SO4)大于 a mol·L-1时,浸出率降低的原因可能是

(2)“调 pH”所加入的试剂 X 为
A.H2SO4 B.NaOH C.NH3·H2O D.Na2CO3
(3)滤渣 1 的主要成分为
(4)滤液 2 中,通入过量 CO2反应生成 Al(OH)3的离子方程式为
(5)AlCl3制得 NaAlH4反应的化学方程式为
您最近一年使用:0次
2020-09-28更新
|
133次组卷
|
2卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
解答题-实验探究题
|
适中(0.65)
解题方法
18. 磷化氢(PH3)常用于有机合成、粮仓杀虫等。实验室用白磷(P4)与浓 NaOH加热制备 PH3,同时得到次磷酸钠(NaH2PO2),装置如图。
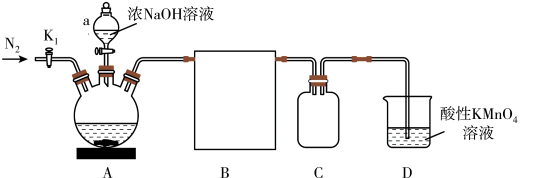
(已知:PH3是无色有毒气体,有强还原性,易自燃;丁醇沸点 117.7℃)
(1)实验室少量白磷保存于______ 。
(2)仪器 a 的名称为______ ,B 应选用图中装置______ 。

(3)实验操作步骤如下:
① 打开 K1,通入 N2一段时间;
② 检查装置气密性;
③ 关闭 K1,打开磁力加热搅拌器加热至 50℃~60℃,滴加烧碱溶液;
④ 在 A 中加入丁醇和白磷。
则正确的操作顺序是______ 。
(4)装置A中发生反应的化学方程式为______ ,使用丁醇作为反应物的分散剂,目的是______ 。
(5)装置C、D的作用分别是______ 、______ 。
(6)测定NaH2PO2纯度。分离提纯A中反应后的混合物,得到NaH2PO2(M=88g·mol-1)粗品,并取1.00g配成100mL溶液。取20.00mL于锥形瓶中,酸化后加入30.00mL0.100mol·L-1碘水,充分反应,以淀粉溶液作指示剂,用0.100mol·L-1Na2S2O3溶液滴定至终点,平均消耗20.00mL。则产品纯度为______ 。(相关反应为:H2PO +H2O+I2=H2PO
+H2O+I2=H2PO +2H++2I-,2S2O
+2H++2I-,2S2O +I2=S4O
+I2=S4O +2I-)
+2I-)

(已知:PH3是无色有毒气体,有强还原性,易自燃;丁醇沸点 117.7℃)
(1)实验室少量白磷保存于
(2)仪器 a 的名称为

(3)实验操作步骤如下:
① 打开 K1,通入 N2一段时间;
② 检查装置气密性;
③ 关闭 K1,打开磁力加热搅拌器加热至 50℃~60℃,滴加烧碱溶液;
④ 在 A 中加入丁醇和白磷。
则正确的操作顺序是
(4)装置A中发生反应的化学方程式为
(5)装置C、D的作用分别是
(6)测定NaH2PO2纯度。分离提纯A中反应后的混合物,得到NaH2PO2(M=88g·mol-1)粗品,并取1.00g配成100mL溶液。取20.00mL于锥形瓶中,酸化后加入30.00mL0.100mol·L-1碘水,充分反应,以淀粉溶液作指示剂,用0.100mol·L-1Na2S2O3溶液滴定至终点,平均消耗20.00mL。则产品纯度为
 +H2O+I2=H2PO
+H2O+I2=H2PO +2H++2I-,2S2O
+2H++2I-,2S2O +I2=S4O
+I2=S4O +2I-)
+2I-)
您最近一年使用:0次
2020-09-28更新
|
150次组卷
|
2卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
解答题-原理综合题
|
适中(0.65)
解题方法
19. 合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
常温下,大气固氮的倾向______ 工业固氮(填“大于”或“小于”)。
(2)N2(g)与H2(g)反应的能量变化如图所示。
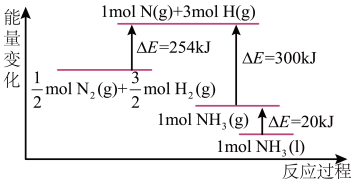
则N2(g)与H2(g)制备NH3(l)的热化学方程式为__________________ 。
(3)T ℃时,在 2 L恒容密闭容器中加入 1.2 mol N2和2 mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)⇌2NH3(g)],体系中n(NH3)随时间的变化如图。
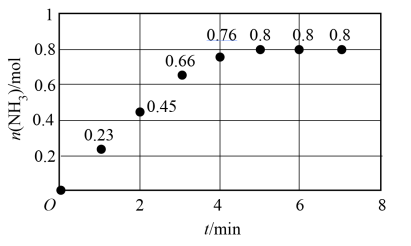
①前2分钟内的平均反应速率v(NH3)=______ mol·L-1·min-1。
②下列情况能说明该反应已达到平衡状态的是______ (选填序号)。
A.混合气体的密度不变
B.单位时间内断裂n mol N—H键的同时形成n mol H—H键
C.容器内的总压强不再变化
D.3v 正(H2)=2v 逆(NH3)
③有关工业固氮的说法正确的是______ (选填序号)。
A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强越大越好
④T ℃时,该反应的平衡常数为______ 。
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol·min-1)与催化剂的对应关系如表所示。
在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是______ (填化学式)。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
| 反应 | 大气固氮N2(g)+O2(g)⇌2NO(g) | 工业固氮N2(g)+3H2(g)⇌2NH3(g) | ||||
| 温度/℃ | 25 | 2000 | 25 | 350 | 400 | 450 |
| 平衡常数(K) | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
(2)N2(g)与H2(g)反应的能量变化如图所示。

则N2(g)与H2(g)制备NH3(l)的热化学方程式为
(3)T ℃时,在 2 L恒容密闭容器中加入 1.2 mol N2和2 mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)⇌2NH3(g)],体系中n(NH3)随时间的变化如图。

①前2分钟内的平均反应速率v(NH3)=
②下列情况能说明该反应已达到平衡状态的是
A.混合气体的密度不变
B.单位时间内断裂n mol N—H键的同时形成n mol H—H键
C.容器内的总压强不再变化
D.3v 正(H2)=2v 逆(NH3)
③有关工业固氮的说法正确的是
A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强越大越好
④T ℃时,该反应的平衡常数为
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol·min-1)与催化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
您最近一年使用:0次
2020-09-28更新
|
173次组卷
|
2卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学实验基础、认识化学科学、有机化学基础、化学与STSE、化学反应原理、物质结构与性质
试卷题型(共 19题)
题型
数量
单选题
14
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 铵盐 钠单质的保存与用途 仪器使用与实验安全 实验安全 | |
| 2 | 0.85 | 化学用语综合判断 原子结构示意图、离子结构示意图 有机物的结构式、结构简式、比例模型、球棍模型、最简式 乙烯的“四式二型” | |
| 3 | 0.85 | 乙醇的工业制法及用途 淀粉和纤维素 石油裂化、裂解 煤的液化 | |
| 4 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 5 | 0.65 | 离子反应的发生条件 离子共存 限定条件下的离子共存 | |
| 6 | 0.85 | 酸碱中和滴定实验相关仪器 物质的分离、提纯 蒸馏与分馏 萃取和分液 | |
| 7 | 0.65 | 物质分离、提纯综合应用 过滤 物质制备的探究 | |
| 8 | 0.85 | 物质的转化 含硫化合物之间的转化 二氧化硅的化学性质 铁与非金属单质反应 | |
| 9 | 0.85 | 原电池正负极判断 原电池电极反应式书写 铅蓄电池 | |
| 10 | 0.65 | 物质的分离、提纯 物质的检验 化学实验方案的设计与评价 | |
| 11 | 0.85 | 二氧化硫与其他强氧化剂的反应 物质性质的探究 | |
| 12 | 0.65 | 同分异构体的数目的确定 含碳碳双键物质的性质的推断 有机分子中原子共面的判断 | |
| 13 | 0.85 | 化学平衡的移动及其影响因素 化学平衡常数 化学平衡图像分析 | |
| 14 | 0.65 | 弱电解质的电离平衡 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 15 | 0.65 | 氨的还原性 铵根离子的检验 同周期元素性质递变规律 共价键的实质与形成 | 无机推断题 |
| 16 | 0.65 | 水溶液中水的电离程度及的计算 溶液稀释时pH的变化图像 一元强酸与一元弱酸的比较 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |
| 17 | 0.65 | 铝的钝化 偏铝酸钠与二氧化碳的反应 物质分离、提纯综合应用 物质制备的探究 | 工业流程题 |
| 18 | 0.65 | 化学实验基础操作 常见气体的制备与收集 探究物质组成或测量物质的含量 物质制备的探究 | 实验探究题 |
| 19 | 0.65 | 根据△H=生成物的总能量之和-反应物的总能量之和进行计算 化学反应速率计算 化学反应条件的控制及优化 化学平衡状态的判断方法 | 原理综合题 |



