解题方法
1 . 已知A、B、C、D、E、F是原子序数依次增大的六种短周期主族元素,A与B能形成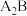 和
和 两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:
两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:
(1)C在元素周期表中的位置是_______ 。
(2)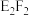 的电子式为
的电子式为_______ 。
(3)D的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(4) 和
和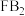 是市场上较好的消毒剂,等质量的
是市场上较好的消毒剂,等质量的 和
和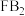 分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为
分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为_______ 。
(5)已知W、X、Y、Z四种物质中均含有上述元素中的某一种,M、X为单质,其余均为化合物,它们之间存在如图所示的转化关系(反应条件略)。
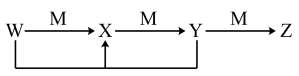
①Z的化学式为_______ 。
②上述五种物质所含的元素中,原子半径最大的是_______ (填元素符号)。
③C元素形成的单质与M在海水中可以形成原电池,其正极的电极反应式为_______ 。
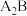 和
和 两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:
两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:(1)C在元素周期表中的位置是
(2)
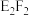 的电子式为
的电子式为(3)D的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物反应的离子方程式为
(4)
 和
和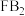 是市场上较好的消毒剂,等质量的
是市场上较好的消毒剂,等质量的 和
和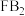 分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为
分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为(5)已知W、X、Y、Z四种物质中均含有上述元素中的某一种,M、X为单质,其余均为化合物,它们之间存在如图所示的转化关系(反应条件略)。

①Z的化学式为
②上述五种物质所含的元素中,原子半径最大的是
③C元素形成的单质与M在海水中可以形成原电池,其正极的电极反应式为
您最近一年使用:0次
解题方法
2 . 中国冶金报指出,钢铁行业作为国民经济重要的基础产业,碳排放量在国内占比13-15%,因此钢铁行业应承担起碳减排的主体责任,努力成为碳减排的先行者。已知,铁有α、γ、δ三种晶体结构,并且在一定条件下可以相互转化(如图),请回答相关的问题:
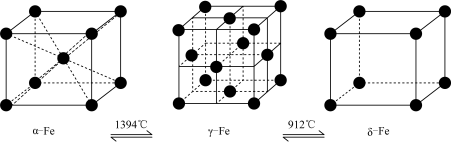
(1)铁元素在元素周期表中的位置_______ ,Fe2+的外围电子排布式_______ ,铁的三种晶体之间的转化属于_______ 变化(填“物理”或“化学”),理由是:_______ 。
(2)铁的α、γ、δ三种晶体结构中,Fe原子的配位数之比为:_______ 。
(3)设α-Fe晶胞边长为a cm,δ-Fe晶胞边长为b cm, 计算确定:两种晶体的密度比为:_______ 。(用a、b的代数式表示)
(4)Fe3C是工业炼铁生产过程中产生的一种铁的合金,在Fe3C晶体中,每个碳原子被6个位于顶角位置的铁原子所包围,成八面体结构,即碳原子配位数为6,那么,铁原子配位数为_______ 。
(5)事实上,Fe3C是C与铁的晶体在高温下形成的间隙化合物(即碳原子填入铁晶体中的某些空隙),根据相关信息,你认为形成碳化铁的铁的三种晶体结构中,最有可能的是:_______ ,(选填“α-Fe”、“γ-Fe”或“δ-Fe”)
(6)摩尔盐[ (NH4)2 SO4·FeSO4·6H2O]是一种复盐, 它易溶于水,不溶于乙醇,性质比一般亚铁盐稳定,不易被氧化,试分析该晶体中亚铁离子可稳定存在的原因_______ 。

(1)铁元素在元素周期表中的位置
(2)铁的α、γ、δ三种晶体结构中,Fe原子的配位数之比为:
(3)设α-Fe晶胞边长为a cm,δ-Fe晶胞边长为b cm, 计算确定:两种晶体的密度比为:
(4)Fe3C是工业炼铁生产过程中产生的一种铁的合金,在Fe3C晶体中,每个碳原子被6个位于顶角位置的铁原子所包围,成八面体结构,即碳原子配位数为6,那么,铁原子配位数为
(5)事实上,Fe3C是C与铁的晶体在高温下形成的间隙化合物(即碳原子填入铁晶体中的某些空隙),根据相关信息,你认为形成碳化铁的铁的三种晶体结构中,最有可能的是:
(6)摩尔盐[ (NH4)2 SO4·FeSO4·6H2O]是一种复盐, 它易溶于水,不溶于乙醇,性质比一般亚铁盐稳定,不易被氧化,试分析该晶体中亚铁离子可稳定存在的原因
您最近一年使用:0次
名校
3 . a、b、c、d、e、f、g是元素周期表前四周期中的元素,且原子序数依次增大,部分元素的相关信息如表所示。
请回答下列问题:
(1) 在元素周期表中的
在元素周期表中的___________ (填“s”、“p”、“d”或“ ”)区,写出基态
”)区,写出基态 原子的轨道表示式:
原子的轨道表示式:___________ 。
(2)a、b、c的最简单氢化物的沸点由高到低的顺序为___________ (用化学式表示)。
(3)从微观角度分析:为什么 单质的熔、沸点高于
单质的熔、沸点高于 单质的熔、沸点?
单质的熔、沸点?___________ 。
(4)a、b、c三种元素的电负性由高到低的排列次序为___________ (用元素符号表示)。
(5) 常温下呈液态,熔点为
常温下呈液态,熔点为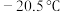 ,沸点为
,沸点为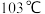 ,易溶于非极性溶剂,
,易溶于非极性溶剂,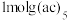 中含有
中含有___________  键,中心原子
键,中心原子 的杂化方式为
的杂化方式为___________ (填标号)。
A. 杂化 B.
杂化 B. 杂化 C.
杂化 C. 杂化 D.
杂化 D. 杂化
杂化
(6)短周期元素 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素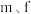 形成的化合物在气态时有单体
形成的化合物在气态时有单体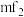 和二聚体
和二聚体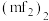 ,在晶体中便形成多聚体
,在晶体中便形成多聚体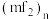 。其中二聚体
。其中二聚体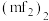 和多聚体
和多聚体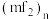 的结构如图所示:
的结构如图所示:
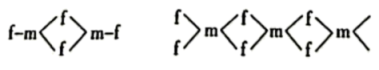
则在二聚体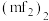 和多聚体
和多聚体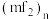 中
中 原子的杂化轨道类型依次为
原子的杂化轨道类型依次为___________ ,单体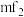 空间结构为
空间结构为___________ 形。
 | 核外电子总数等于 的最外层电子数 的最外层电子数 |
 | 基态原子中 电子总数与 电子总数与 电子总数相等 电子总数相等 |
 | 短周期元素中金属性最强的元素 |
 | 基态原子价层电子排布式为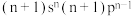 |
 | 基态原子的最外层 轨道有2个电子的自旋状态与其他电子的自旋状态相反 轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
 | 其单质是生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板 |
(1)
 在元素周期表中的
在元素周期表中的 ”)区,写出基态
”)区,写出基态 原子的轨道表示式:
原子的轨道表示式:(2)a、b、c的最简单氢化物的沸点由高到低的顺序为
(3)从微观角度分析:为什么
 单质的熔、沸点高于
单质的熔、沸点高于 单质的熔、沸点?
单质的熔、沸点?(4)a、b、c三种元素的电负性由高到低的排列次序为
(5)
 常温下呈液态,熔点为
常温下呈液态,熔点为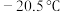 ,沸点为
,沸点为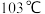 ,易溶于非极性溶剂,
,易溶于非极性溶剂,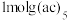 中含有
中含有 键,中心原子
键,中心原子 的杂化方式为
的杂化方式为A.
 杂化 B.
杂化 B. 杂化 C.
杂化 C. 杂化 D.
杂化 D. 杂化
杂化(6)短周期元素
 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素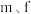 形成的化合物在气态时有单体
形成的化合物在气态时有单体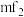 和二聚体
和二聚体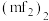 ,在晶体中便形成多聚体
,在晶体中便形成多聚体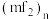 。其中二聚体
。其中二聚体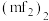 和多聚体
和多聚体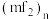 的结构如图所示:
的结构如图所示: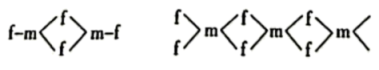
则在二聚体
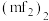 和多聚体
和多聚体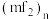 中
中 原子的杂化轨道类型依次为
原子的杂化轨道类型依次为 空间结构为
空间结构为
您最近一年使用:0次
4 . 短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1.
(1)人的汗液中含有T的简单离子,其离子结构示意图为_______ ;元素M在元素周期表中的位置是_______ 。
(2)R的最高价氧化物所含的化学键类型是_______ (选填“离子”或“共价”)。
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为_______ 。(用具体的化学式表示)
(4)在一定条件下甲、乙、丙有如下转化:甲 乙
乙 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是_______ (选填序号,下同)。
①R ②Q2③M ④T2
(5)工业上,常利用RO与MO2反应生成固态M单质和RO2,从而消除这两种气体对大气的污染。已知:2RO(g)+O2(g)=2RO2(g)△H=-akJ·mol-1;M(s)+O2(g)=MO2(g)△H=-bkJ·mol-1,则反应2RO(g)+MO2(g)=2RO2(g)+M(s)△H=_______ 。
| R | Q | ||
| M | T |
(2)R的最高价氧化物所含的化学键类型是
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为
(4)在一定条件下甲、乙、丙有如下转化:甲
 乙
乙 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是①R ②Q2③M ④T2
(5)工业上,常利用RO与MO2反应生成固态M单质和RO2,从而消除这两种气体对大气的污染。已知:2RO(g)+O2(g)=2RO2(g)△H=-akJ·mol-1;M(s)+O2(g)=MO2(g)△H=-bkJ·mol-1,则反应2RO(g)+MO2(g)=2RO2(g)+M(s)△H=
您最近一年使用:0次
名校
解题方法
5 . 罗美昔布是一种抗炎药,临床用于治疗风湿性关节炎、牙痛等,化合物W是合成罗美昔布的一种中间体,W合成路线如下:
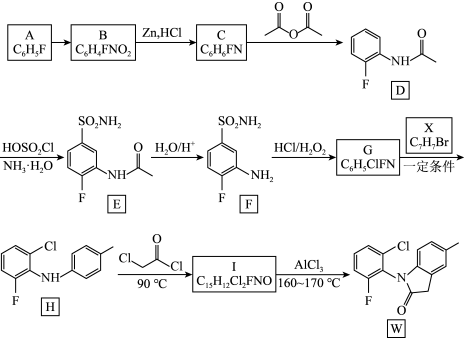
已知:(ⅰ)
(ⅱ)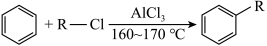
回答下列问题:
(1)A的化学名称为_______ ,B中含氧官能团的名称为_______ 。
(2)由C生成D的反应类型为_______ ;D中所含元素(H除外)第一电离能由大到小的顺序为_______ 。
(3)设置D→E和F→G两步反应的作用是_______ 。
(4)写出由G生成H的化学方程式_______ 。
(5)写出Ⅰ的结构简式_______ 。
(6)M为D的同系物,相对分子质量比D大14。M的同分异构体中同时满足下列条件的共有_______ 种(不考虑立体异构)。
①属于芳香族化合物;
②苯环上含有两个取代基,且位置相对;
③含有 ;
;
④能发生银镜反应。
满足上述条件的同分异构体中,核磁共振氢谱为3∶2∶2∶2∶1的同分异构体为_______ (写出其中两种的结构简式)。

已知:(ⅰ)

(ⅱ)
回答下列问题:
(1)A的化学名称为
(2)由C生成D的反应类型为
(3)设置D→E和F→G两步反应的作用是
(4)写出由G生成H的化学方程式
(5)写出Ⅰ的结构简式
(6)M为D的同系物,相对分子质量比D大14。M的同分异构体中同时满足下列条件的共有
①属于芳香族化合物;
②苯环上含有两个取代基,且位置相对;
③含有
 ;
;④能发生银镜反应。
满足上述条件的同分异构体中,核磁共振氢谱为3∶2∶2∶2∶1的同分异构体为
您最近一年使用:0次
2023-04-14更新
|
955次组卷
|
2卷引用:吉林省长春市2023届高三质量监测(三)理综化学试题
名校
解题方法
6 . 以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线。制备 的反应转化关系如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是
的反应转化关系如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是
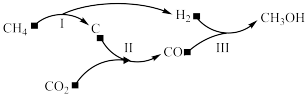
 的反应转化关系如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是
的反应转化关系如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是
A.用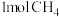 理论上能生产的 理论上能生产的 中含有极性键的数目为4 NA 中含有极性键的数目为4 NA |
B.等物质的量的 和 和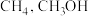 的质子数比 的质子数比 多8 NA 多8 NA |
C.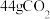 气体和 气体和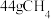 与 与 的混合气体,所含C原子数均为NA 的混合气体,所含C原子数均为NA |
D.用 制备合成气的反应中,若生成 制备合成气的反应中,若生成 ,反应转移电子数为3 NA ,反应转移电子数为3 NA |
您最近一年使用:0次
2021-11-30更新
|
542次组卷
|
3卷引用:吉林省东北师范大学附属中学2021-2022学年高三上学期一模考试化学试题
7 . X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素,Y是地壳中含量最高的元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是


| A.反应③为工业制粗硅的原理 |
| B.Z位于元素周期表第三周期ⅡA族 |
| C.4种元素的原子中,Y原子的半径最小 |
| D.工业上通过电解乙来制取Z |
您最近一年使用:0次
名校
8 . 有八种短周期主族元素x、y、z、d、e、f、 g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。z、e、g、h的最高价氧化物对应水化物溶液(浓度均为0.01 mol/L)的pH与原子序数的关系如图2所示。
根据上述信息进行判断,并回答下列问题:
(1)g在元素周期表中的位置是____________________ 。
(2)比较d、e、f的简单离子半径大小为______ <______ <______ (用离子符号表示);y、h的最高价氧化物对应水化物酸性较强的是__________ (用化学式表示)。
(3)下列可作为比较e和f金属性强弱的依据是________ 。
A.测等浓度相应氯化物水溶液的pH
B.测两种元素单质的硬度和熔、沸点
C.比较单质做还原剂时失去的电子数目的多少
D.比较两种元素在化合物中化合价的高低
E.比较单质与同浓度盐酸反应的剧烈程度
(4)据报道,最近意大利科学家获得了极具研究价值的z4,其分子结构与白磷分子(P4)的正四面体结构相似。已知断裂1 mol z-z键吸收167 kJ热量,生成1 mol Z≡Z键放出942 kJ热量,请写出z4气体在一定条件下生成z2气体反应的热化学方程式___________________ 。
(5)由上述元素中的y、z、e组成的某剧毒化合物eyz不慎泄漏时,消防人员通常采用喷洒过氧化氢溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为___________________________________________ 。已知eyz含有z2分子中类似的化学键,写出化合物eyz的电子式____________ 。

根据上述信息进行判断,并回答下列问题:
(1)g在元素周期表中的位置是
(2)比较d、e、f的简单离子半径大小为
(3)下列可作为比较e和f金属性强弱的依据是
A.测等浓度相应氯化物水溶液的pH
B.测两种元素单质的硬度和熔、沸点
C.比较单质做还原剂时失去的电子数目的多少
D.比较两种元素在化合物中化合价的高低
E.比较单质与同浓度盐酸反应的剧烈程度
(4)据报道,最近意大利科学家获得了极具研究价值的z4,其分子结构与白磷分子(P4)的正四面体结构相似。已知断裂1 mol z-z键吸收167 kJ热量,生成1 mol Z≡Z键放出942 kJ热量,请写出z4气体在一定条件下生成z2气体反应的热化学方程式
(5)由上述元素中的y、z、e组成的某剧毒化合物eyz不慎泄漏时,消防人员通常采用喷洒过氧化氢溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为
您最近一年使用:0次
2017-12-19更新
|
222次组卷
|
5卷引用:吉林省实验中学2018届高三上学期第四次模拟考试化学试题
吉林省实验中学2018届高三上学期第四次模拟考试化学试题(已下线)二轮复习测试专项 专题06 物质结构与元素周期律安徽省肥东县高级中学2019届高三上学期12月调研化学试题(已下线)第5章 原子结构 元素周期律 单元测试(测)——2020年高考化学一轮复习讲练测四川省阆中中学2020-2021学年高二下学期仁智班期中教学质量检测化学试题
名校
解题方法
9 . 现有部分短周期元素的信息如表所示:
A、B、D三种单质(分别由X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种筒能燃料,分子中含有18个电子,其组成元素与丙相同。
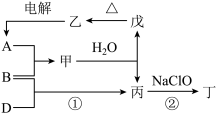
(1)元素X在周期表中的位置是______ ,其简单离子的结构示意图为______ 。
(2)单质B的电子式为______ 。
(3)丙中所含的化学键类型是______ (填序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5 mol 参加反应时转移1 mol电子,该反应的化学方程式为
参加反应时转移1 mol电子,该反应的化学方程式为______ 。
(5)一定条件下,A与 、C(石墨)反应只生成乙和碳化钛(
、C(石墨)反应只生成乙和碳化钛( ),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为
),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为______ 。
| 元素编号 | 元素性质或原子结构信息 |
| X | 第三周期元素中简单离子半径最小的元素 |
| Y | 其最简单氢化物丙的水溶液呈碱性 |
| Z | 原子核外电子数和所在周期数相等 |

(1)元素X在周期表中的位置是
(2)单质B的电子式为
(3)丙中所含的化学键类型是
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5 mol
 参加反应时转移1 mol电子,该反应的化学方程式为
参加反应时转移1 mol电子,该反应的化学方程式为(5)一定条件下,A与
 、C(石墨)反应只生成乙和碳化钛(
、C(石墨)反应只生成乙和碳化钛( ),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为
),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为
您最近一年使用:0次
2020-03-02更新
|
1107次组卷
|
7卷引用:2016届吉林省东北师范大学附属中学高三上第三次模拟化学试卷
名校
10 . 已知A、B、C、D为由短周期元素组成的四种物质,它们有如下所示转化关系,且D为强电解质(其他相关物质可能省略)。

下列说法不正确的是

下列说法不正确的是
| A.若A为非金属单质,则它与Mg反应的产物中阴、阳离子个数比可能为2:3 |
| B.若A为非金属单质,则其组成元素在周期表中的位置可能处于第二周期第IVA族 |
| C.若A是共价化合物,则A和D有可能发生氧化还原反应 |
| D.若A是金属或非金属单质,则常温下0. 1 mol/L的D溶液中由水电离出的c(H+)可能为10-13mol/L |
您最近一年使用:0次
2019-04-17更新
|
1548次组卷
|
6卷引用:吉林省大安一中2019-2020学年高三上学期第四次月考化学试题



