二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式_______________________________________ 。
(2)已知:Se+2H2SO4(浓) 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O Se+2SO42-+4H+
Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_________________________ 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3 Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为__________ 。
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式
(2)已知:Se+2H2SO4(浓)
 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O2SO2+SeO2+2H2O
 Se+2SO42-+4H+
Se+2SO42-+4H+SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3
 Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为
更新时间:2019-12-16 00:04:11
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;
②2SO2+SeO2+2H2O===Se+2SO42—+4H+。
(1) Se与浓H2SO4的反应中,氧化剂是________________ ,还原剂是_______________ 。当有标准状况下22.4 L SO2气体生成时,转移电子的物质的量是________ mol。
(2)依据反应①、②判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是______________________ 。
(3)用单线桥法标出反应②电子转移的方向和数目:_____________________________ 。
(4)SeO2、KI和HNO3发生如下反应:SeO2+KI+HNO3―→Se+I2+KNO3+H2O配平上述反应的化学方程式______________________________________________ 。
已知:①Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;
②2SO2+SeO2+2H2O===Se+2SO42—+4H+。
(1) Se与浓H2SO4的反应中,氧化剂是
(2)依据反应①、②判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是
(3)用单线桥法标出反应②电子转移的方向和数目:
(4)SeO2、KI和HNO3发生如下反应:SeO2+KI+HNO3―→Se+I2+KNO3+H2O配平上述反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】微型化学实验能有效减少污染,节约药品。如图,某学生在衬有一张白纸的玻璃片上放置表面皿,在表面皿上的不同位置分别滴加浓度均为0.1 的
的 、
、 (含淀粉)、
(含淀粉)、 (含酚酞)、
(含酚酞)、 (含
(含 )溶液各1滴,在表面皿中心处放置2小粒
)溶液各1滴,在表面皿中心处放置2小粒 晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见
晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见 晶体很快溶解,并产生气体。
晶体很快溶解,并产生气体。

已知 能与
能与 反应生成红色络合物
反应生成红色络合物 。
。
(1)①写出化学实验室中用 制取
制取 的化学方程式:
的化学方程式:____ 。
②完成本实验中制取 的化学方程式:
的化学方程式:___ 
____ 
____ 
___ 
____ 
____ ,如该反应中消耗还原剂的物质的量为8 ,则转移电子数目为
,则转移电子数目为______ 。
(2)b处的实验现象为______ 。c处的实验现象为_______ 。
(3)d处反应的离子方程式为____ 。
(4)通过该实验能比较 、
、 、
、 三种物质氧化性的强弱,其氧化性由强到弱的顺序是
三种物质氧化性的强弱,其氧化性由强到弱的顺序是_____ 。
 的
的 、
、 (含淀粉)、
(含淀粉)、 (含酚酞)、
(含酚酞)、 (含
(含 )溶液各1滴,在表面皿中心处放置2小粒
)溶液各1滴,在表面皿中心处放置2小粒 晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见
晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见 晶体很快溶解,并产生气体。
晶体很快溶解,并产生气体。
已知
 能与
能与 反应生成红色络合物
反应生成红色络合物 。
。(1)①写出化学实验室中用
 制取
制取 的化学方程式:
的化学方程式:②完成本实验中制取
 的化学方程式:
的化学方程式:




 ,则转移电子数目为
,则转移电子数目为(2)b处的实验现象为
(3)d处反应的离子方程式为
(4)通过该实验能比较
 、
、 、
、 三种物质氧化性的强弱,其氧化性由强到弱的顺序是
三种物质氧化性的强弱,其氧化性由强到弱的顺序是
您最近一年使用:0次
【推荐3】根据所学知识回答下列问题:
(1)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不可能发生的是_______。
(2)从旧CUP中回收金部分流程如下

若用Zn粉将溶液中的1.2个HAuCl4完全还原,则参加反应的Zn的个数是_______ 。
(3)饮用水中 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉还原
的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉还原 ,在该反应中铝粉转化为[Al(OH)4]-。若0.25个单质铝恰好还原0.15个
,在该反应中铝粉转化为[Al(OH)4]-。若0.25个单质铝恰好还原0.15个 ,则
,则 被还原为
被还原为_______ (写化学式)
(4)Na2S2O3是一种常用除氯剂,其溶液与Cl2发生反应时生成NaCl和两种强酸,则该反应的离子方程式为:______________ ,若有0.5个Na2S2O3作还原剂完全反应,则转移的电子数为_______ 。
(1)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不可能发生的是_______。
A.2Fe3++SO2+2H2O=2Fe2++ +4H+ +4H+ | B.H2SO4+2HI=I2+SO2+2H2O |
| C.SO2+O2+2H2O=H2O2+H2SO4 | D.2Fe2++I2=2Fe3++2I- |

若用Zn粉将溶液中的1.2个HAuCl4完全还原,则参加反应的Zn的个数是
(3)饮用水中
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉还原
的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉还原 ,在该反应中铝粉转化为[Al(OH)4]-。若0.25个单质铝恰好还原0.15个
,在该反应中铝粉转化为[Al(OH)4]-。若0.25个单质铝恰好还原0.15个 ,则
,则 被还原为
被还原为(4)Na2S2O3是一种常用除氯剂,其溶液与Cl2发生反应时生成NaCl和两种强酸,则该反应的离子方程式为:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产氯化铜晶体的流程如图:
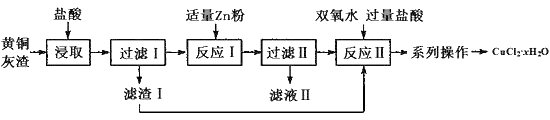
写出反应Ⅱ的化学方程式:__ 。

写出反应Ⅱ的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】铁是应用最广泛的金属,铁的卤化物、氧化物等均为重要化合物。回答下列问题。
(1)FeCl3溶液吸可以吸收烟气中的SO2,该反应的离子方程式是___________ 。
(2)已知反应:3Br2 + 6FeCl2 = 4FeCl3 + 2FeBr3,向1L 0.4mol/L的FeBr2溶液中通入6.72LCl2(标准状况),写出该反应的离子方程式(用总方程式表示)___________
(3)已知铁的某种氧化物化学式为FexO(x<1),铁元素的质量分数为76.3%,则FexO中x值(精确至0.01)为___________ ,该氧化物中的Fe分别为Fe2+、Fe3+,计算n(Fe2+):n(Fe3+)= ___________
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe H2
H2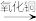 Cu,②CuO
Cu,②CuO  CuSO4
CuSO4 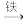 Cu。
Cu。
若实验过程中,根据规范的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是___________
A.相等 B.①多 C.②多 D.无法判断
(5)在铁与铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1 g;再向其中加入一定量稀硫酸,充分振荡后,剩余金属m2 g,则m1___________ (填“大于”、“可能大于”、“等于”或“可能等于”)m2
(6)以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4molFe(OH)3沉淀,此间共消耗的水的物质的量为___________ mol
(1)FeCl3溶液吸可以吸收烟气中的SO2,该反应的离子方程式是
(2)已知反应:3Br2 + 6FeCl2 = 4FeCl3 + 2FeBr3,向1L 0.4mol/L的FeBr2溶液中通入6.72LCl2(标准状况),写出该反应的离子方程式(用总方程式表示)
(3)已知铁的某种氧化物化学式为FexO(x<1),铁元素的质量分数为76.3%,则FexO中x值(精确至0.01)为
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe
 H2
H2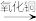 Cu,②CuO
Cu,②CuO  CuSO4
CuSO4 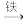 Cu。
Cu。若实验过程中,根据规范的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是
A.相等 B.①多 C.②多 D.无法判断
(5)在铁与铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1 g;再向其中加入一定量稀硫酸,充分振荡后,剩余金属m2 g,则m1
(6)以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4molFe(OH)3沉淀,此间共消耗的水的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出P在周期表中的位置____________________ ;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为__________________________ ;
(3)实验④中的现象为:_______________________________________________ ;
(4)实验②反应的离子方程式是:________________________________________ ;
(5)实验③反应的离子方程式是:_______________________________________ 。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出P在周期表中的位置
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为
(3)实验④中的现象为:
(4)实验②反应的离子方程式是:
(5)实验③反应的离子方程式是:
您最近一年使用:0次
【推荐1】回答下列问题:
(1)请配平以下的氧化还原方程式:。
①□ □
□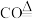 □
□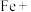 □
□
______
②□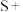 □
□ □
□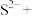 □
□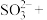 □
□
______
③□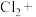 □
□ □_______=□
□_______=□ □
□ □
□ (缺了一种反应物)
(缺了一种反应物)________
(2)已知还原性强弱顺序是 ,向含有
,向含有 、
、 、
、 的溶液中通入氯气,先被氧化的离子是
的溶液中通入氯气,先被氧化的离子是___________ 。
(3)高铁酸钠(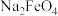 )被公认为绿色净水剂,比
)被公认为绿色净水剂,比 、
、 ,
, 氧化性更强,无二次污染:
氧化性更强,无二次污染:
①干法制备高铁酸钠的主要反应为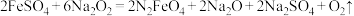 ,该反应中的氧化剂为
,该反应中的氧化剂为___________ ,氧化产物为___________ 。
②除了干法制备高铁酸钠,还可用湿法制备高铁酸钠,其反应物和生成物共有七种微粒: 、
、 、
、 、
、 、
、 、
、 、
、 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。
(1)请配平以下的氧化还原方程式:。
①□
 □
□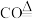 □
□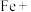 □
□
②□
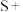 □
□ □
□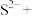 □
□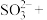 □
□
③□
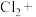 □
□ □_______=□
□_______=□ □
□ □
□ (缺了一种反应物)
(缺了一种反应物)(2)已知还原性强弱顺序是
 ,向含有
,向含有 、
、 、
、 的溶液中通入氯气,先被氧化的离子是
的溶液中通入氯气,先被氧化的离子是(3)高铁酸钠(
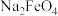 )被公认为绿色净水剂,比
)被公认为绿色净水剂,比 、
、 ,
, 氧化性更强,无二次污染:
氧化性更强,无二次污染:①干法制备高铁酸钠的主要反应为
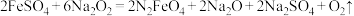 ,该反应中的氧化剂为
,该反应中的氧化剂为②除了干法制备高铁酸钠,还可用湿法制备高铁酸钠,其反应物和生成物共有七种微粒:
 、
、 、
、 、
、 、
、 、
、 、
、 ,写出该反应的离子方程式:
,写出该反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】二价铁(Fe2+)的性质
(1)化合价:+2价,处于_______ 价态。
(2)性质预测:既有_______ 又有_______ 。
(3)与氧化剂、还原剂的反应

①与Cl2反应:_______ 。
②与稀HNO3反应:_______ 。
③与HClO反应:_______ 。
④与Zn反应:_______ 。
(1)化合价:+2价,处于
(2)性质预测:既有
(3)与氧化剂、还原剂的反应

①与Cl2反应:
②与稀HNO3反应:
③与HClO反应:
④与Zn反应:
您最近一年使用:0次
【推荐3】2022年第14号台风“梅花”过后,对环境进行消毒杀菌、获取洁净的饮用水都需要大量消毒剂,开发具有广谱、高效、低毒的杀菌消毒剂是今后发展的趋势。
(1)传统杀菌消毒剂漂白粉在水体中产生强氧化性物质而发挥作用,其化学方程式为:_____ 。
(2)过氧乙酸(CH3COOOH)是一种多用途的新型液体消毒杀菌剂,它具有CH3COOH和H2O2的双重性质。下列物质与过氧乙酸混合,不会使过氧乙酸失效的是_____ (填序号)。
(3)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1molO3转化为1molO2和1molH2O)等物质常被用作消毒剂。等物质的量的上述物质中消毒效率最高的是_____ (填序号)。
(1)传统杀菌消毒剂漂白粉在水体中产生强氧化性物质而发挥作用,其化学方程式为:
(2)过氧乙酸(CH3COOOH)是一种多用途的新型液体消毒杀菌剂,它具有CH3COOH和H2O2的双重性质。下列物质与过氧乙酸混合,不会使过氧乙酸失效的是
| A.FeCl2溶液 | B.KMnO4溶液 | C.稀盐酸 | D.NaHCO3溶液 |
| A.Cl2 | B.H2O2 | C.O3 | D.ClO2 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】举重运动员常常会抓一把“镁粉”在手里搓,以起到防滑效果,某种“镁粉”中只含有 、
、 、
、 中的一种或几种固体。某兴趣小组对其成分展开了探究:分别取4.2克
中的一种或几种固体。某兴趣小组对其成分展开了探究:分别取4.2克 、
、 、
、 和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡,请结合实验现象和数据回答问题。
和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡,请结合实验现象和数据回答问题。
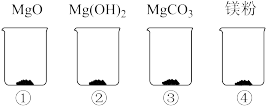
(1)烧杯③中产生的气体是___________ 。
(2)“镁粉”中不只含有 一种物质,理由是
一种物质,理由是___________ 。
(3)表格中m的值为___________ 。
(4)为确定“镁粉”的具体成分,兴趣小组补充了如下实验:取“镁粉”和 各4.2克,加入足量稀盐酸,生成相同条件下的气体体积分别为952毫升和1120毫升,由此可知该种“镁粉”的成分是___________
各4.2克,加入足量稀盐酸,生成相同条件下的气体体积分别为952毫升和1120毫升,由此可知该种“镁粉”的成分是___________
 、
、 、
、 中的一种或几种固体。某兴趣小组对其成分展开了探究:分别取4.2克
中的一种或几种固体。某兴趣小组对其成分展开了探究:分别取4.2克 、
、 、
、 和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡,请结合实验现象和数据回答问题。
和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡,请结合实验现象和数据回答问题。
| 物质 |  |  |  | “美粉” |
| 消耗盐酸的质量/g | 121.8 | m | 58.0 | 61.9 |
(2)“镁粉”中不只含有
 一种物质,理由是
一种物质,理由是(3)表格中m的值为
(4)为确定“镁粉”的具体成分,兴趣小组补充了如下实验:取“镁粉”和
 各4.2克,加入足量稀盐酸,生成相同条件下的气体体积分别为952毫升和1120毫升,由此可知该种“镁粉”的成分是___________
各4.2克,加入足量稀盐酸,生成相同条件下的气体体积分别为952毫升和1120毫升,由此可知该种“镁粉”的成分是___________A. 和 和 | B. 和 和 |
C. 和 和 | D. |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】某固体混合物可能含有碳酸钠、硫酸铜、硫酸钾和硝酸钡。现进行以下实验:
步骤一:将该混合物放入足量水中,产生白色沉淀,过滤得无色透明溶液;
步骤二:再加入足量的稀硝酸,沉淀全部溶解,逸出无色气体,所得溶液澄清透明:
步骤三:最后加入稀硫酸,又立刻出现白色沉淀。
根据上述现象可推断,原混合物中肯定有_________ ,肯定没有_________ 。(填化学式)
步骤一:将该混合物放入足量水中,产生白色沉淀,过滤得无色透明溶液;
步骤二:再加入足量的稀硝酸,沉淀全部溶解,逸出无色气体,所得溶液澄清透明:
步骤三:最后加入稀硫酸,又立刻出现白色沉淀。
根据上述现象可推断,原混合物中肯定有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。回答下列问题:
(1)岩脑砂的制备

①该实验中用依盐酸与MnO2 反应制取所需氯气,则装置F中的试剂是______ (填试剂名称)。
②为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:___→ef←____(用小写字母和箭头表示,箭头方向与气流方向一致)。________________
③装置D处有两个明显的不足之处,请指出________________________________ 。
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要_________________________________ 。
(2)岩脑砂中元素的测定准确称取ag岩脑砂,与足量的氧化铜混合加热(发生的反应为2NH4Cl+3CuO 3Cu+N2↑+2HCl↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
3Cu+N2↑+2HCl↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。

①设置装置H的目的是_____________________________________________ 。
②若装置I增重bg,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为24.5 L/mol),则岩脑砂中m(N) : m(Cl)=________ (用含b、V 的代数式表示,不必化简)。
若测量体积时气体温度高于常温(其他操作均正确),则m(N)比正常值____ (填“偏高”“偏低”或“无影响”)。
(1)岩脑砂的制备

①该实验中用依盐酸与MnO2 反应制取所需氯气,则装置F中的试剂是
②为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:___→ef←____(用小写字母和箭头表示,箭头方向与气流方向一致)。
③装置D处有两个明显的不足之处,请指出
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要
(2)岩脑砂中元素的测定准确称取ag岩脑砂,与足量的氧化铜混合加热(发生的反应为2NH4Cl+3CuO
 3Cu+N2↑+2HCl↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
3Cu+N2↑+2HCl↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
①设置装置H的目的是
②若装置I增重bg,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为24.5 L/mol),则岩脑砂中m(N) : m(Cl)=
若测量体积时气体温度高于常温(其他操作均正确),则m(N)比正常值
您最近一年使用:0次



