名校
解题方法
1 . 下列指定反应的离子方程式书写正确的是
A.将氯气通入水中: |
B. 溶液与少量的 溶液与少量的 溶液混合: 溶液混合: |
C. 通入酸性高锰酸钾溶液:5SO2+2 通入酸性高锰酸钾溶液:5SO2+2 +2H2O = 5 +2H2O = 5 +2Mn2++4H+ +2Mn2++4H+ |
D.向硫酸酸化的 溶液中通入O2: 溶液中通入O2: |
您最近一年使用:0次
2024-05-03更新
|
241次组卷
|
3卷引用:宁夏石嘴山市平罗中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
2 . 根据化学反应速率和化学反应限度的知识回答下列问题:
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:___________ 。
(2)反应开始至4 min时,A的平均反应速率为___________ 。
(3)4 min时,反应是否达平衡状态?___________ (填“是”或“否”),8 min时,v正___________ v逆。(填“>”“<”或“=”)
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。___________ 。
(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为___________ 。
②反应达到平衡时,放出的热量___________ (填字母,下同)。
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为___________ 。
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)__________
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:
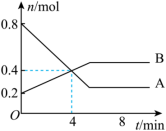
(2)反应开始至4 min时,A的平均反应速率为
(3)4 min时,反应是否达平衡状态?
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为
②反应达到平衡时,放出的热量
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)

您最近一年使用:0次
2024-04-30更新
|
279次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
3 . 运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3: ,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。 ___________ (填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)课本里介绍的合成氨技术叫哈伯法: ,应用此法反应达到平衡时反应物的转化率不高。
,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是___________ (填编号)。
A.使用更高效的催化剂 B.升高温度
C.减小体积 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2 的物质的量随时间的变化曲线。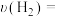
___________ 。从第11min起,扩大容器的体积为4 L,则n(N2) 的变化曲线为___________ (填编号)。
(3)实验室模拟用浓硫酸脱除氮氧化物,装置如图所示,实验开始后装置C中发生反应:NO+NO2+2H2SO4(浓)=2NOHSO4+H2O。___________ ,装置B的作用是___________ 。
②理论上应控制相同时间内a、b处通入气体的物质的量之比为___________ 。
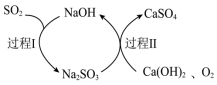
(4)可用双碱法(氢氧化钙为悬浊液)脱硫处理工业废气中的SO2,原理如图所示,双碱法脱硫的总反应方程式为___________ 。
(1)硫酸生产中,SO2催化氧化生成SO3:
 ,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。 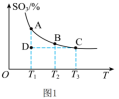
②若反应进行到状态D时,

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)课本里介绍的合成氨技术叫哈伯法:
 ,应用此法反应达到平衡时反应物的转化率不高。
,应用此法反应达到平衡时反应物的转化率不高。①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是
A.使用更高效的催化剂 B.升高温度
C.减小体积 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2 的物质的量随时间的变化曲线。
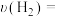
(3)实验室模拟用浓硫酸脱除氮氧化物,装置如图所示,实验开始后装置C中发生反应:NO+NO2+2H2SO4(浓)=2NOHSO4+H2O。
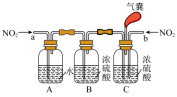
②理论上应控制相同时间内a、b处通入气体的物质的量之比为
(4)可用双碱法(氢氧化钙为悬浊液)脱硫处理工业废气中的SO2,原理如图所示,双碱法脱硫的总反应方程式为
您最近一年使用:0次
名校
解题方法
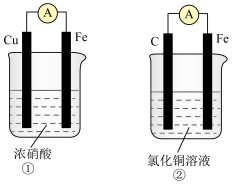
4 . 任何化学反应都伴随着能量的变化,化学能可转化为热能、电能等。回答下列有关问题:
(1)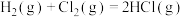 的反应过程如图所示:
的反应过程如图所示:___________ (填“放热”或“吸热”)反应,生成2molHCl(g)吸收或放出的热量为___________ 。
(2)下列变化中属于吸热反应的是___________ (填标号)。
①液态水汽化 ②生石灰与水反应
③ ④
④ 与固体
与固体 混合
混合
(3)用如图装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则 a 电极的电极反应式为___________ ,当量筒中收集到 336mL(标准状况下)气体时,通过导线的电子的物质的量为___________ 。___________ 极(填“正”或“负”)。___________ (填“①”或“②”)该装置中的正极的电极反应式为___________ ;电子从___________ (填电极材料)流向___________ (填电极材料)
(1)
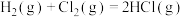 的反应过程如图所示:
的反应过程如图所示: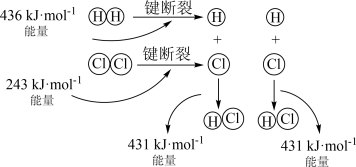
(2)下列变化中属于吸热反应的是
①液态水汽化 ②生石灰与水反应
③
 ④
④ 与固体
与固体 混合
混合(3)用如图装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则 a 电极的电极反应式为
您最近一年使用:0次
名校
5 . 一定条件下可合成乙烯:6H2(g)+2CO2(g) ⇌CH2=CH2 (g)+4H2O(g) 已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是
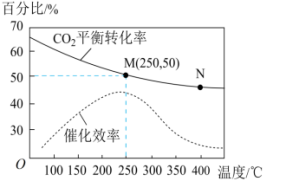
| A.温度不变,若增大压强,ν正增加、ν逆减小 |
| B.升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 |
| C.温度不变,若恒压下向平衡体系中充入惰性气体,平衡不移动 |
| D.若投料比n(H2):n(CO2)=3:1,则图中 M点乙烯的体积分数为7.7% |
您最近一年使用:0次
名校
6 . 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是

| A.洗气瓶中产生的沉淀是硫酸钡 |
| B.在Z导管出来的气体中无二氧化碳 |
| C.洗气瓶中产生的沉淀是碳酸钡 |
| D.在Z导管口无明显现象 |
您最近一年使用:0次
7 . 下列实验装置或设计能完成相应实验的是
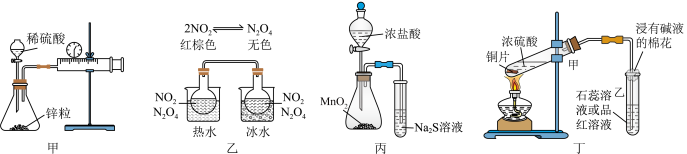
A.装置甲测定H2表示的反应速率(单位: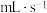 ) ) |
B.装置乙验证2NO2(g) N2O4(g)正反应是放热反应 N2O4(g)正反应是放热反应 |
| C.装置丙可比较MnO2、Cl2、S的氧化性 |
| D.装置丁中,反应后向试管甲中加水可以检验是否有CuSO4生成 |
您最近一年使用:0次
名校
解题方法
8 . 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定反应过程中产生氢气体积V的数据,根据数据绘制得如图,则曲线a、b、c、d所对应的实验组别,有关说法错误的是
| 实验组别 |  | 温度/ ℃ | 形状(Fe) |
| Ⅰ | 2.0 | 30 | 块状 |
| Ⅱ | 2.5 | 30 | 块状 |
| Ⅲ | 2.5 | 50 | 粉末状 |
| Ⅳ | 2.5 | 50 | 块状 |
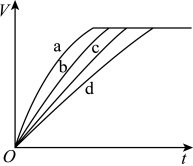
| A.曲线a对应的实验组别为Ⅲ |
| B.对比实验Ⅰ、Ⅱ说明浓度对化学反应速率的影响 |
| C.对比实验Ⅱ、Ⅳ说明温度对化学反应速率的影响 |
| D.曲线a、b、c、d对应的实验组别分别为Ⅳ、Ⅲ、Ⅱ、Ⅰ |
您最近一年使用:0次
2024-04-30更新
|
116次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
9 . 下列各组离子在指定溶液中一定可以大量共存的是
A.新制氯水中:K+、Fe3+、S2-、 |
B.在pH=12的溶液中:Na+、Mg2+、 、 、 |
C.遇紫色石蕊溶液变红的溶液中:Na+、Fe2+、 、 、 |
D.滴加酚酞试液呈红色的溶液中:Na+、K+、 、 、 |
您最近一年使用:0次
名校
10 . 某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。(已知:C+2H2SO4(浓) CO2+2SO2↑+2H2O)
CO2+2SO2↑+2H2O)
(1)有同学认为制得的SO2中可能混有杂质,其化学式为_________ 。
为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。_________ ;装置C中品红溶液的作用是_________ 。
(3)装置H的作用为_________ 。
兴趣小组设计如图装置验证二氧化硫的化学性质。___________ ;
为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
(5)上述方案中合理的是___________ (填Ⅰ、Ⅱ或Ⅲ);试管b中发生反应的离子方程式为___________ 。
(6)如果用硫酸溶液和 固体反应制取
固体反应制取 装置如图所示。其中
装置如图所示。其中 导管的作用是
导管的作用是________ 。 含量(假设空气中无其他还原性气体)。
含量(假设空气中无其他还原性气体)。 (标准状况下),最终所得固体质量为
(标准状况下),最终所得固体质量为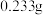 ,通过计算确定该空气中二氧化硫的含量是
,通过计算确定该空气中二氧化硫的含量是________ 。(结果精确到 )
)
 CO2+2SO2↑+2H2O)
CO2+2SO2↑+2H2O)(1)有同学认为制得的SO2中可能混有杂质,其化学式为
为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。
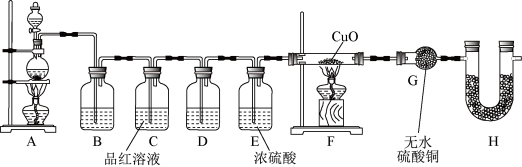
(3)装置H的作用为
兴趣小组设计如图装置验证二氧化硫的化学性质。

为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
(5)上述方案中合理的是
(6)如果用硫酸溶液和
 固体反应制取
固体反应制取 装置如图所示。其中
装置如图所示。其中 导管的作用是
导管的作用是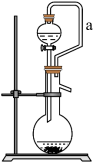
 含量(假设空气中无其他还原性气体)。
含量(假设空气中无其他还原性气体)。
 (标准状况下),最终所得固体质量为
(标准状况下),最终所得固体质量为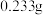 ,通过计算确定该空气中二氧化硫的含量是
,通过计算确定该空气中二氧化硫的含量是 )
)
您最近一年使用:0次
2024-04-29更新
|
167次组卷
|
2卷引用:宁夏石嘴山市平罗中学2023-2024学年高一下学期4月月考化学试题



