名校
解题方法
1 . 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。回答下列问题:
(1)SiO2属于___________ (填“酸性”“碱性”或“两性”)氧化物。盛装NaOH溶液的试剂瓶不能用玻璃塞,其原因为___________ (用离子方程式表示)。
(2)用氮化硅(Si3N4)陶瓷制造发动机,能大幅度提高发动机的热效率。工业上制备氮化硅的原理为:3SiCl4+2N2+6H2 Si3N4+12HCl。
Si3N4+12HCl。
①SiCl4是___________ (填“离子化合物”或“共价化合物”)。
②若该反应转移3mol电子,生成Si3N4的质量为___________ g。
(3)芯片制作中的部分流程如图:___________ 。
Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是___________ 。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.铁坩埚
②去除磷硅玻璃即除去扩散制结过程中产生的SiO2,下列试剂合适的为___________ (填标号),写出其化学方程式:___________ 。
a.浓硫酸 b.氢氟酸 c.稀硝酸
(1)SiO2属于
(2)用氮化硅(Si3N4)陶瓷制造发动机,能大幅度提高发动机的热效率。工业上制备氮化硅的原理为:3SiCl4+2N2+6H2
 Si3N4+12HCl。
Si3N4+12HCl。①SiCl4是
②若该反应转移3mol电子,生成Si3N4的质量为
(3)芯片制作中的部分流程如图:

Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是
A.普通玻璃坩埚 B.石英玻璃坩埚 C.铁坩埚
②去除磷硅玻璃即除去扩散制结过程中产生的SiO2,下列试剂合适的为
a.浓硫酸 b.氢氟酸 c.稀硝酸
您最近一年使用:0次
名校
解题方法
2 . 如图所示,是原电池的装置图。请回答:___________ ;在反应中溶液中的阴离子移向___________ (填“A”或“B”),反应进行一段时间后溶液C中H+浓度___________ 。(填“增大”“减小”或“基本不变”)
(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为___________ ,B极电极反应式为___________ 。
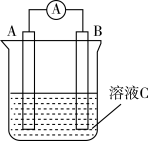
(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为
您最近一年使用:0次
名校
解题方法
3 . 化学电源是人类生产和生活的重要能量来源之一,回答下列问题。
(1)为了探究化学反应中的能量变化,某同学设计了如下两个实验。___________ (填序号)。
A.图1和图2的气泡均产生在锌棒表面
B.图1中温度计的示数高于图2的示数
C.图2中产生气体的速度比1快
D.图1和图2中温度计的示数相等,且均高于室温
②图②装置中,正极的电极反应方程式为___________ 。
(2)将反应2Fe3++Fe=3Fe2+设计成原电池装置,负极的电极反应方程式为___________ ,离子导体为___________ 。
(3)甲烷碱性燃料电池以KOH溶液为电解质溶液,电池反应为CH4+2O2+2OH- CO
CO +3H2O,该电池的负极电极反应方程式为
+3H2O,该电池的负极电极反应方程式为___________ ,K+向___________ 极(填正或负)移动,若电路中通过0.4mol电子,则理论上消耗甲烷的体积为(标况)___________ 。
(1)为了探究化学反应中的能量变化,某同学设计了如下两个实验。
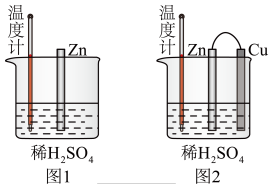
A.图1和图2的气泡均产生在锌棒表面
B.图1中温度计的示数高于图2的示数
C.图2中产生气体的速度比1快
D.图1和图2中温度计的示数相等,且均高于室温
②图②装置中,正极的电极反应方程式为
(2)将反应2Fe3++Fe=3Fe2+设计成原电池装置,负极的电极反应方程式为
(3)甲烷碱性燃料电池以KOH溶液为电解质溶液,电池反应为CH4+2O2+2OH-
 CO
CO +3H2O,该电池的负极电极反应方程式为
+3H2O,该电池的负极电极反应方程式为
您最近一年使用:0次
名校
4 . 回答下列问题:
(1)一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物分别经过浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重6.6g。求乙醇和氧气物质的量分别是___________ 、___________ 。
(2)若将0.6mol乙醇与11.5g金属钠充分反应,则标况下生成气体的体积是___________ 。
(1)一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物分别经过浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重6.6g。求乙醇和氧气物质的量分别是
(2)若将0.6mol乙醇与11.5g金属钠充分反应,则标况下生成气体的体积是
您最近一年使用:0次
名校
解题方法
5 . 一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:____________ 。
(2)反应开始到10 s间,用Z表示的反应速率v(Z)=____________ 。
(3)反应开始到10 s时,Y的转化率=___________ (转化率是指某反应物转化的物质的量与该反应物的起始物质的量的百分比)。
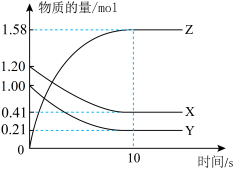
(2)反应开始到10 s间,用Z表示的反应速率v(Z)=
(3)反应开始到10 s时,Y的转化率=
您最近一年使用:0次
名校
解题方法
6 . 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和2 mol/L硫酸设计实验方案来研究影响反应速率的因素。请完成下列实验报告:
该小组的实验目的是研究反应物本身的______ 对反应速率的影响。
| 实验内容 | 实验现象 | 结论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢:Mg | 反应物的性质越 |
您最近一年使用:0次
名校
解题方法
7 . 根据化学反应速率和化学反应限度的知识回答下列问题:
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:___________ 。
(2)反应开始至4 min时,A的平均反应速率为___________ 。
(3)4 min时,反应是否达平衡状态?___________ (填“是”或“否”),8 min时,v正___________ v逆。(填“>”“<”或“=”)
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。___________ 。
(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为___________ 。
②反应达到平衡时,放出的热量___________ (填字母,下同)。
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为___________ 。
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)__________
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:
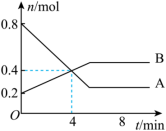
(2)反应开始至4 min时,A的平均反应速率为
(3)4 min时,反应是否达平衡状态?
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为
②反应达到平衡时,放出的热量
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)

您最近一年使用:0次
2024-04-30更新
|
385次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
8 . 运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3: ,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。 ___________ (填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)课本里介绍的合成氨技术叫哈伯法: ,应用此法反应达到平衡时反应物的转化率不高。
,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是___________ (填编号)。
A.使用更高效的催化剂 B.升高温度
C.减小体积 D.充入氮气,增大氮气的浓度(保持容器体积不变)
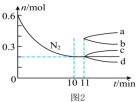
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2 的物质的量随时间的变化曲线。
___________ 。从第11min起,扩大容器的体积为4 L,则n(N2) 的变化曲线为___________ (填编号)。
(3)实验室模拟用浓硫酸脱除氮氧化物,装置如图所示,实验开始后装置C中发生反应:NO+NO2+2H2SO4(浓)=2NOHSO4+H2O。___________ ,装置B的作用是___________ 。
②理论上应控制相同时间内a、b处通入气体的物质的量之比为___________ 。
(4)可用双碱法(氢氧化钙为悬浊液)脱硫处理工业废气中的SO2,原理如图所示,双碱法脱硫的总反应方程式为___________ 。
(1)硫酸生产中,SO2催化氧化生成SO3:
 ,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。 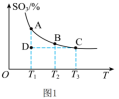
②若反应进行到状态D时,

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)课本里介绍的合成氨技术叫哈伯法:
 ,应用此法反应达到平衡时反应物的转化率不高。
,应用此法反应达到平衡时反应物的转化率不高。①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是
A.使用更高效的催化剂 B.升高温度
C.减小体积 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2 的物质的量随时间的变化曲线。
(3)实验室模拟用浓硫酸脱除氮氧化物,装置如图所示,实验开始后装置C中发生反应:NO+NO2+2H2SO4(浓)=2NOHSO4+H2O。
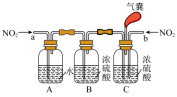
②理论上应控制相同时间内a、b处通入气体的物质的量之比为
(4)可用双碱法(氢氧化钙为悬浊液)脱硫处理工业废气中的SO2,原理如图所示,双碱法脱硫的总反应方程式为
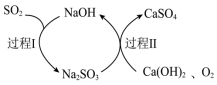
您最近一年使用:0次
名校
9 . 回答下列问题。
I.酸雨是指 pH<5.6 的降水。
(1)下列气体中,与形成酸雨无关的是_________ 。
A.CO2 B.SO2 C.NOx
(2)下列变化属于“氮的固定”的是_________ (填字母)。
(3)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:_________ 。
(4)从硫元素的化合价看,下列物质不具有氧化性的是___________。
Ⅱ.揭开浓硫酸的“神秘面纱”。
(5)在化工生产的过程中,一些试剂需要特殊的运输方式,比如具有强氧化性、强还原性、强腐蚀性等性质的试剂。通常情况下,下列物质可用铁制槽车装运的是_________。
I.酸雨是指 pH<5.6 的降水。
(1)下列气体中,与形成酸雨无关的是
A.CO2 B.SO2 C.NOx
(2)下列变化属于“氮的固定”的是_________ (填字母)。
| A.植物从土壤中吸收氮肥 | B.将空气中的氮气转变为氮的化合物 |
| C.硝酸和氨气反应生成氮肥 | D.大豆的根瘤菌将含氮的化合物转变为植物蛋白质 |
(4)从硫元素的化合价看,下列物质不具有氧化性的是___________。
| A.Na2S | B.S | C.SO2 | D.H2SO4 |
Ⅱ.揭开浓硫酸的“神秘面纱”。
(5)在化工生产的过程中,一些试剂需要特殊的运输方式,比如具有强氧化性、强还原性、强腐蚀性等性质的试剂。通常情况下,下列物质可用铁制槽车装运的是_________。
| A.浓盐酸 | B.浓硫酸 | C.稀硫酸 | D.浓氢氧化钠溶液 |
您最近一年使用:0次
名校
解题方法
10 . 向盛有下列溶液的试管中分别通入SO2气体:①NaOH溶液(滴有酚酞溶液);②紫色石蕊溶液;③品红溶液;④酸性高锰酸钾溶液;⑤硫化钠溶液。请回答下列问题:
(1)试管①中的现象是_______ ,发生反应的离子方程式为_______
(2)试管③中的现象是_______ 若将吸收SO2的溶液加热,现象是_______ 。
(3)上述实验,SO2表现出还原性的是_______ (填序号,下同),SO2表现出漂白性的是_______ 。
(1)试管①中的现象是
(2)试管③中的现象是
(3)上述实验,SO2表现出还原性的是
您最近一年使用:0次



