名校
解题方法
1 . 二甲醚(CH3OCH3)是一种绿色、可再生的新能源。
(1)①二甲醚(CH3OCH3)与乙醇(CH3CH2OH)的关系是___________ 。
②25℃、101kPa时,若1g二甲醚气体完全燃烧生成液态水放出mkJ的热量,则1mol二甲醚完全燃烧,放出的能量是___________ kJ。
(2)一定条件下,可用下列反应制得二甲醚:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
①在体积为2L密闭容器中,通入一定量的一氧化碳和氢气,2min末生成9g的水,2min 内CO的平均反应速率___________ mol/(L·min)。
②下列措施能够使该反应速率加快的是___________ 。
A.升高温度 B.降低压强 C.及时移走二甲醚
③若该反应在恒容密闭容器中进行,下列能说明该反应已达平衡状态的是___________ 。
A.单位时间内生成1mol CO,同时生成2mol H2
B.CH3OCH3的浓度不再变化
C.容器内气体的压强不再变化
D.CH3OCH3与H2O的物质的量相等
(3)二甲醚(CH3OCH3)“燃料电池”的工作原理如图所示:___________ (填“正极”或“负极”)。
②a电极的电极反应式为___________ 。
(1)①二甲醚(CH3OCH3)与乙醇(CH3CH2OH)的关系是
②25℃、101kPa时,若1g二甲醚气体完全燃烧生成液态水放出mkJ的热量,则1mol二甲醚完全燃烧,放出的能量是
(2)一定条件下,可用下列反应制得二甲醚:2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。①在体积为2L密闭容器中,通入一定量的一氧化碳和氢气,2min末生成9g的水,2min 内CO的平均反应速率
②下列措施能够使该反应速率加快的是
A.升高温度 B.降低压强 C.及时移走二甲醚
③若该反应在恒容密闭容器中进行,下列能说明该反应已达平衡状态的是
A.单位时间内生成1mol CO,同时生成2mol H2
B.CH3OCH3的浓度不再变化
C.容器内气体的压强不再变化
D.CH3OCH3与H2O的物质的量相等
(3)二甲醚(CH3OCH3)“燃料电池”的工作原理如图所示:
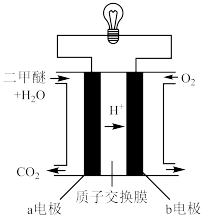
②a电极的电极反应式为
您最近一年使用:0次
2 . 乙烯( )是一种重要的有机化工原料,其产量可以用来衡量一个国家的石油化工发展水平,回答下列问题。
)是一种重要的有机化工原料,其产量可以用来衡量一个国家的石油化工发展水平,回答下列问题。
(1)乙烯分子中的官能团名称为___________ (填“碳碳双键”或“碳碳三键”);从有机物的类别来看,乙烯属于___________ (填“饱和烃”或“不饱和烃”)。
(2)工业上可用乙烯制备乙醇,其反应的化学方程式为: 。该反应属于反应
。该反应属于反应___________ (填“加成”或“取代”)。
(3)在一定条件下,乙烯发生加聚反应生成重要的高分子化合物聚乙烯(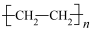 ),其反应的化学方程式为
),其反应的化学方程式为___________ 。
 )是一种重要的有机化工原料,其产量可以用来衡量一个国家的石油化工发展水平,回答下列问题。
)是一种重要的有机化工原料,其产量可以用来衡量一个国家的石油化工发展水平,回答下列问题。(1)乙烯分子中的官能团名称为
(2)工业上可用乙烯制备乙醇,其反应的化学方程式为:
 。该反应属于反应
。该反应属于反应(3)在一定条件下,乙烯发生加聚反应生成重要的高分子化合物聚乙烯(
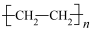 ),其反应的化学方程式为
),其反应的化学方程式为
您最近一年使用:0次
3 . 下表显示了元素周期表中短周期的大部分结构,①~④4种元素和氯元素在其中的位置如下。
回答下列问题:
(1)①的元素符号为___________ 。
(2)②的原子结构示意图为___________ 。
(3)③的最高价氧化物对应的水化物的化学式为___________ (填“ ”或“
”或“ ”)。
”)。
(4)④的单质在氧气中燃烧,可生成一种具有漂白作用的气体,写出其反应的化学方程式___________ 。
| ① | ||||||
| ② | ③ | |||||
| ④ | Cl | |||||
(1)①的元素符号为
(2)②的原子结构示意图为
(3)③的最高价氧化物对应的水化物的化学式为
 ”或“
”或“ ”)。
”)。(4)④的单质在氧气中燃烧,可生成一种具有漂白作用的气体,写出其反应的化学方程式
您最近一年使用:0次
名校
解题方法
4 . 硫及其化合物是十分重要的化工原料。
Ⅰ.工业上一般以硫磺或其他含硫矿物为原料制备硫酸。金属冶炼时产生的含二氧化硫废气经回收后也可用于制备硫酸。___________ 。
(2)用98.3%的浓硫酸吸收 而不用水的原因为
而不用水的原因为___________ 。
Ⅱ.某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气)___________ (答操作)。
(4)已知开始时量气管读数为 mL,最终读数为
mL,最终读数为 mL(均折合成标准状况,且
mL(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为___________ mol/L。
Ⅲ.实验小组为探究 与
与 溶液的反应,进行了以下实验。
溶液的反应,进行了以下实验。
实验一:用如下装置(夹持、加热仪器略)制备 ,将足量
,将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B,经分析得出,沉淀B可能为
溶液中,迅速反应,得到无色溶液A和白色沉淀B,经分析得出,沉淀B可能为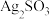 、(微溶)或二者的混合物。
、(微溶)或二者的混合物。 溶液,未出现白色沉淀。
溶液,未出现白色沉淀。
(5)实验二可判断B中不含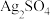 。做出判断的理由为
。做出判断的理由为___________ 。
(6)由实验二可知,实验一中, 与
与 溶液反应的离子方程式是
溶液反应的离子方程式是___________ 。
根据物质性质分析, 与
与 溶液应该可以发生氧化还原反应。
溶液应该可以发生氧化还原反应。
实验三:将实验一所得混合物隔绝空气放置一段时间,有Ag和 生成。
生成。
(7)根据实验一、二、三,可得结论为___________ 。
Ⅰ.工业上一般以硫磺或其他含硫矿物为原料制备硫酸。金属冶炼时产生的含二氧化硫废气经回收后也可用于制备硫酸。

(2)用98.3%的浓硫酸吸收
 而不用水的原因为
而不用水的原因为Ⅱ.某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气)

(4)已知开始时量气管读数为
 mL,最终读数为
mL,最终读数为 mL(均折合成标准状况,且
mL(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为Ⅲ.实验小组为探究
 与
与 溶液的反应,进行了以下实验。
溶液的反应,进行了以下实验。实验一:用如下装置(夹持、加热仪器略)制备
 ,将足量
,将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B,经分析得出,沉淀B可能为
溶液中,迅速反应,得到无色溶液A和白色沉淀B,经分析得出,沉淀B可能为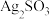 、(微溶)或二者的混合物。
、(微溶)或二者的混合物。
 溶液,未出现白色沉淀。
溶液,未出现白色沉淀。(5)实验二可判断B中不含
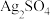 。做出判断的理由为
。做出判断的理由为(6)由实验二可知,实验一中,
 与
与 溶液反应的离子方程式是
溶液反应的离子方程式是根据物质性质分析,
 与
与 溶液应该可以发生氧化还原反应。
溶液应该可以发生氧化还原反应。实验三:将实验一所得混合物隔绝空气放置一段时间,有Ag和
 生成。
生成。(7)根据实验一、二、三,可得结论为
您最近一年使用:0次
名校
5 . 电池在人们的生产生活中起着重要的作用,请回答下列问题:
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,放电时的总反应为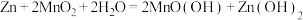 。该电池的正极为
。该电池的正极为 ,其电极反应式为:
,其电极反应式为:___________ 。___________ ;
②写出a电极上发生的电极反应___________ 。
(3)钴酸锂电池的正极采用钴酸锂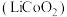 ,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式:
,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式: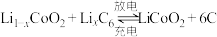 ,写出放电时负极的电极反应
,写出放电时负极的电极反应___________ 。
(4)利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
①烧渣是LiCl、 和
和 的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为
的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为___________ ;
②“滤饼2”的主要成分是___________ ,常温下, 的溶解度比LiOH
的溶解度比LiOH___________ (填“大”或“小”);
③“850℃煅烧”时的化学方程式为:___________ ;
④在实验室检查滤饼2是否洗涤干净的具体操作是:___________ 。
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,放电时的总反应为
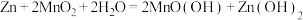 。该电池的正极为
。该电池的正极为 ,其电极反应式为:
,其电极反应式为: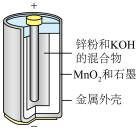
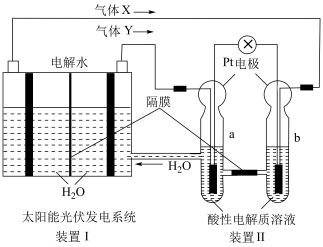
②写出a电极上发生的电极反应
(3)钴酸锂电池的正极采用钴酸锂
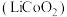 ,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式:
,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式: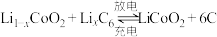 ,写出放电时负极的电极反应
,写出放电时负极的电极反应(4)利用
 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: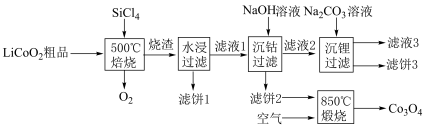
①烧渣是LiCl、
 和
和 的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为
的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为②“滤饼2”的主要成分是
 的溶解度比LiOH
的溶解度比LiOH③“850℃煅烧”时的化学方程式为:
④在实验室检查滤饼2是否洗涤干净的具体操作是:
您最近一年使用:0次
解题方法
6 . 化学在日常防疫中发挥了重要作用,各类杀菌消毒剂逐渐被人们认识和使用。下列是我们常见的几种消毒剂:①“84”消毒液;②3%H2O2溶液;③漂白粉;④ClO2;⑤O3;⑥碘酒;⑦75%酒精;⑧高铁酸钠(Na2FeO4)。按要求回答下列问题。
(1)上述杀菌消毒剂属于电解质的是___________ ,属于非电解质的是__________ 。(填序号)。
(2)“84”消毒液可由Cl2和NaOH溶液反应制得,若与“洁厕灵”(盐酸是成分之一)混合使用会产生黄绿色有毒气体,原因是_________ (用离子方程式表示)。
(3)H2O2是一种绿色环保型消毒剂,其结构式为__________ ,含有化学键的类型为__________ 。
(4)O3是一种强氧化剂,具有强大的杀菌能力。O3与O2的关系是互为__________ 。
(5)高铁酸钠(Na2FeO4)是一种多功能新型净水剂。工业上可在NaOH溶液中,用NaClO氧化Fe(OH)3的方法制备Na2FeO4,其离子方程式为__________ ,Na2FeO4在水中可以发生反应: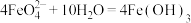 (胶体)
(胶体)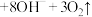 ,当反应转移的电子数为
,当反应转移的电子数为 时,生成标准状态下O2的体积约为
时,生成标准状态下O2的体积约为__________ 。
(1)上述杀菌消毒剂属于电解质的是
(2)“84”消毒液可由Cl2和NaOH溶液反应制得,若与“洁厕灵”(盐酸是成分之一)混合使用会产生黄绿色有毒气体,原因是
(3)H2O2是一种绿色环保型消毒剂,其结构式为
(4)O3是一种强氧化剂,具有强大的杀菌能力。O3与O2的关系是互为
(5)高铁酸钠(Na2FeO4)是一种多功能新型净水剂。工业上可在NaOH溶液中,用NaClO氧化Fe(OH)3的方法制备Na2FeO4,其离子方程式为
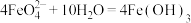 (胶体)
(胶体)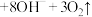 ,当反应转移的电子数为
,当反应转移的电子数为 时,生成标准状态下O2的体积约为
时,生成标准状态下O2的体积约为
您最近一年使用:0次
解题方法
7 . I.现有A、B、C、D四种可溶性物质,它们溶于水后电离产生的所有离子如下表所示:(各物质中所含离子均不相同)
已知:①A物质是中学里用来检验Cl-的盐;
②向B物质的溶液中滴入无色酚酞溶液,呈红色;
③C物质分别与其它三种物质在溶液中反应均能产生白色沉淀,且B和C反应产生的白色沉淀会迅速变为灰绿色,最后变为红褐色。
回答下列问题:
(1)写出下列物质的化学式:A___________ ,D___________ 。
(2)写出③中沉淀颜色变化过程中涉及的化学反应方程式___________ 。
(3)检验溶液中Fe2+是否变质的操作是___________ 。
(4)D物质和C物质在溶液中反应的离子方程式为___________ 。
II.研究钠及其化合物的性质有重要的意义。
(5)某同学向 和
和 的混合液中逐滴加入一定浓度的盐酸,生成
的混合液中逐滴加入一定浓度的盐酸,生成 的体积(标准状况)与加入盐酸的体积的关系如图所示:
的体积(标准状况)与加入盐酸的体积的关系如图所示: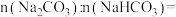
___________ 。
②盐酸的物质的量浓度为___________ 。
| 阳离子 |
|
| 阴离子 |
|
②向B物质的溶液中滴入无色酚酞溶液,呈红色;
③C物质分别与其它三种物质在溶液中反应均能产生白色沉淀,且B和C反应产生的白色沉淀会迅速变为灰绿色,最后变为红褐色。
回答下列问题:
(1)写出下列物质的化学式:A
(2)写出③中沉淀颜色变化过程中涉及的化学反应方程式
(3)检验溶液中Fe2+是否变质的操作是
(4)D物质和C物质在溶液中反应的离子方程式为
II.研究钠及其化合物的性质有重要的意义。
(5)某同学向
 和
和 的混合液中逐滴加入一定浓度的盐酸,生成
的混合液中逐滴加入一定浓度的盐酸,生成 的体积(标准状况)与加入盐酸的体积的关系如图所示:
的体积(标准状况)与加入盐酸的体积的关系如图所示:
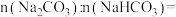
②盐酸的物质的量浓度为
您最近一年使用:0次
名校
解题方法
8 . 某小组同学设计实验实现几种价态硫元素的转化。
Ⅰ:从下列试剂中选择合适的试剂实现S(+6价)→S(+4价)的转化。
试剂清单:①浓H2SO4;②稀H2SO4;③酸性KMnO4溶液;④Na2SO3溶液;⑤Cu;⑥品红溶液。
(1)写出实现转化的化学方程式:___________ 。
(2)设计实验,证明实现了该转化(写出操作和现象):___________ 。
Ⅱ:实现硫元素在0价、+2价、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
SO2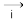 Na2SO3溶液
Na2SO3溶液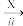 Na2S2O3溶液
Na2S2O3溶液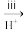 X
X
(3)ⅰ中加入的物质是___________ ,该转化说明SO2的类别是___________ 。
(4)写出ⅲ反应的离子方程式:___________ 。
Ⅰ:从下列试剂中选择合适的试剂实现S(+6价)→S(+4价)的转化。
试剂清单:①浓H2SO4;②稀H2SO4;③酸性KMnO4溶液;④Na2SO3溶液;⑤Cu;⑥品红溶液。
(1)写出实现转化的化学方程式:
(2)设计实验,证明实现了该转化(写出操作和现象):
Ⅱ:实现硫元素在0价、+2价、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
SO2
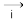 Na2SO3溶液
Na2SO3溶液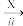 Na2S2O3溶液
Na2S2O3溶液 X
X(3)ⅰ中加入的物质是
(4)写出ⅲ反应的离子方程式:
您最近一年使用:0次
2024-05-11更新
|
89次组卷
|
2卷引用:湖北省武汉西藏中学2023-2024学年高一下学期5月期中考试化学试题
名校
解题方法
9 . 液相催化还原法可去除水体中的 ,其分步催化还原机理如图1所示。其他条件相同,不同
,其分步催化还原机理如图1所示。其他条件相同,不同 时,反应1小时后
时,反应1小时后 化率和不同产物在总还原产物中所占的物质的量的百分比如图2所示。
化率和不同产物在总还原产物中所占的物质的量的百分比如图2所示。_____________ ,还原剂是_____________ 。
(2)反应ⅰ的离子方程式是_____________________________________ 。
(3)研究表明, 在
在 表面与
表面与 竞争吸附,会降低
竞争吸附,会降低 吸附
吸附 的能力,但对
的能力,但对 吸附
吸附 的能力影响不大。
的能力影响不大。
①随 增大,
增大, 和氨态氮在还原产物中的百分比均减小,原因是
和氨态氮在还原产物中的百分比均减小,原因是_________________________ ,导致反应ⅱ的化学反应速率降低。
②随 减小,还原产物中
减小,还原产物中 的变化趋势是
的变化趋势是_____________________________ ,说明 表面吸附的
表面吸附的 和
和 的个数比变大,对反应
的个数比变大,对反应_________________________ (用离子方程式表示)更有利。
(4)分析图2,使用该催化剂,通过调节溶液 ,可将
,可将 可能多地转化为
可能多地转化为 。其具体方法是
。其具体方法是_____________ 。
 ,其分步催化还原机理如图1所示。其他条件相同,不同
,其分步催化还原机理如图1所示。其他条件相同,不同 时,反应1小时后
时,反应1小时后 化率和不同产物在总还原产物中所占的物质的量的百分比如图2所示。
化率和不同产物在总还原产物中所占的物质的量的百分比如图2所示。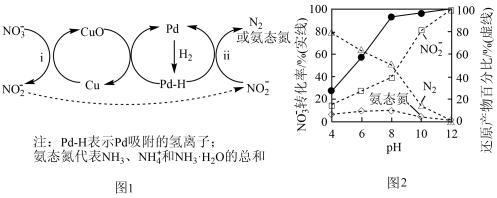
(2)反应ⅰ的离子方程式是
(3)研究表明,
 在
在 表面与
表面与 竞争吸附,会降低
竞争吸附,会降低 吸附
吸附 的能力,但对
的能力,但对 吸附
吸附 的能力影响不大。
的能力影响不大。①随
 增大,
增大, 和氨态氮在还原产物中的百分比均减小,原因是
和氨态氮在还原产物中的百分比均减小,原因是②随
 减小,还原产物中
减小,还原产物中 的变化趋势是
的变化趋势是 表面吸附的
表面吸附的 和
和 的个数比变大,对反应
的个数比变大,对反应(4)分析图2,使用该催化剂,通过调节溶液
 ,可将
,可将 可能多地转化为
可能多地转化为 。其具体方法是
。其具体方法是
您最近一年使用:0次
解题方法
10 . 硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)生产普通玻璃用到的主要原料有________________ ,生产设备是________ 。
(2) 是玻璃的主要成分之一,
是玻璃的主要成分之一, 与氢氧化钠溶液反应的化学方程式为
与氢氧化钠溶液反应的化学方程式为_______________ 。
(3)氢氟酸是HF的水溶液,可与 反应生成
反应生成 ,写出化学方程式:
,写出化学方程式:________ 。因此工艺师常用________ (填物质名称)溶液来雕刻玻璃。
(4) 的水溶液俗称水玻璃,在其中浸泡过的棉花不易燃烧,说明
的水溶液俗称水玻璃,在其中浸泡过的棉花不易燃烧,说明 可用作
可用作________ 。 可通过
可通过 与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是
与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________ (填字母)。
A.普通玻璃坩埚 B.石英坩埚 C.铁坩埚
(5)工业上常利用反应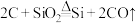 制备硅单质,该反应中氧化剂是
制备硅单质,该反应中氧化剂是________ 。能否用该反应说明碳与硅的非金属性强弱?________ (填“能”或“不能”)。
(1)生产普通玻璃用到的主要原料有
(2)
 是玻璃的主要成分之一,
是玻璃的主要成分之一, 与氢氧化钠溶液反应的化学方程式为
与氢氧化钠溶液反应的化学方程式为(3)氢氟酸是HF的水溶液,可与
 反应生成
反应生成 ,写出化学方程式:
,写出化学方程式:(4)
 的水溶液俗称水玻璃,在其中浸泡过的棉花不易燃烧,说明
的水溶液俗称水玻璃,在其中浸泡过的棉花不易燃烧,说明 可用作
可用作 可通过
可通过 与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是
与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是A.普通玻璃坩埚 B.石英坩埚 C.铁坩埚
(5)工业上常利用反应
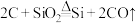 制备硅单质,该反应中氧化剂是
制备硅单质,该反应中氧化剂是
您最近一年使用:0次

 Na+、Fe2+、Ag+、Ba2+
Na+、Fe2+、Ag+、Ba2+ 、
、


