1 . 有机化合物的组成、结构、性质及转化是学习有机化学的必备知识。 与
与 混合在光照条件下发生反应生成多种氯代烃。
混合在光照条件下发生反应生成多种氯代烃。
(1)写出反应生成 的化学方程式:
的化学方程式:_______ ,其反应类型是_______ 。
(2) 与
与 反应生成
反应生成 的反应过程、中间态物质的能量关系如图所示(
的反应过程、中间态物质的能量关系如图所示( 、
、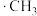 表示带有单电子的原子或原子团)。
表示带有单电子的原子或原子团)。 是由
是由 在光照下化学键断裂生成的,该过程
在光照下化学键断裂生成的,该过程_______ (填“放出”或“吸收”)能量。
②该反应过程可能会生成一种副产物烃,该烃的结构简式为_______ 。
(3)下列各组物质:属同系物的是_______ ,属同位素的是_______ ,属同分异构体的是_______ ,其中 的一氯代物有
的一氯代物有_______ 种。
 与
与 混合在光照条件下发生反应生成多种氯代烃。
混合在光照条件下发生反应生成多种氯代烃。(1)写出反应生成
 的化学方程式:
的化学方程式:(2)
 与
与 反应生成
反应生成 的反应过程、中间态物质的能量关系如图所示(
的反应过程、中间态物质的能量关系如图所示( 、
、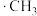 表示带有单电子的原子或原子团)。
表示带有单电子的原子或原子团)。
 是由
是由 在光照下化学键断裂生成的,该过程
在光照下化学键断裂生成的,该过程②该反应过程可能会生成一种副产物烃,该烃的结构简式为
(3)下列各组物质:属同系物的是
 的一氯代物有
的一氯代物有A. 和
和 B.16O2与18O3 C.
B.16O2与18O3 C. 与
与 D.正丁烷与异戊烷 E.
D.正丁烷与异戊烷 E. 与
与 F.
F.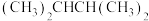 与
与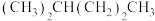
您最近一年使用:0次
名校
2 . NO-空气质子交换膜燃料电池实现了制硝酸、发电、环保一体化。某兴趣小组用该电池模拟工业处理废气和废水的过程,装置如图所示,下列说法正确的是

| A.b膜为阳离子交换膜 |
B.乙池中阴极的电极反应式为 |
C.当浓缩室得到 的盐酸时,M室溶液的质量变化为 的盐酸时,M室溶液的质量变化为 (溶液体积变化忽略不计) (溶液体积变化忽略不计) |
D.若甲池有 参加反应,则乙池中处理废气( 参加反应,则乙池中处理废气( 和 和 )的总体积为 )的总体积为 |
您最近一年使用:0次
3 . 碘是国防、工业、农业、医药等部门和行业所依赖的重要原料,海水提碘是从海藻中提取元素碘的技术。
Ⅰ.海带提碘(海带中碘元素以I-形式存在)_______ ,设计实验检验氧化后所得溶液是否含I2时,可取样于试管,滴加_______ (填试剂名称)。
(2)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为_______ ;向分离得到的含I-和 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为_______ 。
Ⅱ.获取重要的还原剂-HI
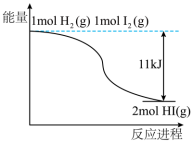
(3)H2和I2反应生成HI过程能量变化如图所示,1molH2(g)、1molHI(g)分子中化学键断裂时分别要吸收能量436kJ、299kJ,则1molI2(g)分子中化学键断裂时需吸收的能量为_______ kJ。
(4)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为 ,其工作原理如图所示:
,其工作原理如图所示:_______ ;
②放电时,转移0.6×6.02×1023个电子,负极质量减少_______ g。
Ⅰ.海带提碘(海带中碘元素以I-形式存在)
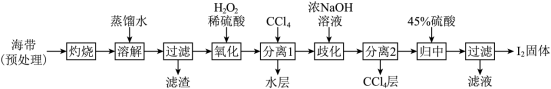
(2)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为
 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为Ⅱ.获取重要的还原剂-HI
(3)H2和I2反应生成HI过程能量变化如图所示,1molH2(g)、1molHI(g)分子中化学键断裂时分别要吸收能量436kJ、299kJ,则1molI2(g)分子中化学键断裂时需吸收的能量为
(4)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为
 ,其工作原理如图所示:
,其工作原理如图所示: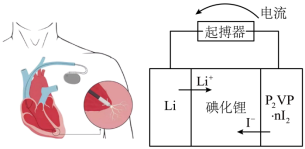
②放电时,转移0.6×6.02×1023个电子,负极质量减少
您最近一年使用:0次
名校
4 . 在等压下化学反应所吸收或放出的热量,称为化学反应的焓变。回答下列问题:
(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,则 △H=
△H=_______ kJ∙mol-1。
(2)2SO2(g)+ O2(g)⇌2SO3(g)反应过程的能量变化如图所示。
①E的大小对该反应的反应热_______ (填“有”或“无”)影响。
②SO2氧化为SO3的热化学方程式为_______ 。
(3)已知: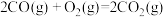 △H=-566 kJ∙mol-1 ①
△H=-566 kJ∙mol-1 ①
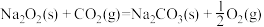 △H=-226 kJ∙mol-1②
△H=-226 kJ∙mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为_______ 。
(4)常压下,某铝热反应的温度与能量变化如图所示: △H=
△H=_______ kJ∙mol-1。
②101.3kPa、25℃时,该铝热反应的热化学方程式为_______ 。
(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,则
 △H=
△H=(2)2SO2(g)+ O2(g)⇌2SO3(g)反应过程的能量变化如图所示。
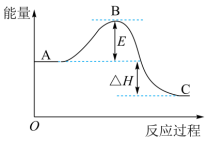
①E的大小对该反应的反应热
②SO2氧化为SO3的热化学方程式为
(3)已知:
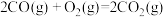 △H=-566 kJ∙mol-1 ①
△H=-566 kJ∙mol-1 ①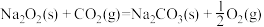 △H=-226 kJ∙mol-1②
△H=-226 kJ∙mol-1②则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为
(4)常压下,某铝热反应的温度与能量变化如图所示:
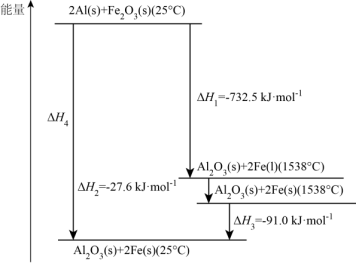
 △H=
△H=②101.3kPa、25℃时,该铝热反应的热化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 以柏林绿 为代表的新型可充电钠离子电池的放电工作原理如图所示,下列说法不正确的是
为代表的新型可充电钠离子电池的放电工作原理如图所示,下列说法不正确的是
 为代表的新型可充电钠离子电池的放电工作原理如图所示,下列说法不正确的是
为代表的新型可充电钠离子电池的放电工作原理如图所示,下列说法不正确的是
| A.充电时,Mo箔外接电源的正极 |
B.充电时,Mo箔上发生反应为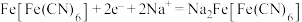 |
C.放电时, 通过交换膜从右室移向左室 通过交换膜从右室移向左室 |
| D.外电路中通过0.2mol电子时,负极区电解质质量变化为2.2g |
您最近一年使用:0次
名校
6 . 下列关于化学物质的用途或性质的叙述不正确的是
| A.单质硫易溶于CS2,实验室可用CS2清洗沾有硫单质的试管 |
B.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化 |
C.浓硫酸有强吸水性,可以干燥 |
D.标况下N2与NH3按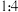 充满烧瓶,烧瓶倒置水中充分反应后,烧瓶内溶液的浓度接近 充满烧瓶,烧瓶倒置水中充分反应后,烧瓶内溶液的浓度接近 |
您最近一年使用:0次
名校
7 . 下列化学用语或说法正确的是
| A.满足通式CnH2n+2(≥1)的分子一定是烷烃 | B.C4H10表示一种纯净物 |
C.乙烷的结构简式: | D.甲烷的空间填充模型: |
您最近一年使用:0次
8 . 下列表述中不正确的是
| A.制饭勺、饭盒、高压锅等的不锈钢是合金 |
| B.水泥、玻璃、陶瓷均为传统的硅酸盐材料,三者的原料都主要为SiO2 |
| C.硅酸盐由大量的硅氧四面体基本单元构成,大多具有硬度高、难溶于水、耐高温、耐腐蚀等特点 |
| D.硅酸钠的水溶液俗称水玻璃,可用作黏合剂和防火剂 |
您最近一年使用:0次
9 . 在容积为2.0L的恒温密闭容器中,通入3mol 和一定量的
和一定量的 ,发生反应:
,发生反应: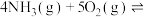
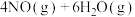 ,测得某些物质浓度随时间变化如图所示。
,测得某些物质浓度随时间变化如图所示。___________ mol,
___________  。
。
(2)下列叙述中能表明该反应达到平衡状态的是___________。
(3)欲提高生成NO的速率,理论上可以采取的措施为___________ 。
A.加入催化剂 B.降低温度 C.加入
(4)某小组为了探究影响 溶液与
溶液与 溶液在酸性条件下反应速率的因素,配制0.2
溶液在酸性条件下反应速率的因素,配制0.2
 溶液、0.1
溶液、0.1
 溶液和0.6
溶液和0.6
 溶液。将溶液按下表设计的实验方案混合(混合溶液的体积变化忽略不计):
溶液。将溶液按下表设计的实验方案混合(混合溶液的体积变化忽略不计):
①上述实验中涉及的离子方程式有:
i. 与
与 溶液的反应:
溶液的反应:___________ ;
ii.过量的 与稀硫酸:
与稀硫酸: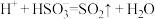 。
。
②实验中a=___________ mL、b=___________ mL。
③实验2中用 表示的反应速率
表示的反应速率
___________  。
。
 和一定量的
和一定量的 ,发生反应:
,发生反应: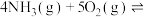
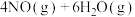 ,测得某些物质浓度随时间变化如图所示。
,测得某些物质浓度随时间变化如图所示。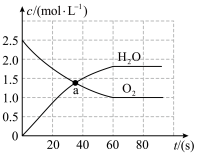

 。
。(2)下列叙述中能表明该反应达到平衡状态的是___________。
| A.容器内混合气体的密度保持不变 |
| B.断裂1molN—H同时断裂1molO—H |
| C.容器内混合气体的压强保持不变 |
D.平衡时,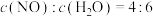 |
(3)欲提高生成NO的速率,理论上可以采取的措施为
A.加入催化剂 B.降低温度 C.加入

(4)某小组为了探究影响
 溶液与
溶液与 溶液在酸性条件下反应速率的因素,配制0.2
溶液在酸性条件下反应速率的因素,配制0.2
 溶液、0.1
溶液、0.1
 溶液和0.6
溶液和0.6
 溶液。将溶液按下表设计的实验方案混合(混合溶液的体积变化忽略不计):
溶液。将溶液按下表设计的实验方案混合(混合溶液的体积变化忽略不计):| 实验编号 | 实验温度/K | V[ (aq)]/mL (aq)]/mL | V[ (aq)]/mL (aq)]/mL | V[ (aq)]/mL (aq)]/mL | V( )/mL )/mL | 褪色时间/min |
| 1 | 298 | 4.0 | 2.0 | 2.0 | 2.0 | 7 |
| 2 | 298 | 5.0 | 2.0 | 2.0 | a | 5 |
| 3 | 303 | b | 2.0 | 2.0 | 1.0 | 2 |
i.
 与
与 溶液的反应:
溶液的反应:ii.过量的
 与稀硫酸:
与稀硫酸: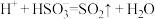 。
。②实验中a=
③实验2中用
 表示的反应速率
表示的反应速率
 。
。
您最近一年使用:0次
名校
解题方法
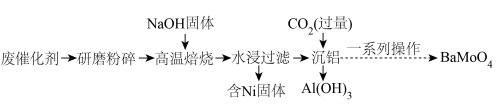
10 . 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如图: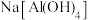 形式存在;
形式存在;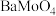 难溶于水。
难溶于水。
(1)“研磨粉碎”的目的是__________ 。
(2)“高温焙烧”中,有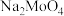 生成,其中Mo元素的化合价为
生成,其中Mo元素的化合价为__________ 。
(3)过滤需要使用的硅酸盐材质的仪器有__________ 。
(4)写出“沉铝”时反应的离子方程式:__________ 。“沉铝”后滤液中的阴离子主要为__________ 。
(5)“一系列操作”主要有两步:
①第一步是往“沉铝”后的滤液中滴加适量的 溶液。若滴加的
溶液。若滴加的 溶液过量,可能产生
溶液过量,可能产生 沉淀,写出生成
沉淀,写出生成 的离子方程式:
的离子方程式:__________ 。
②第二步是沉淀完成后,经过滤、洗涤等操作获得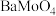 。检验
。检验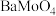 是否洗涤干净的操作为
是否洗涤干净的操作为__________ 。
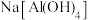 形式存在;
形式存在;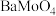 难溶于水。
难溶于水。(1)“研磨粉碎”的目的是
(2)“高温焙烧”中,有
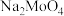 生成,其中Mo元素的化合价为
生成,其中Mo元素的化合价为(3)过滤需要使用的硅酸盐材质的仪器有
(4)写出“沉铝”时反应的离子方程式:
(5)“一系列操作”主要有两步:
①第一步是往“沉铝”后的滤液中滴加适量的
 溶液。若滴加的
溶液。若滴加的 溶液过量,可能产生
溶液过量,可能产生 沉淀,写出生成
沉淀,写出生成 的离子方程式:
的离子方程式:②第二步是沉淀完成后,经过滤、洗涤等操作获得
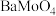 。检验
。检验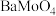 是否洗涤干净的操作为
是否洗涤干净的操作为
您最近一年使用:0次
7日内更新
|
51次组卷
|
3卷引用:江西省多所重点中学2023-2024学年高一下学期5月联合考试化学试卷



