名校
解题方法
1 . 钨在自然界的储量只有620万吨,江西独占有520万吨。江西每年产生大量的钨冶炼渣(主要含SiO2、MnO2、Al2O3、CaO、MgO、FeO、Fe2O3以及少量重金属氧化物等),以钨冶炼渣为原料,提炼制备电池级硫酸锰的工艺流程如下: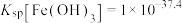 ,
,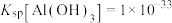 。
。
(1)“酸浸”时,为提高锰的浸出率,可采取的措施是_______ (写一种即可),滤渣1的主要成分为SiO2、_______ (填化学式)。
(2)酸浸后所得浸出液中金属阳离子包括Mn2+,写出生成Mn2+的离子方程式_______ 。
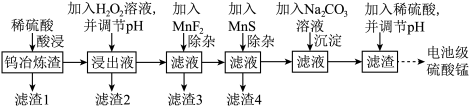
(3)若要使 和
和 沉淀完全,则需调节溶液的pH最小值为
沉淀完全,则需调节溶液的pH最小值为_______ 。
(4)滤渣3的主要成分是CaF2和_______ 。
(5)加MnS的目的是_______ 。
(6)如图为MnSO4溶解度曲线。从MnSO4溶液中提取MnSO4晶体的操作为_______ , _______ ,洗涤,干燥,碾磨,即得到了电池级硫酸锰。
 ,
,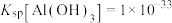 。
。(1)“酸浸”时,为提高锰的浸出率,可采取的措施是
(2)酸浸后所得浸出液中金属阳离子包括Mn2+,写出生成Mn2+的离子方程式
(3)若要使
 和
和 沉淀完全,则需调节溶液的pH最小值为
沉淀完全,则需调节溶液的pH最小值为(4)滤渣3的主要成分是CaF2和
(5)加MnS的目的是
(6)如图为MnSO4溶解度曲线。从MnSO4溶液中提取MnSO4晶体的操作为

您最近一年使用:0次
名校
解题方法
2 . 设NA为阿伏加德罗常数的值。下列说法正确的是
| A.46 g由NO2和N2O4组成的混合气体中,所含氧原子的数目为4NA |
B.1 L1 mol/L NH4NO3溶液中,所含 的总数小于NA 的总数小于NA |
| C.56 g Fe与一定量的浓硝酸恰好反应,转移的电子数一定为3NA |
| D.常温下,22.4 L氨气所含NH3的分子数为NA |
您最近一年使用:0次
名校
解题方法
3 . 中国的地热能开发和利用过程中,硫磺温泉常伴有H2S气体生成。H2S为无色、有臭鸡蛋气味的剧毒气体,H2S脱硫技术是当前的重点研究方向。
(1)20世纪30年代,德国法本公司将H2S的氧化分两阶段完成。
第一阶段反应为H2S(g)+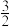 O2(g)=SO2(g)+H2O(g) ΔH=−518.9kJ·mol−1,
O2(g)=SO2(g)+H2O(g) ΔH=−518.9kJ·mol−1,
第二阶段反应为2H2S(g)+SO2(g)=2H2O(g)+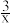 Sx(s) ΔH=−96.1kJ·mol−1。
Sx(s) ΔH=−96.1kJ·mol−1。
19世纪英国化学家Claus开发了H2S氧化制硫的方法,即:3H2S(g)+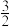 O2(g)=
O2(g)=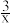 Sx(s)+3H2O(g),ΔH=
Sx(s)+3H2O(g),ΔH=_______ kJ·mol−1。
(2)氧化锌法也是一种传统的脱硫方法,其反应原理如下:ZnO(s)+H2S(g) ZnS(s)+H2O(g) ΔH=−76.63kJ·mol−1,文献显示,工业上氧化锌法控制温度在300~400℃,分析控制此温度区间的原因:温度过低
ZnS(s)+H2O(g) ΔH=−76.63kJ·mol−1,文献显示,工业上氧化锌法控制温度在300~400℃,分析控制此温度区间的原因:温度过低_______ ,温度过高_______ 。
(3)热解H2S制H2。根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(g) 2H2(g)+S2(g) ΔH1=+170kJ·mol−1
2H2(g)+S2(g) ΔH1=+170kJ·mol−1
Ⅱ.CH4(g)+S2(g) CS2(g)+2H2(g) ΔH2=+64kJ·mol−1
CS2(g)+2H2(g) ΔH2=+64kJ·mol−1
总反应:Ⅲ.2H2S(g)+CH4(g) CS2(g)+4H2(g)
CS2(g)+4H2(g)
投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释。
①反应Ⅱ能自发进行的条件是_______ (填“高温或低温”)。
②恒温恒压下,增加N2的体积分数,H2的物质的量_______ (填“增大,减小或不变”)。
③在TK、pkPa反应条件下,只充入H2S和Ar气体进行H2S热分解反应。已知反应一开始,c(H2S)∶c(Ar)=1∶3,平衡时混合气中H2S与H2的分压相等,则平衡常数Kp=_______ kPa。
(4)用CH4燃料电池连接成如图b装置。_______ 极,写出乙池总反应的离子方程式_______ 。
②当甲池中消耗标准状况下4.48LO2时,丙中a、b均为惰性电极,W为足量硝酸银溶液,停止电解后要加入_______ 克Ag2O才能复原。
(5)燃油汽车尾气中含有 和氮氧化物,氮氧化物包括
和氮氧化物,氮氧化物包括 等,研究
等,研究 还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。已知:
还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。已知: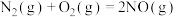
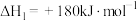 ,
, 的燃烧热为
的燃烧热为 。
。
写出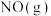 与
与 催化转化成
催化转化成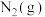 和
和 的热化学方程式
的热化学方程式_______ 。
(1)20世纪30年代,德国法本公司将H2S的氧化分两阶段完成。
第一阶段反应为H2S(g)+
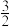 O2(g)=SO2(g)+H2O(g) ΔH=−518.9kJ·mol−1,
O2(g)=SO2(g)+H2O(g) ΔH=−518.9kJ·mol−1,第二阶段反应为2H2S(g)+SO2(g)=2H2O(g)+
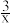 Sx(s) ΔH=−96.1kJ·mol−1。
Sx(s) ΔH=−96.1kJ·mol−1。19世纪英国化学家Claus开发了H2S氧化制硫的方法,即:3H2S(g)+
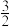 O2(g)=
O2(g)=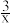 Sx(s)+3H2O(g),ΔH=
Sx(s)+3H2O(g),ΔH=(2)氧化锌法也是一种传统的脱硫方法,其反应原理如下:ZnO(s)+H2S(g)
 ZnS(s)+H2O(g) ΔH=−76.63kJ·mol−1,文献显示,工业上氧化锌法控制温度在300~400℃,分析控制此温度区间的原因:温度过低
ZnS(s)+H2O(g) ΔH=−76.63kJ·mol−1,文献显示,工业上氧化锌法控制温度在300~400℃,分析控制此温度区间的原因:温度过低(3)热解H2S制H2。根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(g)
 2H2(g)+S2(g) ΔH1=+170kJ·mol−1
2H2(g)+S2(g) ΔH1=+170kJ·mol−1Ⅱ.CH4(g)+S2(g)
 CS2(g)+2H2(g) ΔH2=+64kJ·mol−1
CS2(g)+2H2(g) ΔH2=+64kJ·mol−1总反应:Ⅲ.2H2S(g)+CH4(g)
 CS2(g)+4H2(g)
CS2(g)+4H2(g)投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释。
①反应Ⅱ能自发进行的条件是
②恒温恒压下,增加N2的体积分数,H2的物质的量
③在TK、pkPa反应条件下,只充入H2S和Ar气体进行H2S热分解反应。已知反应一开始,c(H2S)∶c(Ar)=1∶3,平衡时混合气中H2S与H2的分压相等,则平衡常数Kp=
(4)用CH4燃料电池连接成如图b装置。

②当甲池中消耗标准状况下4.48LO2时,丙中a、b均为惰性电极,W为足量硝酸银溶液,停止电解后要加入
(5)燃油汽车尾气中含有
 和氮氧化物,氮氧化物包括
和氮氧化物,氮氧化物包括 等,研究
等,研究 还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。已知:
还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。已知: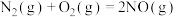
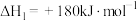 ,
, 的燃烧热为
的燃烧热为 。
。写出
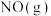 与
与 催化转化成
催化转化成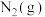 和
和 的热化学方程式
的热化学方程式
您最近一年使用:0次
4 . 按要求回答下列问题:
(1)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO +H2O
+H2O H2SO3+OH- ①
H2SO3+OH- ①
HSO
 H++SO
H++SO ②
②
向0.1 mol·L-1的NaHSO3溶液中加入少量NaOH固体,则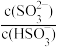
_______ (填“增大”“减小”或“不变”)。
(2)氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。
25 ℃时氯气—氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) ①
Cl2(aq) ①
Cl2(aq) + H2O HClO + H+ + Cl- ②
HClO + H+ + Cl- ②
HClO H+ + ClO- ③
H+ + ClO- ③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。_______ ,
由图可知该常数值为_______ 。
②用氯处理饮用水时,夏季的杀菌效果比冬季_______ (填“好”或“差”)。
(1)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO
 +H2O
+H2O H2SO3+OH- ①
H2SO3+OH- ①HSO

 H++SO
H++SO ②
②向0.1 mol·L-1的NaHSO3溶液中加入少量NaOH固体,则
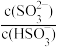
(2)氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。
25 ℃时氯气—氯水体系中存在以下平衡关系:
Cl2(g)
 Cl2(aq) ①
Cl2(aq) ①Cl2(aq) + H2O
 HClO + H+ + Cl- ②
HClO + H+ + Cl- ②HClO
 H+ + ClO- ③
H+ + ClO- ③其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
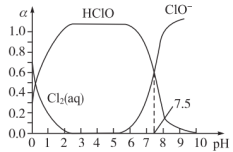
由图可知该常数值为
②用氯处理饮用水时,夏季的杀菌效果比冬季
您最近一年使用:0次
名校
解题方法
5 . 探究铁及其化合物的性质,下列实验方案、现象或结论不正确的是
| 选项 | 实验方案 | 现象 | 结论 |
| A | 2mL0.01mol·L-1FeCl3溶液滴加 浓盐酸 浓盐酸 | 溶液颜色变浅 | 氢离子抑制了Fe3+的水解 |
| B | 常温下,向 溶液中加入 溶液中加入 溶液,将带火星的木条放在试管口 溶液,将带火星的木条放在试管口 | 木条复燃 |  比 比 的氧化性强 的氧化性强 |
| C | 向氢氧化铁胶体中逐滴加入稀硫酸至过量 | 先产生沉淀后逐渐溶解 | Fe(OH)3先聚集为沉淀,后与 应 应 |
| D | 向K3Fe(CN)6溶液中加入少许铁粉,静置一段时间 | 有蓝色沉淀生成 | K3Fe(CN)6具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 下列实验结论不正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 食醋浸泡水垢 | 产生无色气体 | 乙酸的酸性比碳酸强 |
| B | 乙醇与酸性高锰酸钾溶液混合 | 紫色褪去 | 乙醇具有还原性 |
| C | 碘酒滴到土豆片上 | 土豆片变蓝 | 淀粉遇碘离子变蓝 |
| D | 新制的银氨溶液与葡萄糖溶液混合加热 | 有银镜生成 | 葡萄糖具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 江西有众多非物质文化遗产,如景德镇手工制瓷技艺、李渡烧酒酿造技艺、峡江米粉的制作技艺、婺源绿茶制作技艺。下列说法错误的是
| A.景德镇手工制得的瓷器是硅酸盐产品 |
| B.烧酒酿造过程中未发生氧化还原反应 |
| C.峡江米粉中含有天然高分子化合物 |
| D.婺源绿茶在冲泡的过程中体系的熵值增大 |
您最近一年使用:0次
名校
解题方法
8 . 用 催化还原
催化还原 可以消除氮氧化物的污染。已知:
可以消除氮氧化物的污染。已知:
①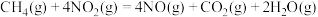

②

下列说法错误的是
 催化还原
催化还原 可以消除氮氧化物的污染。已知:
可以消除氮氧化物的污染。已知:①
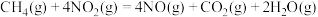

②


下列说法错误的是
| A.反应①②中,相同物质的量的甲烷发生反应,转移的电子数相同。 |
B.若用标准状况下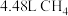 还原 还原 生成 生成 、 、 和 和 ,则放出的热量为 ,则放出的热量为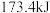 。 。 |
C.由反应①可知:  。 。 |
D.已知 的燃烧热为 的燃烧热为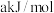 ,由 ,由 组成的混合物 组成的混合物 ,完全燃烧并恢复到常温时放出的热量为 ,完全燃烧并恢复到常温时放出的热量为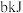 ,则 ,则 的燃烧热为 的燃烧热为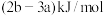 。 。 |
您最近一年使用:0次
2024-05-21更新
|
234次组卷
|
4卷引用:江西省丰城中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
9 . 科学家利用氧化锆锌作催化剂,在一定温度下将 和
和 转化为重要有机原料甲醇
转化为重要有机原料甲醇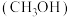 ,其原理为:
,其原理为:
 (即正反应为放热反应)。在容积为
(即正反应为放热反应)。在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和 发生上述反应。
发生上述反应。 和
和 的物质的量随时间变化如图所示。回答下列问题:
的物质的量随时间变化如图所示。回答下列问题:
_____ 。
(2)0- 内,
内, 的反应速率为
的反应速率为_______ 。
(3)下列叙述正确的是_______ (填序号)。
a. 时
时 的生成速率等于其分解速率
的生成速率等于其分解速率
b.由 保持不变,可判断该反应达到平衡状态
保持不变,可判断该反应达到平衡状态
c.当 时,该反应一定达到平衡状态
时,该反应一定达到平衡状态
d.当 的体积分数不再变化,可判断该反应达到平衡状态
的体积分数不再变化,可判断该反应达到平衡状态
(4)该温度下达到平衡时,混合气体中 的体积分数为
的体积分数为________ ,此时体系压强与开始时的压强之比为_____ 。
(5)其他条件不变时,下列措施不能使生成 的反应速率增大的是
的反应速率增大的是_______ (填序号)。
a.增大 的浓度 b.将容器的容积变为
的浓度 b.将容器的容积变为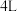
c.恒容条件下充入一定量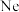 d.将恒温恒容容器改为绝热恒容容器
d.将恒温恒容容器改为绝热恒容容器
(6)已知升高温度,平衡向吸热方向移动。降低温度,此反应再次达到平衡时体系中混合气体的平均摩尔质量____ (填“增大”“减小”或“不变”)。
(7) 燃料电池的工作原理如图所示,a、b均为铂电极, A、B为燃料或氧气入口。
燃料电池的工作原理如图所示,a、b均为铂电极, A、B为燃料或氧气入口。____ 。
 和
和 转化为重要有机原料甲醇
转化为重要有机原料甲醇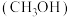 ,其原理为:
,其原理为:
 (即正反应为放热反应)。在容积为
(即正反应为放热反应)。在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和 发生上述反应。
发生上述反应。 和
和 的物质的量随时间变化如图所示。回答下列问题:
的物质的量随时间变化如图所示。回答下列问题: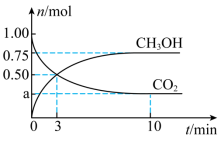

(2)0-
 内,
内, 的反应速率为
的反应速率为(3)下列叙述正确的是
a.
 时
时 的生成速率等于其分解速率
的生成速率等于其分解速率b.由
 保持不变,可判断该反应达到平衡状态
保持不变,可判断该反应达到平衡状态c.当
 时,该反应一定达到平衡状态
时,该反应一定达到平衡状态d.当
 的体积分数不再变化,可判断该反应达到平衡状态
的体积分数不再变化,可判断该反应达到平衡状态(4)该温度下达到平衡时,混合气体中
 的体积分数为
的体积分数为(5)其他条件不变时,下列措施不能使生成
 的反应速率增大的是
的反应速率增大的是a.增大
 的浓度 b.将容器的容积变为
的浓度 b.将容器的容积变为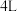
c.恒容条件下充入一定量
 d.将恒温恒容容器改为绝热恒容容器
d.将恒温恒容容器改为绝热恒容容器(6)已知升高温度,平衡向吸热方向移动。降低温度,此反应再次达到平衡时体系中混合气体的平均摩尔质量
(7)
 燃料电池的工作原理如图所示,a、b均为铂电极, A、B为燃料或氧气入口。
燃料电池的工作原理如图所示,a、b均为铂电极, A、B为燃料或氧气入口。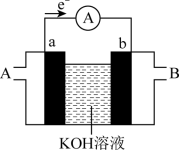
您最近一年使用:0次
10 . 根据所学知识填空
(1)正长石的主要成分为KAlSi3O8,将其表示为氧化物形式:___________ 。
(2)利用焰色反应可以定性鉴别某些金属盐。灼烧Li2SO4时,焰色为___________(填标号)。
(3)向1mol KAl(SO4)2溶液中滴加Ba(OH)2溶液至沉淀的物质的量最大时的离子方程式___________
(4)现有以下四种物质:
请根据题意选择恰当的选项用字母代号填空。
①可与KSCN溶液反应,溶液变红的是___________ ;
②常用于焙制糕点,也可用作抗酸药的是___________ ;
③可用于制备硅胶和木材防火剂的是___________ ;
④可用于制造计算机芯片的是___________ 。
(1)正长石的主要成分为KAlSi3O8,将其表示为氧化物形式:
(2)利用焰色反应可以定性鉴别某些金属盐。灼烧Li2SO4时,焰色为___________(填标号)。
| A.黄绿色 | B.洋红色 | C.紫红色 | D.绿色 |
(4)现有以下四种物质:
| A.Si | B.FeCl3 | C.NaHCO3 | D.Na2SiO3 |
①可与KSCN溶液反应,溶液变红的是
②常用于焙制糕点,也可用作抗酸药的是
③可用于制备硅胶和木材防火剂的是
④可用于制造计算机芯片的是
您最近一年使用:0次



