1 . 常温下, 、HCOOH(甲酸)、二元弱酸
、HCOOH(甲酸)、二元弱酸 的电离常数见下表,下列说法正确的是
的电离常数见下表,下列说法正确的是
 、HCOOH(甲酸)、二元弱酸
、HCOOH(甲酸)、二元弱酸 的电离常数见下表,下列说法正确的是
的电离常数见下表,下列说法正确的是| 分子式 |  | HCOOH |  |
| 电离常数 |  | 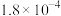 |  、 、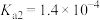 |
A.等物质的量浓度的几种溶液pH大小关系: |
B.HCOONa溶液中滴入少量 ,发生反应 ,发生反应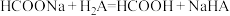 |
C.NaHA溶液中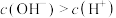 |
D. 的电离常数小于 的电离常数小于 |
您最近一年使用:0次
2 . 实验室一瓶硫酸亚铁和硫酸铁混合物,取一定量样品溶于水,配成100mL溶液。所得溶液分成二份,在第一份溶液中加入0.5mol·Lˉ1氯化钡220mL恰好完全反应;在第二份溶液中通入标准状况下的氯气0.896L,可使Fe2+全部变成Fe3+。
(1)所取样品中硫酸铁物质的量是
(2)若在第一份溶液完全反应后所得溶液中再加入足量氢氧化钠溶液,所得沉淀经洗涤,在空气中充分灼烧,最后残渣的质量是
您最近一年使用:0次
23-24高二下·全国·课前预习
3 . 某种含C、H、O三种元素的未知物A,经燃烧分析实验测得其中碳的质量分数为52.16%,氢的质量分数为13.14%。则:
(1)氧的质量分数为___________ 。
(2)C、H、O的原子个数比N(C)∶N(H)∶N(O)≈___________ 。
(3)该未知物A的实验式为___________ 。
(1)氧的质量分数为
(2)C、H、O的原子个数比N(C)∶N(H)∶N(O)≈
(3)该未知物A的实验式为
您最近一年使用:0次
名校
4 . 某有机物X(分子组成可表示为CxHyOz)是生物体的一种代谢产物,在不同的生命体中发挥不同的功能。现对X进行相关实验:
①取纯净的X固体9.0g(不含结晶水),控制在125℃~150℃缓慢加热,将其完全转化为蒸气,所得X气体所占体积为2.24L(已折算成标准状况);
②取纯净的X固体18.0g(不含结晶水),迅速加热到190℃以上,使其完全分解,得到三种气体产物;
③将分解产物依次通过足量浓硫酸和无水硫酸铜固体,浓硫酸增重3.6g,无水硫酸铜不显蓝色;
④将剩余的气体8.96L(已折算成标准状况)通过足量澄清石灰水,有白色沉淀生成,最后剩余的气体在装置末端可以被点燃;
⑤被点燃的尾气产生蓝色火焰,用干冷的烧杯罩在火焰上方没有水雾产生,用涂有澄清石灰水的烧杯罩在火焰上方有浑浊。
回答下列问题:
(1)有机物X的摩尔质量为___________ ;X分解产物的化学式为___________ 。
(2)通过计算推导出X的分子式(写出计算过程)___________ 。
(3)取0.5g含有杂质的X固体,溶于水配成25.00mL溶液,取所配溶液于锥形瓶中,加入少量硫酸酸化,用KMnO4溶液滴定至X恰好全部氧化成二氧化碳,共消耗0.002mol 的KMnO4.(MnO 转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为
转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为___________ 。
①取纯净的X固体9.0g(不含结晶水),控制在125℃~150℃缓慢加热,将其完全转化为蒸气,所得X气体所占体积为2.24L(已折算成标准状况);
②取纯净的X固体18.0g(不含结晶水),迅速加热到190℃以上,使其完全分解,得到三种气体产物;
③将分解产物依次通过足量浓硫酸和无水硫酸铜固体,浓硫酸增重3.6g,无水硫酸铜不显蓝色;
④将剩余的气体8.96L(已折算成标准状况)通过足量澄清石灰水,有白色沉淀生成,最后剩余的气体在装置末端可以被点燃;
⑤被点燃的尾气产生蓝色火焰,用干冷的烧杯罩在火焰上方没有水雾产生,用涂有澄清石灰水的烧杯罩在火焰上方有浑浊。
回答下列问题:
(1)有机物X的摩尔质量为
(2)通过计算推导出X的分子式(写出计算过程)
(3)取0.5g含有杂质的X固体,溶于水配成25.00mL溶液,取所配溶液于锥形瓶中,加入少量硫酸酸化,用KMnO4溶液滴定至X恰好全部氧化成二氧化碳,共消耗0.002mol 的KMnO4.(MnO
 转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为
转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为
您最近一年使用:0次
2024-02-24更新
|
149次组卷
|
2卷引用:浙江省宁波市北仑中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
5 . 电化学广泛应用于工业生产和环境保护上。
(1)全钒液流电池是化学储能领域的一个研究热点,储能容量大、使用寿命长。利用该电池电解处理含 的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
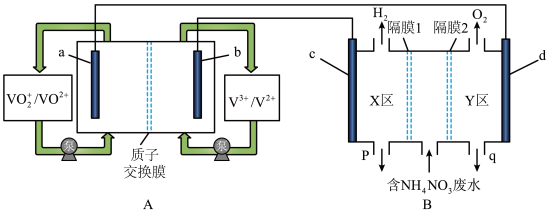
①全钒液流电池放电时,a电极反应式为___________ ,电子的流向由___________ (填“a→导线→d”或“d→导线→a”)。
②隔膜1为___________ 离子交换膜(填“阴”或“阳”),装置B中q口流出液中主要的溶质为___________ (填化学式),d电极的电极反应式为___________ 。
③当装置A中有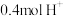 通过质子交换膜时,则装置B中产生气体的总体积为
通过质子交换膜时,则装置B中产生气体的总体积为___________ L(标准状况下),处理___________ 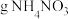 。
。
(2)用电解法可除去硝酸工业产生的尾气NO,并得到 ,工作原理如下图。
,工作原理如下图。
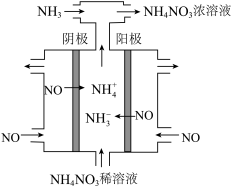
理论上通入 与NO的最佳物质的量之比为
与NO的最佳物质的量之比为___________ 。
(1)全钒液流电池是化学储能领域的一个研究热点,储能容量大、使用寿命长。利用该电池电解处理含
 的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
①全钒液流电池放电时,a电极反应式为
②隔膜1为
③当装置A中有
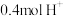 通过质子交换膜时,则装置B中产生气体的总体积为
通过质子交换膜时,则装置B中产生气体的总体积为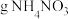 。
。(2)用电解法可除去硝酸工业产生的尾气NO,并得到
 ,工作原理如下图。
,工作原理如下图。
理论上通入
 与NO的最佳物质的量之比为
与NO的最佳物质的量之比为
您最近一年使用:0次
6 . 已知:常温下,部分弱电解质的电离平衡常数如下表所示,回答下列问题:
(1)常温下,物质的量浓度相等的下列溶液pH由大到小的顺序是_______ (填序号)。
① 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液
(2)常温下,将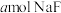 溶于水向该溶液中滴加
溶于水向该溶液中滴加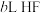 溶液后溶液呈中性,所滴加HF溶液的浓度为
溶液后溶液呈中性,所滴加HF溶液的浓度为_______  。
。
(3)下列离子方程式错误的是_______ (填序号)。
①向 溶液中加入过量
溶液中加入过量 溶液:
溶液:
②向 溶液中通入少量
溶液中通入少量 气体:
气体: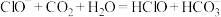
③向 溶液中通入过量
溶液中通入过量 气体:
气体: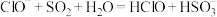
④向 溶液中加入少量
溶液中加入少量 溶液:
溶液:
(4)①下列能证明草酸为弱酸的实验是_______ (填标号)。
A.室温下,分别取等浓度 溶液和盐酸测 pH,
溶液和盐酸测 pH, 溶液 pH 大于盐酸
溶液 pH 大于盐酸
B.室温下,浓度为 c1的 溶液 pH=a,加入一定量的
溶液 pH=a,加入一定量的  溶液,测得pH>a
溶液,测得pH>a
C.室温下,取pH=a(a<3)的 溶液稀释 100 倍后,测其pH<a +2
溶液稀释 100 倍后,测其pH<a +2
D.标准状况下,取0.10mol/L的 溶液100mL 与足量锌粉反应,收集到H2体积为224mL
溶液100mL 与足量锌粉反应,收集到H2体积为224mL
②用0.02000 mol/L的NaOH溶液滴定某未知浓度的草酸,若选择甲基橙为指示剂,到达滴定终点时主要溶质的化学式为_______ 。当pH为3时,溶液中
_______ 。
 | HF |  |  |  | |
 | 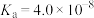 | 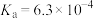 |   | 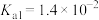  |  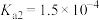 |
①
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液(2)常温下,将
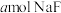 溶于水向该溶液中滴加
溶于水向该溶液中滴加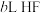 溶液后溶液呈中性,所滴加HF溶液的浓度为
溶液后溶液呈中性,所滴加HF溶液的浓度为 。
。(3)下列离子方程式错误的是
①向
 溶液中加入过量
溶液中加入过量 溶液:
溶液:
②向
 溶液中通入少量
溶液中通入少量 气体:
气体: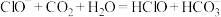
③向
 溶液中通入过量
溶液中通入过量 气体:
气体: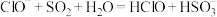
④向
 溶液中加入少量
溶液中加入少量 溶液:
溶液:
(4)①下列能证明草酸为弱酸的实验是
A.室温下,分别取等浓度
 溶液和盐酸测 pH,
溶液和盐酸测 pH, 溶液 pH 大于盐酸
溶液 pH 大于盐酸B.室温下,浓度为 c1的
 溶液 pH=a,加入一定量的
溶液 pH=a,加入一定量的  溶液,测得pH>a
溶液,测得pH>aC.室温下,取pH=a(a<3)的
 溶液稀释 100 倍后,测其pH<a +2
溶液稀释 100 倍后,测其pH<a +2D.标准状况下,取0.10mol/L的
 溶液100mL 与足量锌粉反应,收集到H2体积为224mL
溶液100mL 与足量锌粉反应,收集到H2体积为224mL②用0.02000 mol/L的NaOH溶液滴定某未知浓度的草酸,若选择甲基橙为指示剂,到达滴定终点时主要溶质的化学式为

您最近一年使用:0次
7 . 现有含HCl和 的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图:
的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图:
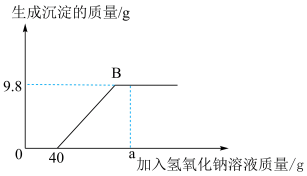
(1)当加入 溶液质量为ag时,溶液中的溶质有
溶液质量为ag时,溶液中的溶质有___________ (写出化学式);
(2)NaOH中Na元素的质量分数___________ (写出计算式);
(3)求混合溶液中 的质量分数
的质量分数___________ (写出计算过程);
(4)求恰好完全反应时,消耗NaOH溶液的总质量___________ (写出计算过程)。
 的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图:
的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图:
(1)当加入
 溶液质量为ag时,溶液中的溶质有
溶液质量为ag时,溶液中的溶质有(2)NaOH中Na元素的质量分数
(3)求混合溶液中
 的质量分数
的质量分数(4)求恰好完全反应时,消耗NaOH溶液的总质量
您最近一年使用:0次
2023-10-11更新
|
161次组卷
|
3卷引用:12-2023新东方高二上期中考化学12
12-2023新东方高二上期中考化学12北京市首都师范大学附属中学2023-2024学年高一上学期10月月考化学试题(已下线)【精品卷】3.2.2 物质的量在化学方程式计算中的应用课堂例题-人教版2023-2024学年必修第一册
解题方法
8 . 某温度(t℃)时,纯水中c(H+)=1.0×10-6.5mol∙L-1。
(1)则该温度下水的离子积常数KW=___________ ;t℃___________ (填“>”、“<”或“=”) 25℃。
(2)将此温度下pH=12的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为___________ ,溶液中由水电离出的c(H+)=___________ (忽略溶液混合时体积的变化)
(3)室温下,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合后混合液的pH=10,则所用H2SO4溶液与NaOH溶液的体积之比是___________ (忽略溶液混合时体积的变化)。
(1)则该温度下水的离子积常数KW=
(2)将此温度下pH=12的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为
(3)室温下,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合后混合液的pH=10,则所用H2SO4溶液与NaOH溶液的体积之比是
您最近一年使用:0次
解题方法
9 . 一定温度下,向容积为 的密闭容器中通入
的密闭容器中通入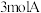 和
和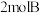 ,混合气体起始压强为
,混合气体起始压强为 。发生反应:
。发生反应: ,反应进行到
,反应进行到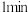 时测得剩余
时测得剩余 ,此时
,此时 的浓度为
的浓度为 。反应进行到
。反应进行到 时该容器内混合气体总压强为p,5min后反应达到平衡。
时该容器内混合气体总压强为p,5min后反应达到平衡。
(1)x为___________ 。
(2)反应在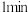 内,B的平均反应速率为
内,B的平均反应速率为___________ 。
(3)请用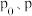 来表示
来表示 时反应物B的转化率为
时反应物B的转化率为___________ 。
(4)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是___________。
 的密闭容器中通入
的密闭容器中通入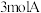 和
和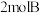 ,混合气体起始压强为
,混合气体起始压强为 。发生反应:
。发生反应: ,反应进行到
,反应进行到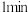 时测得剩余
时测得剩余 ,此时
,此时 的浓度为
的浓度为 。反应进行到
。反应进行到 时该容器内混合气体总压强为p,5min后反应达到平衡。
时该容器内混合气体总压强为p,5min后反应达到平衡。(1)x为
(2)反应在
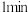 内,B的平均反应速率为
内,B的平均反应速率为(3)请用
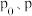 来表示
来表示 时反应物B的转化率为
时反应物B的转化率为(4)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是___________。
A. | B.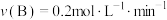 |
C. | D.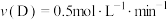 |
您最近一年使用:0次
10 . 计算填空:
(1)在 时,
时, 在
在 中完全燃烧生成
中完全燃烧生成 放出
放出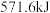 的热量,则
的热量,则 的燃烧热为
的燃烧热为____________________ 。
(2)已知: 的燃烧热为
的燃烧热为 ,
, 和
和 的混合气体
的混合气体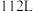 (标准状况下)完全燃烧生成
(标准状况下)完全燃烧生成 和液态水时放出的热量为
和液态水时放出的热量为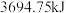 ,则混合气体中
,则混合气体中 和
和 的体积比为
的体积比为____________________ 。
(1)在
 时,
时, 在
在 中完全燃烧生成
中完全燃烧生成 放出
放出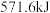 的热量,则
的热量,则 的燃烧热为
的燃烧热为(2)已知:
 的燃烧热为
的燃烧热为 ,
, 和
和 的混合气体
的混合气体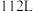 (标准状况下)完全燃烧生成
(标准状况下)完全燃烧生成 和液态水时放出的热量为
和液态水时放出的热量为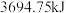 ,则混合气体中
,则混合气体中 和
和 的体积比为
的体积比为
您最近一年使用:0次



