名校
解题方法
1 . 25℃时,在等体积的①pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是___________ 。
您最近一年使用:0次
名校
解题方法
2 . 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4g铜。_______ 。硝酸所表现出的化学性质主要有_______
②待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是_______ g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用0.1mol Fe和含有0.3mol 的稀硝酸进行实验,若两种物质恰好反应都无剩余,且
的稀硝酸进行实验,若两种物质恰好反应都无剩余,且 只被还原成NO。则
只被还原成NO。则
①反应结束后的溶液中 、
、 的物质的量之比
的物质的量之比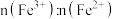 为
为_______ 。
②标准状况下,计算生成NO气体的体积_______ 。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4g铜。
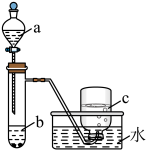
②待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用0.1mol Fe和含有0.3mol
 的稀硝酸进行实验,若两种物质恰好反应都无剩余,且
的稀硝酸进行实验,若两种物质恰好反应都无剩余,且 只被还原成NO。则
只被还原成NO。则①反应结束后的溶液中
 、
、 的物质的量之比
的物质的量之比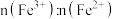 为
为②标准状况下,计算生成NO气体的体积
您最近一年使用:0次
2023-04-19更新
|
171次组卷
|
2卷引用:湖南省岳阳市岳汨联考2023-2024学年高二下学期5月月考化学试题
22-23高二上·全国·课时练习
名校
解题方法
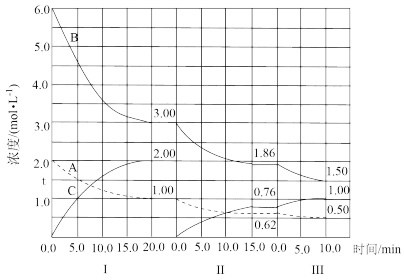
3 . 反应aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
问题:
(1)反应的化学方程式中a∶b∶c为____ 。
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为____ 。
(3)B的平衡转化率αI(B)、αII(B)、αIII(B)中最小的是____ ,其值是____ 。
(4)由第一次平衡到第二次平衡,平衡向____ 移动,采取的措施是____ 。
(5)比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低;T2____ T3(填“<”“>”“=”),判断的理由是____ 。
 cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
问题:
(1)反应的化学方程式中a∶b∶c为
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为
(3)B的平衡转化率αI(B)、αII(B)、αIII(B)中最小的是
(4)由第一次平衡到第二次平衡,平衡向
(5)比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低;T2
您最近一年使用:0次
2022-10-18更新
|
1095次组卷
|
4卷引用:2.2.3 化学反应速率和化学平衡图像——同步学习必备知识
(已下线)2.2.3 化学反应速率和化学平衡图像——同步学习必备知识内蒙古包钢第一中学2022-2023学年高二上学期月考化学试题江西省赣州市十校协作2022-2023学年高二上学期期中联考化学试题河南省郑州中学2023-2024学年高三上学期第二次月考化学试题
名校
解题方法
4 . 完成下列问题。
(1)已知完全断裂物质的量均为1mol的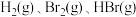 中的化学键时吸收能量分别为
中的化学键时吸收能量分别为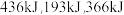 。则在该条件下,
。则在该条件下,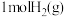 与
与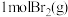 完全反应会
完全反应会_______ (填“吸收”或“放出”)_______  能量。
能量。
(2)将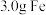 和
和 的混合粉末完全溶于
的混合粉末完全溶于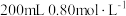 盐酸中,生成标准状况下
盐酸中,生成标准状况下 (假设气体被完全收集);反应后的溶液中滴入2滴
(假设气体被完全收集);反应后的溶液中滴入2滴 溶液后不显血红色。请通过分析计算回答:
溶液后不显血红色。请通过分析计算回答:
①则混合粉末中Fe的物质的量是_______ mol;
②若在反应后的混合液中加入锌,则理论上最多可溶解锌的质量是_______ g。
(1)已知完全断裂物质的量均为1mol的
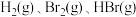 中的化学键时吸收能量分别为
中的化学键时吸收能量分别为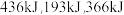 。则在该条件下,
。则在该条件下,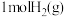 与
与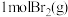 完全反应会
完全反应会 能量。
能量。(2)将
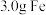 和
和 的混合粉末完全溶于
的混合粉末完全溶于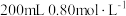 盐酸中,生成标准状况下
盐酸中,生成标准状况下 (假设气体被完全收集);反应后的溶液中滴入2滴
(假设气体被完全收集);反应后的溶液中滴入2滴 溶液后不显血红色。请通过分析计算回答:
溶液后不显血红色。请通过分析计算回答:①则混合粉末中Fe的物质的量是
②若在反应后的混合液中加入锌,则理论上最多可溶解锌的质量是
您最近一年使用:0次
解题方法
5 . 向500mL 和NaOH的混合溶液中持续通入
和NaOH的混合溶液中持续通入 。通入
。通入 的体积和溶液中沉淀的关系如图所示(气体体积均已换算为标准状况下的体积,忽略
的体积和溶液中沉淀的关系如图所示(气体体积均已换算为标准状况下的体积,忽略 与水的反应和溶液体积变化等)。请回答:
与水的反应和溶液体积变化等)。请回答:

(1)混合溶液中 的物质的量浓度为
的物质的量浓度为_______ mol/L。
(2)当通入的 总体积为2240mL时,溶液中
总体积为2240mL时,溶液中 与
与 的物质的量之比为
的物质的量之比为_______ 。
 和NaOH的混合溶液中持续通入
和NaOH的混合溶液中持续通入 。通入
。通入 的体积和溶液中沉淀的关系如图所示(气体体积均已换算为标准状况下的体积,忽略
的体积和溶液中沉淀的关系如图所示(气体体积均已换算为标准状况下的体积,忽略 与水的反应和溶液体积变化等)。请回答:
与水的反应和溶液体积变化等)。请回答:
(1)混合溶液中
 的物质的量浓度为
的物质的量浓度为(2)当通入的
 总体积为2240mL时,溶液中
总体积为2240mL时,溶液中 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
解题方法
6 . 电解金属锰阳极渣(主要成分MnO2,杂质为Pb、Fe、Cu元素的化合物)和黄铁矿(FeS2)为原料可制备Mn3O4,其流程如图所示:
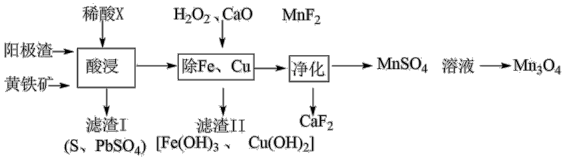
已知:Ksp(MnF2)=5.0×10−3、Ksp(CaF2)=3.5×10−11,回答下列问题:
(1)“酸浸”时,所用的稀酸X是_______ (填化学式)。
(2)“酸浸”过程中,Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图所示。
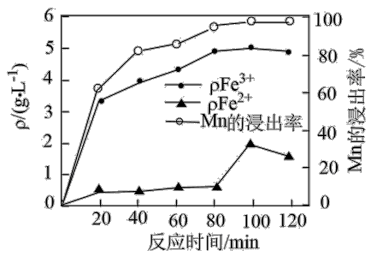
20~80 min内,浸出Mn元素的主要离子方程式为_______ 。
(3)室温下,反应MnF2(s)+Ca2+(aq) CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为
CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为_______ 。
(4)Mn3O4含量的测定:准确称取0.2400gMn3O4样品于锥形瓶中,加入25.00 mL0.2000 mol·L-1草酸钠溶液和适量硫酸,加热。待样品完全溶解后,冷却,立即用0.1000 mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液16.00 mL。测定过程中发生下列反应:Mn3O4+C2O +8H+=3Mn2++2CO2↑+4H2O;2MnO
+8H+=3Mn2++2CO2↑+4H2O;2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。
+16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。________

已知:Ksp(MnF2)=5.0×10−3、Ksp(CaF2)=3.5×10−11,回答下列问题:
(1)“酸浸”时,所用的稀酸X是
(2)“酸浸”过程中,Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图所示。

20~80 min内,浸出Mn元素的主要离子方程式为
(3)室温下,反应MnF2(s)+Ca2+(aq)
 CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为
CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为(4)Mn3O4含量的测定:准确称取0.2400gMn3O4样品于锥形瓶中,加入25.00 mL0.2000 mol·L-1草酸钠溶液和适量硫酸,加热。待样品完全溶解后,冷却,立即用0.1000 mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液16.00 mL。测定过程中发生下列反应:Mn3O4+C2O
 +8H+=3Mn2++2CO2↑+4H2O;2MnO
+8H+=3Mn2++2CO2↑+4H2O;2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。
+16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。
您最近一年使用:0次
名校
解题方法
7 . 芳香化合物在一定条件下可与卤代烃发生取代反应。某科研小组以苯、ClCCH3)3为反应物,无水AlCl3为催化剂,制备 (叔丁基苯)。反应原理如下:
(叔丁基苯)。反应原理如下:
 +ClC(CH3)3
+ClC(CH3)3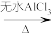
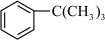 +HCl
+HCl
已知:
I.实验室模拟制备无水AlCl3的实验装置如图I所示:
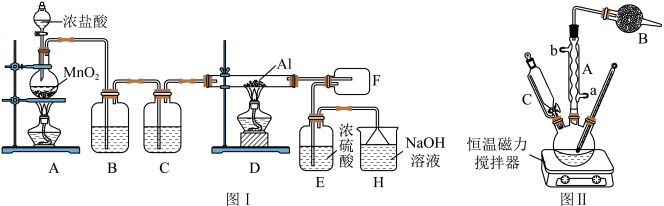
(1)写出装置A中发生反应的化学方程式:_____________ 。
(2)装置B中的试剂为_____________ ;加热顺序:应先点燃________ (填“A”或“D”)处酒精灯。
Ⅱ.实验室制取叔丁基苯的装置如图II所示:
①将35mL苯和足量的无水AlCl3加入三颈烧瓶中;
②滴加氯代叔丁烷[ClC(CH3)3]10mL;
③打开恒温磁力搅拌器反应一段时间;
④洗涤,将反应后的混合物依次用稀盐酸、Na2CO3溶液、H2O洗涤分离;
⑤在所得产物中加入少量无水MgSO4固体、静置,过滤,蒸馏;
⑥称量,得到叔丁基苯10.0g。
(1)用稀盐酸洗涤的目的是________________ ,“洗涤”后“分离”的操作名称是________ 。
(2)加无水MgSO4固体的作用是__________ ,蒸馏时为得到较为纯净的叔丁基苯,应选取蒸气温度在___________ 摄氏度左右的馏分。
(3)叔丁基苯的产率为___________ %(保留至小数点后1位)。
(4)叔丁基苯可以通过一系列反应制备对叔丁基苯甲酸和对叔丁基苯甲酸甲酯,二者均在工业上有重要用途。
①若要分离出未反应完的叔丁基苯进行回收利用(其中含有少量对叔丁基苯甲酸),可选用的实验方案为__________ 。
a.水;分液b.CCl4;蒸馏c.NaOH溶液;蒸馏d.NaOH溶液;分液
②对叔丁基苯甲酸甲酯广泛用于制化妆品、药品,请写出对叔丁基苯甲酸与甲醇反应制备对叔丁基苯甲酸甲酯的化学方程式____________________________________ 。
 (叔丁基苯)。反应原理如下:
(叔丁基苯)。反应原理如下: +ClC(CH3)3
+ClC(CH3)3
 +HCl
+HCl已知:
相对分子质量 | 密度/g·cm–3 | 沸点/℃ | 溶解性 | |
AlCl3 | 133.5 | 2.41 | 181 | 极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88 | 80.1 | 难溶于水 |
ClC(CH3)3 | 92.5 | 0.85 | 51.6 | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 | 169 | 难溶于水,易溶于苯 |

(1)写出装置A中发生反应的化学方程式:
(2)装置B中的试剂为
Ⅱ.实验室制取叔丁基苯的装置如图II所示:
①将35mL苯和足量的无水AlCl3加入三颈烧瓶中;
②滴加氯代叔丁烷[ClC(CH3)3]10mL;
③打开恒温磁力搅拌器反应一段时间;
④洗涤,将反应后的混合物依次用稀盐酸、Na2CO3溶液、H2O洗涤分离;
⑤在所得产物中加入少量无水MgSO4固体、静置,过滤,蒸馏;
⑥称量,得到叔丁基苯10.0g。
(1)用稀盐酸洗涤的目的是
(2)加无水MgSO4固体的作用是
(3)叔丁基苯的产率为
(4)叔丁基苯可以通过一系列反应制备对叔丁基苯甲酸和对叔丁基苯甲酸甲酯,二者均在工业上有重要用途。
①若要分离出未反应完的叔丁基苯进行回收利用(其中含有少量对叔丁基苯甲酸),可选用的实验方案为
a.水;分液b.CCl4;蒸馏c.NaOH溶液;蒸馏d.NaOH溶液;分液
②对叔丁基苯甲酸甲酯广泛用于制化妆品、药品,请写出对叔丁基苯甲酸与甲醇反应制备对叔丁基苯甲酸甲酯的化学方程式
您最近一年使用:0次
8 . (1)在如图反应中,反应前后钒的氧化数和配位数各是多少____ N- N键长如何变化____
(2)单晶衍射实验证实,配合物[ Cr3O( CH3CO2)6(H2O)3]Cl·8H2O中,3个铬原子的化学环境完全相同,乙酸根为桥连配体,水分子为单齿配体。画出该配合物中阳离子的结构示意图_____ 。

(2)单晶衍射实验证实,配合物[ Cr3O( CH3CO2)6(H2O)3]Cl·8H2O中,3个铬原子的化学环境完全相同,乙酸根为桥连配体,水分子为单齿配体。画出该配合物中阳离子的结构示意图
您最近一年使用:0次
9 . 大气污染物中的氮氧化物可用NaOH吸收,发生如下反应:
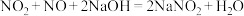

请计算:
(1)若33.6mL(标况下)氮氧化物(只含NO和 )与
)与 恰好完全反应,则
恰好完全反应,则
_______ 。
(2)若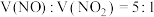 与
与 混合,能与
混合,能与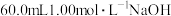 溶液恰好完全反应全部转变成
溶液恰好完全反应全部转变成 ,则
,则
_______ (写出计算过程)
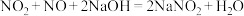

请计算:
(1)若33.6mL(标况下)氮氧化物(只含NO和
 )与
)与 恰好完全反应,则
恰好完全反应,则
(2)若
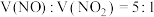 与
与 混合,能与
混合,能与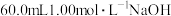 溶液恰好完全反应全部转变成
溶液恰好完全反应全部转变成 ,则
,则
您最近一年使用:0次
2021-04-11更新
|
669次组卷
|
3卷引用:浙江省宁波市慈溪市2020-2021学年高二下学期期末测试化学试题
浙江省宁波市慈溪市2020-2021学年高二下学期期末测试化学试题浙江省绍兴市2021届高三4月适应性考试(二模)化学试题(已下线)第03讲 物质的量在化学方程式计算中的应用(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
10 . 研究处理NOx、SO2对环境保护有着重要的意义。回答下列问题:
(1)二氧化硫在一定条件下可以发生如下反应:SO2(g)+NO2(g)⇌SO3(g)+NO(g)△H=-42kJ•mol-1。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各组实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。部分实验结果如图所示:
进行多组实验(各组实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。部分实验结果如图所示: __ 。
②若A点对应实验中,SO2(g)的起始浓度为c0mol•L-1,经过tmin达到平衡状态,则该时段化学反应速率v(NO2)=__ mol•L-1•min-1。
③图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC__ TD(填或“<”“=”或“<”)。
(2)2NO(g)+O2(g) 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应Ⅰ:2NO(g) N2O2(g)(快) △H1<0 v1正=k1正c2(NO),v1逆=k1逆c(N2O2);
N2O2(g)(快) △H1<0 v1正=k1正c2(NO),v1逆=k1逆c(N2O2);
反应Ⅱ:N2O2(g)+O2(g) 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2)。
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2)。
一定条件下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,平衡常数K=
2NO2(g)达到平衡状态,平衡常数K=___ (用含k1正、k1逆、k2正、k2逆的代数式表示)。反应Ⅰ的活化能EⅠ__ (填“>”“<”或“=”)反应Ⅱ的活化能EⅡ。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数__ k2逆增大的倍数(填“>”“<”或“=”)。
(3)用测压法在刚性密闭容器中研究T℃时4NO(g) N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如表所示:
N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如表所示:
①20min时,NO的转化率α=__ 。
②T℃时,4NO(g) N2(g)+2NO2(g)反应的平衡常数Kp=
N2(g)+2NO2(g)反应的平衡常数Kp=__ (Kp为以分压表示的平衡常数)。
(1)二氧化硫在一定条件下可以发生如下反应:SO2(g)+NO2(g)⇌SO3(g)+NO(g)△H=-42kJ•mol-1。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
 进行多组实验(各组实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。部分实验结果如图所示:
进行多组实验(各组实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。部分实验结果如图所示: 
②若A点对应实验中,SO2(g)的起始浓度为c0mol•L-1,经过tmin达到平衡状态,则该时段化学反应速率v(NO2)=
③图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC
(2)2NO(g)+O2(g)
 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:反应Ⅰ:2NO(g)
 N2O2(g)(快) △H1<0 v1正=k1正c2(NO),v1逆=k1逆c(N2O2);
N2O2(g)(快) △H1<0 v1正=k1正c2(NO),v1逆=k1逆c(N2O2);反应Ⅱ:N2O2(g)+O2(g)
 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2)。
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2)。一定条件下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,平衡常数K=
2NO2(g)达到平衡状态,平衡常数K=②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数
(3)用测压法在刚性密闭容器中研究T℃时4NO(g)
 N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如表所示:
N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如表所示:| 反应时间/min | 0 | 10 | 20 | 30 | 40 |
| 压强/MPa | 15.00 | 14.02 | 13.20 | 12.50 | 12.50 |
②T℃时,4NO(g)
 N2(g)+2NO2(g)反应的平衡常数Kp=
N2(g)+2NO2(g)反应的平衡常数Kp=
您最近一年使用:0次
2021-02-06更新
|
124次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高二下学期6月期末考试化学试题



