解题方法
1 . 某些化学键的键能(kJ·mol-1)如下表:
(1)1 mol H2在2 mol Cl2中燃烧,生成2 mol HCl放出的热量为_______ kJ。
(2)在一定条件下,1 mol H2分别与足量的Cl2、Br2、I2完全反应,放出热量由多到少的顺序是_______ 。
| 键 | H—H | Br—Br | I—I | Cl—Cl | H—Cl | H—I | H—Br |
| 键能 | 436 | 193 | 151 | 247 | 431 | 299 | 366 |
(2)在一定条件下,1 mol H2分别与足量的Cl2、Br2、I2完全反应,放出热量由多到少的顺序是
您最近一年使用:0次
解题方法
2 . 以甲烷为原料制取氢气是工业上常用的制氢方法。已知有关化学反应的能量变化如图所示:
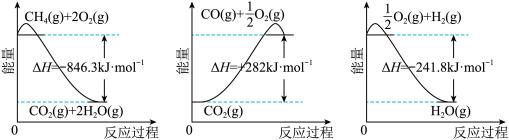
(1)下列说法正确的是___________(填字母)。
(2)CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________ 。

(1)下列说法正确的是___________(填字母)。
| A.CH4的摩尔燃烧焓为846.3 kJ·mol-1 |
| B.CO的摩尔燃烧焓为282 kJ·mol-1 |
| C.H2的摩尔燃烧焓为241.8 kJ·mol-1 |
| D.CO(g)+H2O(g)=CO2(g)+H2(g)为放热反应 |
您最近一年使用:0次
3 . 二甲醚(CH3OCH3)重整制取氢气,具有无毒性、无刺激性等优点,发生反应:CH3OCH3(g)=CO(g)+H2(g)+CH4(g) ΔH。已知部分化学键的键能如下表所示:
计算该反应的ΔH值。_________
| 化学键 | C-H | C-O | H-H | C≡O(CO) |
| 键能/(kJ·mol-1) | 413 | 356 | 436 | 1 075 |
您最近一年使用:0次
4 . 已知丙烷的摩尔燃烧焓ΔH=-2215kJ·mol-1。试计算丙烷完全燃烧生成1.8g水时放出的热量。_____
您最近一年使用:0次
5 . 已知1 g丁烷(C4H10)完全燃烧生成二氧化碳和液态水时,放出50 kJ的热量。
(1)请写出丁烷燃烧的热化学方程式_______ 。
(2)计算10 kg丁烷完全燃烧生成二氧化碳和液态水时放出的热量_______ 。
(1)请写出丁烷燃烧的热化学方程式
(2)计算10 kg丁烷完全燃烧生成二氧化碳和液态水时放出的热量
您最近一年使用:0次
解题方法
6 . 25 ℃、101kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g),放出853 kJ热量。
(1)请写出FeS2(s)燃烧的热化学方程式________ 。
(2)计算理论上180 g FeS2(s)完全燃烧放出的热量________ 。
(1)请写出FeS2(s)燃烧的热化学方程式
(2)计算理论上180 g FeS2(s)完全燃烧放出的热量
您最近一年使用:0次
解题方法
7 . 无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)⇌2NO2(g) ΔH=+24.4 kJ·mol-1。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为_______ (以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=_______ kPa·s-1。
您最近一年使用:0次
解题方法
8 . 已知2N2O5(g)=2N2O4(g)+O2(g),起始时N2O5(g)为35.8 kPa,分解的反应速率v=2×10-3×pN2O5(kPa·min-1)。t=62 min时,测得体系中pO2=2.9 kPa,则此时的pN2O5=_______ kPa,v=_______ kPa·min-1。
您最近一年使用:0次
9 . 将两支惰性电极插入CuSO4溶液中,通电电解。
(1)当有1.0×10-3mol的OH-放电时,溶液显浅蓝色,则在阴极上析出铜的质量是_____ 。
(2)若溶液的体积为1L,忽略溶液体积变化,在标准状况下放出5.6mLO2时,溶液的pH是_____ 。
(1)当有1.0×10-3mol的OH-放电时,溶液显浅蓝色,则在阴极上析出铜的质量是
(2)若溶液的体积为1L,忽略溶液体积变化,在标准状况下放出5.6mLO2时,溶液的pH是
您最近一年使用:0次
解题方法
10 . 已知甲烷隔绝空气在不同温度下有可能发生如下两个反应:①CH4(g)=C(s)+2H2(g),②2CH4(g)=C2H2(g)+3H2(g)。某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,在图书馆查到了如下热力学数据:
①的ΔH(298 K)=74.848 kJ·mol-1,ΔS(298 K)=80.674 J·mol-1·K-1
②的ΔH(298 K)=376.426 kJ·mol-1,ΔS(298 K)=220.211 J·mol-1·K-1
已知焓变和熵变随温度变化很小。请帮助这位同学考虑如下问题:
(1)判断②反应是高温自发还是低温自发:___________ (填“高温”或“低温”)。
(2)通过计算判断①反应在常温下能否自发进行:___________ 。
(3)求算制取炭黑的允许温度范围:___________ 。
(4)为了提高甲烷的碳化程度,你认为下面四个温度中最合适的是___________(填字母)。
①的ΔH(298 K)=74.848 kJ·mol-1,ΔS(298 K)=80.674 J·mol-1·K-1
②的ΔH(298 K)=376.426 kJ·mol-1,ΔS(298 K)=220.211 J·mol-1·K-1
已知焓变和熵变随温度变化很小。请帮助这位同学考虑如下问题:
(1)判断②反应是高温自发还是低温自发:
(2)通过计算判断①反应在常温下能否自发进行:
(3)求算制取炭黑的允许温度范围:
(4)为了提高甲烷的碳化程度,你认为下面四个温度中最合适的是___________(填字母)。
| A.905.2 K | B.927 K |
| C.1 273 K | D.2 000 K |
您最近一年使用:0次



