1 . 顺1,2二甲基环丙烷和反1,2二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。已知:t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,该温度下反应的平衡常数值K=_______ 。

该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。已知:t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,该温度下反应的平衡常数值K=
您最近一年使用:0次
2 . 常温下 的某一元强碱
的某一元强碱 溶液与
溶液与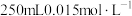 的硫酸溶液相混合,假设混合后液体体积为
的硫酸溶液相混合,假设混合后液体体积为 ,试求:
,试求:
(1)混合液的
___________ 。
(2)若原 一元强碱中含溶质
一元强碱中含溶质 ,则
,则 的相对原子质量为
的相对原子质量为___________ 。
(3)若给混合液中分别滴入几滴甲基橙试液,则溶液的颜色是___________ 。
 的某一元强碱
的某一元强碱 溶液与
溶液与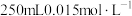 的硫酸溶液相混合,假设混合后液体体积为
的硫酸溶液相混合,假设混合后液体体积为 ,试求:
,试求:(1)混合液的

(2)若原
 一元强碱中含溶质
一元强碱中含溶质 ,则
,则 的相对原子质量为
的相对原子质量为(3)若给混合液中分别滴入几滴甲基橙试液,则溶液的颜色是
您最近一年使用:0次
3 . 化学反应原理对化学反应的研究具有指导意义。
(1)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
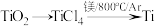
已知:①C(s)+O2(g)=CO2(g);ΔH=-3935kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);ΔH=+141kJ·mol-1则
(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______ 。
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2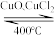 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ.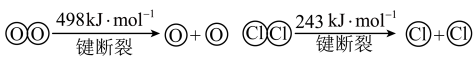
(2)写出该条件下,反应A的热化学方程式为_______ 。
(3)断开1molH-O键与断开1molH-Cl键所需能量相差约为_______ kJ。
(3)利用CO2与CH4制备合成气(CO、H2),可能的反应历程如图所示:
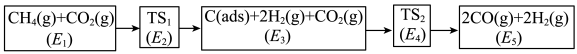
说明:C(ads)为吸附性活性炭,E表示方框中物质总能量(单位:kJ/mol),TS表示过渡态。
(4)制备合成气总反应的 可表示为
可表示为_______ kJ·mol-1。
(5)若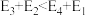 ,则决定速率步骤的化学方程式为
,则决定速率步骤的化学方程式为_______ 。
(1)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
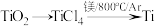
已知:①C(s)+O2(g)=CO2(g);ΔH=-3935kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);ΔH=+141kJ·mol-1则
(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2
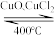 2Cl2+2H2O
2Cl2+2H2O已知:ⅰ.此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ.
(2)写出该条件下,反应A的热化学方程式为
(3)断开1molH-O键与断开1molH-Cl键所需能量相差约为
(3)利用CO2与CH4制备合成气(CO、H2),可能的反应历程如图所示:
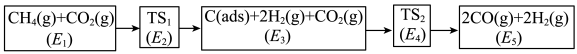
说明:C(ads)为吸附性活性炭,E表示方框中物质总能量(单位:kJ/mol),TS表示过渡态。
(4)制备合成气总反应的
 可表示为
可表示为(5)若
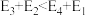 ,则决定速率步骤的化学方程式为
,则决定速率步骤的化学方程式为
您最近一年使用:0次
解题方法
4 . 某些化学键的键能(kJ·mol-1)如下表:
(1)1 mol H2在2 mol Cl2中燃烧,生成2 mol HCl放出的热量为_______ kJ。
(2)在一定条件下,1 mol H2分别与足量的Cl2、Br2、I2完全反应,放出热量由多到少的顺序是_______ 。
| 键 | H—H | Br—Br | I—I | Cl—Cl | H—Cl | H—I | H—Br |
| 键能 | 436 | 193 | 151 | 247 | 431 | 299 | 366 |
(2)在一定条件下,1 mol H2分别与足量的Cl2、Br2、I2完全反应,放出热量由多到少的顺序是
您最近一年使用:0次
5 . 以甲烷为原料制取氢气是工业上常用的制氢方法。已知有关化学反应的能量变化如图所示:
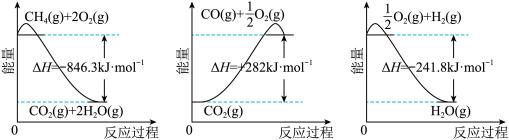
(1)下列说法正确的是___________(填字母)。
(2)CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________ 。

(1)下列说法正确的是___________(填字母)。
| A.CH4的摩尔燃烧焓为846.3 kJ·mol-1 |
| B.CO的摩尔燃烧焓为282 kJ·mol-1 |
| C.H2的摩尔燃烧焓为241.8 kJ·mol-1 |
| D.CO(g)+H2O(g)=CO2(g)+H2(g)为放热反应 |
您最近一年使用:0次
6 . 二甲醚(CH3OCH3)重整制取氢气,具有无毒性、无刺激性等优点,发生反应:CH3OCH3(g)=CO(g)+H2(g)+CH4(g) ΔH。已知部分化学键的键能如下表所示:
计算该反应的ΔH值。_________
| 化学键 | C-H | C-O | H-H | C≡O(CO) |
| 键能/(kJ·mol-1) | 413 | 356 | 436 | 1 075 |
您最近一年使用:0次
7 . 已知丙烷的摩尔燃烧焓ΔH=-2215kJ·mol-1。试计算丙烷完全燃烧生成1.8g水时放出的热量。_____
您最近一年使用:0次
8 . 已知1 g丁烷(C4H10)完全燃烧生成二氧化碳和液态水时,放出50 kJ的热量。
(1)请写出丁烷燃烧的热化学方程式_______ 。
(2)计算10 kg丁烷完全燃烧生成二氧化碳和液态水时放出的热量_______ 。
(1)请写出丁烷燃烧的热化学方程式
(2)计算10 kg丁烷完全燃烧生成二氧化碳和液态水时放出的热量
您最近一年使用:0次
解题方法
9 . 25 ℃、101kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g),放出853 kJ热量。
(1)请写出FeS2(s)燃烧的热化学方程式________ 。
(2)计算理论上180 g FeS2(s)完全燃烧放出的热量________ 。
(1)请写出FeS2(s)燃烧的热化学方程式
(2)计算理论上180 g FeS2(s)完全燃烧放出的热量
您最近一年使用:0次
10 . 无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)⇌2NO2(g) ΔH=+24.4 kJ·mol-1。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为_______ (以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=_______ kPa·s-1。
您最近一年使用:0次



