1 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,应用广泛。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是_____ (填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO−、OH−、FeO42-、Cl−、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:________________________________ 。
②每生成1molFeO42-转移________ mol电子;若反应过程中转移了0.3mol电子,则还原产物的物质的量为________ mol。
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I−===2Fe2++I2,2Fe2++Br2===2Fe3++2Br−,2Fe2++Cl2===2Fe3++2Cl−
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是________ 。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br−被氧化一半时,c为_______________ (用含a、b的代数式表示)。
(3)已知:S2O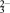 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________ 。
(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。
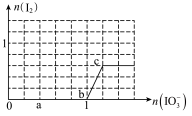
写出a点处还原产物是_______________ ;b点到c点反应的离子方程式________________
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO−、OH−、FeO42-、Cl−、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:
②每生成1molFeO42-转移
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I−===2Fe2++I2,2Fe2++Br2===2Fe3++2Br−,2Fe2++Cl2===2Fe3++2Cl−
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br−被氧化一半时,c为
(3)已知:S2O
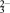 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。

写出a点处还原产物是
您最近一年使用:0次
2019-03-27更新
|
315次组卷
|
2卷引用:沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2
2 . 近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐极值为0.01mg/L。已知在酸性条件下有以下反应:
①2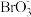 +I2===2
+I2===2 +Br2
+Br2
②2 +10Br-+12H+===I2+5Br2+6H2O
+10Br-+12H+===I2+5Br2+6H2O
③5Br-+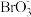 +6H+===3Br2+3H2O
+6H+===3Br2+3H2O
请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由是:_________ 。
(2)反应②中: →l2发生的是
→l2发生的是__________ 反应(氧化、还原)。
现向含6mol的KI的硫酸溶液中逐滴滴加KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图的关系:
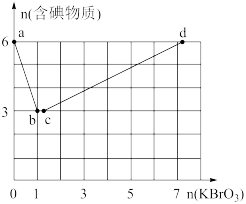
(3)完成a→b阶段的反应方程式,并标出电子转移的方向和数目:I-+BrO3-+H+→ ,________ 。
(4)b→c阶段只有一种元素化合价发生了改变,反应中氧化产物和还原产物的物质的量之比为______ 。
(5)a→b、b→c、c→d阶段的还原剂分别是______ 、_______ 、______ ,依次发生的这些反应,说明有关物质(l2、Br2、I-、Br-)还原性由强到弱的顺序是________ 。
①2
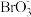 +I2===2
+I2===2 +Br2
+Br2②2
 +10Br-+12H+===I2+5Br2+6H2O
+10Br-+12H+===I2+5Br2+6H2O③5Br-+
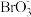 +6H+===3Br2+3H2O
+6H+===3Br2+3H2O请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由是:
(2)反应②中:
 →l2发生的是
→l2发生的是现向含6mol的KI的硫酸溶液中逐滴滴加KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图的关系:

(3)完成a→b阶段的反应方程式,并标出电子转移的方向和数目:I-+BrO3-+H+→ ,
(4)b→c阶段只有一种元素化合价发生了改变,反应中氧化产物和还原产物的物质的量之比为
(5)a→b、b→c、c→d阶段的还原剂分别是
您最近一年使用:0次
19-20高三·浙江·阶段练习
3 . 工业次氯酸钠溶液中含有氯酸钠,测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原为氯化钠(ClO 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性)。加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol/L硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol/L酸性K2Cr2O7溶液滴定至终点,消耗该溶液20.00 mL。已知:
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性)。加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol/L硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol/L酸性K2Cr2O7溶液滴定至终点,消耗该溶液20.00 mL。已知: +6Fe2++6H+=Cl-+6Fe3++3H2O;
+6Fe2++6H+=Cl-+6Fe3++3H2O; +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)与K2Cr2O7反应的硫酸亚铁的物质的量为_______ mol。
(2)计算样品中NaClO3的含量为_______ g/L,写出计算过程。
 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性)。加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol/L硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol/L酸性K2Cr2O7溶液滴定至终点,消耗该溶液20.00 mL。已知:
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性)。加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol/L硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol/L酸性K2Cr2O7溶液滴定至终点,消耗该溶液20.00 mL。已知: +6Fe2++6H+=Cl-+6Fe3++3H2O;
+6Fe2++6H+=Cl-+6Fe3++3H2O; +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O(1)与K2Cr2O7反应的硫酸亚铁的物质的量为
(2)计算样品中NaClO3的含量为
您最近一年使用:0次
名校
4 . 肼是一种强还原剂,用NaClO与NH3反应可用于生产肼(N2H4),其反应的化学方程式为:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生产1000 g质量分数为25.6%的肼溶液最少需要___________ L(标准状况)NH3。
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原( 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00 mL。
被还原为Cr3+),消耗该溶液20.00 mL。
①用H2O2与次氯酸钠反应的离子方程式为___________ 。
②实验中加热煮沸的目的是___________ 。
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。___________
⑴生产1000 g质量分数为25.6%的肼溶液最少需要
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(
 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00 mL。
被还原为Cr3+),消耗该溶液20.00 mL。①用H2O2与次氯酸钠反应的离子方程式为
②实验中加热煮沸的目的是
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。
您最近一年使用:0次
2017-04-16更新
|
634次组卷
|
4卷引用:江苏省淮阴中学2019-2020学年高二下学期期末考试化学试题
解题方法
5 . 次氯酸 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备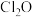 的反应原理为
的反应原理为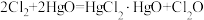 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
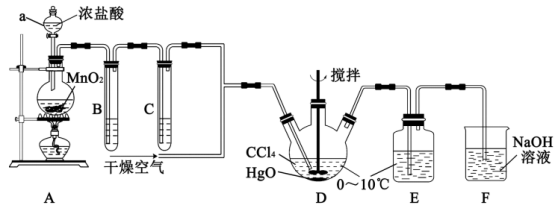
已知:①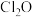 气体
气体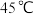 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;
②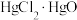 是难溶于水的固体。
是难溶于水的固体。
(1)仪器a的名称是___________ 。写出装置A中反应的离子方程式___________ 。
(2)装置B的作用是___________ ,装置C中盛装的试剂是___________ 。
(3)D中通入 与
与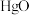 反应制得
反应制得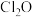 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为___________ 。
(4)有效含氯量常用来衡量消毒剂的消毒能力,用 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
①称取含氯消毒片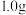 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用___________ 加蒸馏水至刻度线;
②配置 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入___________ 色试剂瓶中,置于暗处放置7~14天后,用酸性 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;
③用滴定管量取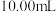 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入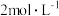 的硫酸
的硫酸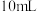 ,10%碘化钾溶液
,10%碘化钾溶液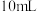 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至___________ 即为终点。记录消耗的 溶液的体积;
溶液的体积;
④重复上述操作三次。四次测定的数据如下表:
根据 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知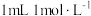 的硫代硫酸钠相当于
的硫代硫酸钠相当于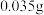 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为___________ %。
 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备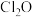 的反应原理为
的反应原理为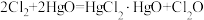 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
已知:①
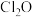 气体
气体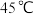 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;②
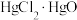 是难溶于水的固体。
是难溶于水的固体。(1)仪器a的名称是
(2)装置B的作用是
(3)D中通入
 与
与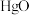 反应制得
反应制得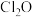 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为(4)有效含氯量常用来衡量消毒剂的消毒能力,用
 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:①称取含氯消毒片
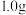 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用②配置
 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;③用滴定管量取
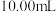 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入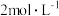 的硫酸
的硫酸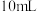 ,10%碘化钾溶液
,10%碘化钾溶液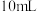 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至 溶液的体积;
溶液的体积;④重复上述操作三次。四次测定的数据如下表:
| 实验序号 | 1 | 2 | 3 | 4 |
消耗 溶液的体积/ 溶液的体积/ | 20.05 | 20.00 | 19.95 | 20.45 |
 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知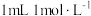 的硫代硫酸钠相当于
的硫代硫酸钠相当于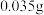 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为
您最近一年使用:0次
名校
解题方法
6 .  是一种棕黑色粉末,难溶于水,可用作强氧化剂和电极制造等。实验室由
是一种棕黑色粉末,难溶于水,可用作强氧化剂和电极制造等。实验室由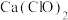 溶液氧化碱性
溶液氧化碱性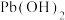 法制备
法制备 的步骤如下:
的步骤如下:

反应原理: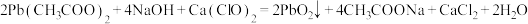 为测定产品(只含
为测定产品(只含 和PbO)中
和PbO)中 、PbO的物质的量之比,称取产品0.5194g,加入20.00mL 0.2500
、PbO的物质的量之比,称取产品0.5194g,加入20.00mL 0.2500
 溶液(
溶液( 还原为
还原为 ,
, 被氧化为
被氧化为 )搅拌使其充分反应,然后用氨水中和,过滤、洗涤除去
)搅拌使其充分反应,然后用氨水中和,过滤、洗涤除去 ,滤液酸化后用0.0400
,滤液酸化后用0.0400
 标准溶液滴定至终点(
标准溶液滴定至终点( 还原为
还原为 ,
, 被氧化为
被氧化为 ),消耗标准溶液10.00mL。计算产品中
),消耗标准溶液10.00mL。计算产品中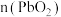 与
与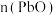 物质的量之比
物质的量之比______ (写出计算过程)。
 是一种棕黑色粉末,难溶于水,可用作强氧化剂和电极制造等。实验室由
是一种棕黑色粉末,难溶于水,可用作强氧化剂和电极制造等。实验室由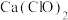 溶液氧化碱性
溶液氧化碱性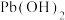 法制备
法制备 的步骤如下:
的步骤如下:
反应原理:
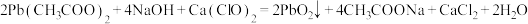 为测定产品(只含
为测定产品(只含 和PbO)中
和PbO)中 、PbO的物质的量之比,称取产品0.5194g,加入20.00mL 0.2500
、PbO的物质的量之比,称取产品0.5194g,加入20.00mL 0.2500
 溶液(
溶液( 还原为
还原为 ,
, 被氧化为
被氧化为 )搅拌使其充分反应,然后用氨水中和,过滤、洗涤除去
)搅拌使其充分反应,然后用氨水中和,过滤、洗涤除去 ,滤液酸化后用0.0400
,滤液酸化后用0.0400
 标准溶液滴定至终点(
标准溶液滴定至终点( 还原为
还原为 ,
, 被氧化为
被氧化为 ),消耗标准溶液10.00mL。计算产品中
),消耗标准溶液10.00mL。计算产品中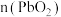 与
与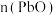 物质的量之比
物质的量之比
您最近一年使用:0次
名校
解题方法
7 . 依据水溶液中的平衡相关原理,回答下列问题:
(1)已知某温度下,Kw=1×10-13,在该温度下0.1 mol∙L-1HA溶液的pH=3
①该溶液中由水电离出的H+浓度是___________ mol∙L-1。
②计算此温度下HA的电离平衡常数Ka约为___________ 。
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
以下说法正确的是___________。(填选项)
(3)已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液aL与pH=2的H2SO4的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=___________ 。
(4)Na2CO3俗称纯碱,是因为其水溶液呈碱性,用离子方程式表示纯碱溶液呈碱性的主要原因是___________ 。在纯碱溶液中下列关系成立的是___________
A.c(H+)+c(Na+)=c( )+c(
)+c( )+c(OH-)
)+c(OH-)
B.c( )>c(
)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.c(OH-)-c(H+)= c( )+2c(H2CO3)
)+2c(H2CO3)
D.c(Na+)=c( )+c(
)+c( )+c(H2CO3)
)+c(H2CO3)
(1)已知某温度下,Kw=1×10-13,在该温度下0.1 mol∙L-1HA溶液的pH=3
①该溶液中由水电离出的H+浓度是
②计算此温度下HA的电离平衡常数Ka约为
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.75×10-5 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=4.0×10-8 |
以下说法正确的是___________。(填选项)
| A.向弱酸溶液中加入少量NaOH溶液,电离平衡常数变大 |
| B.25℃时NaClO的水解平衡常数约为2.5×10-7 |
| C.表中三种酸,酸性最强的是CH3COOH |
D.向NaClO溶液中通入少量CO2气体,可以发生反应:2ClO-+H2O+CO2==2HClO+ |
(4)Na2CO3俗称纯碱,是因为其水溶液呈碱性,用离子方程式表示纯碱溶液呈碱性的主要原因是
A.c(H+)+c(Na+)=c(
 )+c(
)+c( )+c(OH-)
)+c(OH-) B.c(
 )>c(
)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)C.c(OH-)-c(H+)= c(
 )+2c(H2CO3)
)+2c(H2CO3)D.c(Na+)=c(
 )+c(
)+c( )+c(H2CO3)
)+c(H2CO3)
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
8 . 一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1)氯铂酸钡(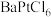 )固体加热时部分分解为
)固体加热时部分分解为 、
、 和
和 ,376.8℃时平衡常数
,376.8℃时平衡常数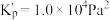 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量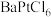 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为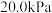 。376.8℃平衡时,测得烧瓶中压强为
。376.8℃平衡时,测得烧瓶中压强为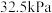 ,则
,则
_______  ,反应
,反应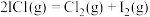 的平衡常数K=
的平衡常数K=_______ (列出计算式即可)。
(2)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数 。
。
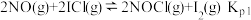

得到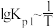 和
和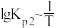 均为线性关系,如下图所示:
均为线性关系,如下图所示:
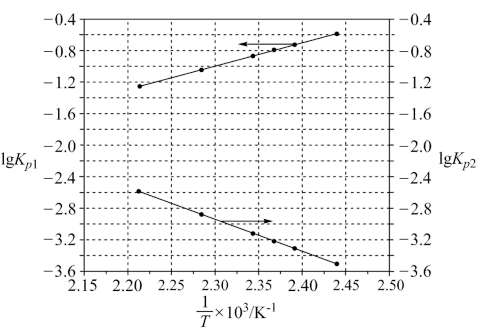
反应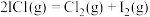 的K=
的K=_______ (用 、
、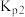 表示)。
表示)。
(1)氯铂酸钡(
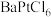 )固体加热时部分分解为
)固体加热时部分分解为 、
、 和
和 ,376.8℃时平衡常数
,376.8℃时平衡常数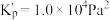 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量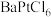 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为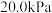 。376.8℃平衡时,测得烧瓶中压强为
。376.8℃平衡时,测得烧瓶中压强为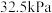 ,则
,则
 ,反应
,反应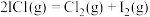 的平衡常数K=
的平衡常数K=(2)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数
 。
。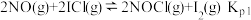

得到
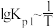 和
和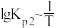 均为线性关系,如下图所示:
均为线性关系,如下图所示:
反应
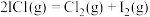 的K=
的K= 、
、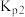 表示)。
表示)。
您最近一年使用:0次
名校
解题方法
9 . 完成下列问题
(1)某温度(t℃)时,水的Kw=1×10-12,则该温度_______ (填“>”“<”或“=”)25℃
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈_______ (填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=_______ mol·L-1。
(3)25℃时,0.05mol·L-1H2SO4溶液的pH=_______ ,0.01 mol·L-1NaOH溶液的pH=_______ 。
(4)25℃时,0.1mol·L-1下列物质的溶液,水电离出的c(H+)由大到小的关系是_______ (填序号)。
①HCl ②CH3COOH(Ka=1.7×10-5) ③NH3·H2O(Kb=1.7×10-5) ④Ba(OH)2
(5)25℃时,pH=4的盐酸中水的电离程度_______ pH=10的Ba(OH)2溶液中水的电离程度。(填大于、小于或等于)
(1)某温度(t℃)时,水的Kw=1×10-12,则该温度
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈
(3)25℃时,0.05mol·L-1H2SO4溶液的pH=
(4)25℃时,0.1mol·L-1下列物质的溶液,水电离出的c(H+)由大到小的关系是
①HCl ②CH3COOH(Ka=1.7×10-5) ③NH3·H2O(Kb=1.7×10-5) ④Ba(OH)2
(5)25℃时,pH=4的盐酸中水的电离程度
您最近一年使用:0次
解题方法
10 . 25℃时,H2CO3的Ka1=4.5×10−7,Ka2=4.8×10−11。请回答:
(1)25℃时,水的离子积Kw=_______ 。
(2)NaHCO3溶液显_______ (填“酸性”、“中性”或“碱性”),结合数据 分析其原因是_______ 。
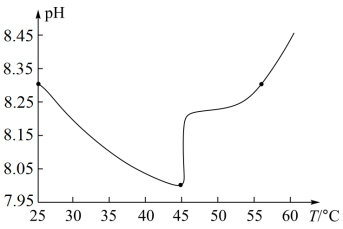
(3)某实验测得0.050 mol·L−1 NaHCO3溶液在加热过程中的pH变化如图所示。试分析45℃后,随温度升高NaHCO3溶液pH增大的原因是_______ 。
(4)氯气通入NaHCO3溶液中产生无色气体,该反应的离子方程式是_______ 。
(1)25℃时,水的离子积Kw=
(2)NaHCO3溶液显
(3)某实验测得0.050 mol·L−1 NaHCO3溶液在加热过程中的pH变化如图所示。试分析45℃后,随温度升高NaHCO3溶液pH增大的原因是

(4)氯气通入NaHCO3溶液中产生无色气体,该反应的离子方程式是
您最近一年使用:0次
2022-03-06更新
|
232次组卷
|
2卷引用:浙江省丽水市2021-2022学年高二上学期普通高中教学质量监控(期末)化学试题



