25℃时,H2CO3的Ka1=4.5×10−7,Ka2=4.8×10−11。请回答:
(1)25℃时,水的离子积Kw=_______ 。
(2)NaHCO3溶液显_______ (填“酸性”、“中性”或“碱性”),结合数据 分析其原因是_______ 。
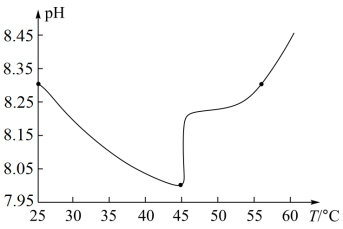
(3)某实验测得0.050 mol·L−1 NaHCO3溶液在加热过程中的pH变化如图所示。试分析45℃后,随温度升高NaHCO3溶液pH增大的原因是_______ 。
(4)氯气通入NaHCO3溶液中产生无色气体,该反应的离子方程式是_______ 。
(1)25℃时,水的离子积Kw=
(2)NaHCO3溶液显
(3)某实验测得0.050 mol·L−1 NaHCO3溶液在加热过程中的pH变化如图所示。试分析45℃后,随温度升高NaHCO3溶液pH增大的原因是

(4)氯气通入NaHCO3溶液中产生无色气体,该反应的离子方程式是
更新时间:2022-03-06 20:17:54
|
相似题推荐
计算题
|
适中
(0.65)
解题方法
【推荐1】已知水在25℃和100℃时,其电离平衡曲线如图所示:

(1)100℃时水的电离平衡曲线应为_________ (填“A”或“B”),理由是________________________ 。
(2)25℃时,将pH=9的 溶液与pH=4的
溶液与pH=4的 溶液混合,若所得混合溶液的pH=7,则
溶液混合,若所得混合溶液的pH=7,则 溶液与
溶液与 溶液的体积之比为
溶液的体积之比为________ 。
(3)100℃时,若100体积 的某强酸溶液与1体积
的某强酸溶液与1体积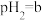 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的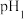 与强碱的
与强碱的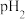 之间应满足的关系式为
之间应满足的关系式为___________ (用含a、b的式子表示)。

(1)100℃时水的电离平衡曲线应为
(2)25℃时,将pH=9的
 溶液与pH=4的
溶液与pH=4的 溶液混合,若所得混合溶液的pH=7,则
溶液混合,若所得混合溶液的pH=7,则 溶液与
溶液与 溶液的体积之比为
溶液的体积之比为(3)100℃时,若100体积
 的某强酸溶液与1体积
的某强酸溶液与1体积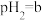 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的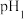 与强碱的
与强碱的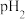 之间应满足的关系式为
之间应满足的关系式为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】完成下列计算:
(1)25℃,0.1mol/L NaOH溶液中的c(H+)=________ ,稀释该溶液到原体积的100倍,水电离出的c(OH-)的浓度为__________________ ;
(2)25℃,pH=13的NaOH溶液中的c(OH-)是pH=11的NaOH溶液中的c(OH-)的______ 倍,将这两种NaOH溶液等体积混合后的溶液pH为___________ (lg2≈0.3,lg3≈0.5,lg5≈0.7,忽略溶液体积变化);
(3)25℃,等物质的量浓度的NaOH溶液与盐酸按3:2体积比混合,所得溶液的pH为12,则NaOH溶液与盐酸的初始浓度为________________ (忽略溶液体积变化)。
(1)25℃,0.1mol/L NaOH溶液中的c(H+)=
(2)25℃,pH=13的NaOH溶液中的c(OH-)是pH=11的NaOH溶液中的c(OH-)的
(3)25℃,等物质的量浓度的NaOH溶液与盐酸按3:2体积比混合,所得溶液的pH为12,则NaOH溶液与盐酸的初始浓度为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】已知水的电离平衡曲线如图所示,试回答下列问题:
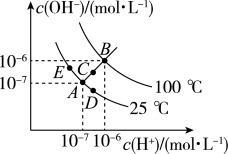
(1)图中五点Kw间的关系是___ 。
(2)若从A点到D点,可采用的措施是__ 。
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)C对应的温度下,测得纯水中的c(H+)=2.4×10-7mol•L-1,则c(OH-)为__ 。该温度下,测得某H2SO4溶液中c( )=5×10-6mol•L-1,该溶液中c(OH-)=
)=5×10-6mol•L-1,该溶液中c(OH-)=__ mol•L-1。
(4)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为__ 。
(5)B对应温度下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积与原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__ 。

(1)图中五点Kw间的关系是
(2)若从A点到D点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)C对应的温度下,测得纯水中的c(H+)=2.4×10-7mol•L-1,则c(OH-)为
 )=5×10-6mol•L-1,该溶液中c(OH-)=
)=5×10-6mol•L-1,该溶液中c(OH-)=(4)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(5)B对应温度下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积与原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)等体积等物质的量浓度的盐酸和氨水溶液混合后,溶液呈_____ (填“酸性”,“中性”或“碱性”),溶液中c(H+)_____ c(OH—)+c(NH3·H2O)(填“>”或“=”或“<”)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH—)=_______ mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)=__________ mol/L,由水电离产生的c(H+)=_______ mol/L,此时温度_______ 25℃(填“高于”、“低于”或“等于”)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH—)=
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】某温度下,纯水中的c(H+)= 2.0×10-7mol/L,则此时溶液中c(OH-)=_________ ;若温度不变,滴入稀盐酸使c(H+)= 5.0×10-4mol/L,则溶液中c(OH-)=_________ ,此时温度______ (填“高于”、“低于”、“等于”)25℃。
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
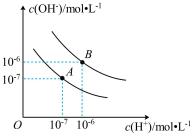
(1)则25 ℃时水的电离平衡曲线应为_______ (填“A”或“B”),请说明理由_____________________ 。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________ 。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______ (填“强”或“弱”)酸
(5)下列溶液pH随温度的变化如图所示的是______ (不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸

(6)下表室温下为几种弱电解质的电离平衡常数
少量CO2与NaHS反应的离子方程式为_________________________________________ 。室温下,CH3COONH4溶液的pH_________ 7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________ (用离子方程式表示)

(1)则25 ℃时水的电离平衡曲线应为
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为
(5)下列溶液pH随温度的变化如图所示的是
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸

(6)下表室温下为几种弱电解质的电离平衡常数
| CH3COOH | H2CO3 | H2S | NH3·H2O |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)已知H-H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据热化学方程式:N2(g) +3H2(g) =2NH3(g) ΔH=-92.4 kJ·mol-1。则N≡N键的键能是_________ 。
(2)已知下列热化学方程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H=﹣25 kJ·mol-1
②3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) △H=﹣47 kJ·mol-1
③Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H=﹢19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式______________ 。
(3)氯化铁水解的离子方程式为__________ ,配制氯化铁溶液时滴加少量盐酸的作用是_____ 。
(2)已知下列热化学方程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H=﹣25 kJ·mol-1
②3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) △H=﹣47 kJ·mol-1
③Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H=﹢19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
(3)氯化铁水解的离子方程式为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】盐类水解平衡和沉淀溶解平衡是水溶液中两种重要的离子平衡。回答下列问题:
(1)为抑制水解,实验室中配制 FeCl3溶液时常加入______ (填名称)。
(2)25℃ 时,pH 均为 3 的醋酸和硫酸铝两种溶液中,由水电离出的c(H+)之比为______ 。
(3)25℃时,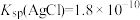 。现将足量氯化银固体放入100 mL0.2 mol/L AgNO3溶液中,则溶液中c(Cl-)=
。现将足量氯化银固体放入100 mL0.2 mol/L AgNO3溶液中,则溶液中c(Cl-)=______ mol·L-1(忽略溶液体积的变化)。
(4)某温度时,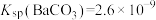 ,
,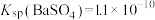 。在该温度下,向含有 BaSO4固体的溶液中滴加 Na2CO3溶液,当有 BaCO3沉淀生成时,溶液中
。在该温度下,向含有 BaSO4固体的溶液中滴加 Na2CO3溶液,当有 BaCO3沉淀生成时,溶液中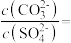
______ (保留1位小数)。
(1)为抑制水解,实验室中配制 FeCl3溶液时常加入
(2)25℃ 时,pH 均为 3 的醋酸和硫酸铝两种溶液中,由水电离出的c(H+)之比为
(3)25℃时,
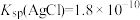 。现将足量氯化银固体放入100 mL0.2 mol/L AgNO3溶液中,则溶液中c(Cl-)=
。现将足量氯化银固体放入100 mL0.2 mol/L AgNO3溶液中,则溶液中c(Cl-)=(4)某温度时,
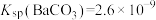 ,
,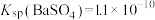 。在该温度下,向含有 BaSO4固体的溶液中滴加 Na2CO3溶液,当有 BaCO3沉淀生成时,溶液中
。在该温度下,向含有 BaSO4固体的溶液中滴加 Na2CO3溶液,当有 BaCO3沉淀生成时,溶液中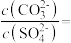
您最近一年使用:0次



