1 . 以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.5mol的H2在一定条件下发生反应:N2(g)+3H2(g)=2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5分钟内该反应的速率 (H2)=
(H2)=_______ ,当平衡时c(N2)=_______ ,此时H2的转化率为_______ %,此条件下该反应的平衡常数为_______ 。
(2)平衡后,若想提高H2的转化率,可以采取的措施有_______。
(3)若在上述2L的密闭容器中,一定量的氮气和氢气发生上述反应,其化学平衡常数K与温度T的关系如表所示:
①试比较K1、K2的大小,K1_______ K2(填“>”、“<”或“=”);
②400℃时,某时刻测得此容器中NH3、N2和H2物质的量分别为2mol、2mol和2mol,则此时该反应向_______ 进行(填“正反应”、“逆反应”或“已平衡”)。
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.5mol的H2在一定条件下发生反应:N2(g)+3H2(g)=2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5分钟内该反应的速率
 (H2)=
(H2)=(2)平衡后,若想提高H2的转化率,可以采取的措施有_______。
| A.加了催化剂 | B.增大容器体积 | C.降低反应体系的温度 | D.加入一定量N2 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,某时刻测得此容器中NH3、N2和H2物质的量分别为2mol、2mol和2mol,则此时该反应向
您最近一年使用:0次
名校
2 . 对碳及其氧化物的化学研究有助于人类充分利用化石燃料,消除碳氧化物对环境的负面影响。用 代替
代替 与燃料
与燃料 反应,既可以提高燃烧效率,又能得到高纯
反应,既可以提高燃烧效率,又能得到高纯 ,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①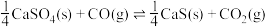
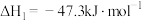
②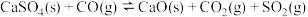
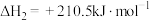
③
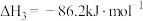
(1)反应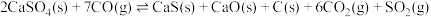 的
的
___________ (用 表示)。
表示)。
(2)向盛有 的真空恒容容器中充入
的真空恒容容器中充入 ,反应①于
,反应①于 达到平衡(
达到平衡( ),平衡时
),平衡时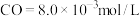 ,
, 的平衡转化率为
的平衡转化率为___________ 。(忽略副反应,结果保留2位有效数字)。
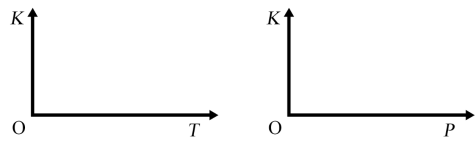
(3)其它条件不变时,升高温度戒缩小容器的体积,均能使反应②的平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P,缩小容器体积)变化而变化的示意图_______ :
(4)某温度下,测得 的
的 溶液的
溶液的 为11,将该温度下
为11,将该温度下 的
的 溶液
溶液 与
与 的
的 溶液,
溶液, 混合,通过计算填写以下不同情况时两溶液的体积比:
混合,通过计算填写以下不同情况时两溶液的体积比:
①若所得混合溶液为中性,且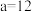 ,
,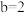 ,则
,则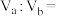
___________ 。
②若所得混合溶液为中性,且 ,则
,则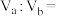
___________ 。
③若所得混合溶液的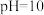 ,且
,且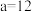 ,
,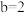 ,则
,则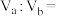
___________ 。
 代替
代替 与燃料
与燃料 反应,既可以提高燃烧效率,又能得到高纯
反应,既可以提高燃烧效率,又能得到高纯 ,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。①
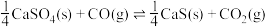
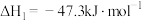
②
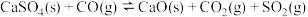
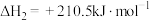
③

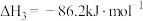
(1)反应
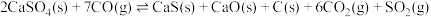 的
的
 表示)。
表示)。(2)向盛有
 的真空恒容容器中充入
的真空恒容容器中充入 ,反应①于
,反应①于 达到平衡(
达到平衡( ),平衡时
),平衡时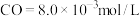 ,
, 的平衡转化率为
的平衡转化率为(3)其它条件不变时,升高温度戒缩小容器的体积,均能使反应②的平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P,缩小容器体积)变化而变化的示意图

(4)某温度下,测得
 的
的 溶液的
溶液的 为11,将该温度下
为11,将该温度下 的
的 溶液
溶液 与
与 的
的 溶液,
溶液, 混合,通过计算填写以下不同情况时两溶液的体积比:
混合,通过计算填写以下不同情况时两溶液的体积比:①若所得混合溶液为中性,且
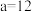 ,
,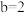 ,则
,则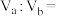
②若所得混合溶液为中性,且
 ,则
,则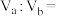
③若所得混合溶液的
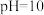 ,且
,且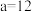 ,
,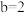 ,则
,则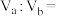
您最近一年使用:0次
名校
3 . 反应: ,在密闭容器中达到平衡时
,在密闭容器中达到平衡时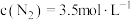 ,
,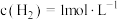 ,
,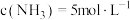 ,求:
,求:
(1) 和
和 的起始浓度
的起始浓度_________ 。
(2) 的转化率
的转化率_________ 。
(3)平衡时压强为开始时压强的百分之几_________ 。
(4)平衡时 占总体积的体积分数
占总体积的体积分数_________ 。
 ,在密闭容器中达到平衡时
,在密闭容器中达到平衡时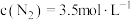 ,
,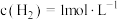 ,
,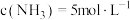 ,求:
,求:(1)
 和
和 的起始浓度
的起始浓度(2)
 的转化率
的转化率(3)平衡时压强为开始时压强的百分之几
(4)平衡时
 占总体积的体积分数
占总体积的体积分数
您最近一年使用:0次
名校
解题方法
4 . 完成下列问题。
(1)常温下,0.05mol/L硫酸溶液中,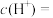
___________ mol/L,水电离的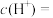
___________ mol/L。将1mL该溶液加水稀释到100mL,稀释后的溶液中
___________ 。
(2)T1℃时,纯水中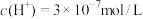 ,则纯水中
,则纯水中
___________ mol/L,此时温度___________ (填“高于”“低于”或“等于”)25℃。若温度不变,滴入盐酸后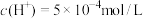 ,则溶液中
,则溶液中
___________ mol/L,由水电离的
___________ mol/L。
(3)T2℃时,测得 的NaOH溶液的pH为11,则该温度下水的离子积常数
的NaOH溶液的pH为11,则该温度下水的离子积常数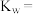
___________ 。该温度___________ (填“高于”“低于”或“等于”)25℃。
(4)常温下,设pH=5的 溶液中由水电离出的
溶液中由水电离出的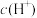 为c1;pH=5的
为c1;pH=5的 溶液中由水电离出的
溶液中由水电离出的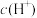 为
为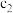 ,则
,则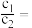
___________ 。
(5)常温下,pH=13的 溶液aL与pH=3的
溶液aL与pH=3的 溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=
溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=___________ 。
(6)已知t℃时,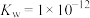 ,在该温度时将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a∶b=
,在该温度时将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a∶b=___________ 。
(1)常温下,0.05mol/L硫酸溶液中,
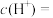
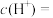

(2)T1℃时,纯水中
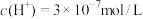 ,则纯水中
,则纯水中
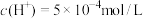 ,则溶液中
,则溶液中

(3)T2℃时,测得
 的NaOH溶液的pH为11,则该温度下水的离子积常数
的NaOH溶液的pH为11,则该温度下水的离子积常数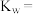
(4)常温下,设pH=5的
 溶液中由水电离出的
溶液中由水电离出的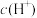 为c1;pH=5的
为c1;pH=5的 溶液中由水电离出的
溶液中由水电离出的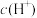 为
为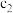 ,则
,则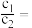
(5)常温下,pH=13的
 溶液aL与pH=3的
溶液aL与pH=3的 溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=
溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=(6)已知t℃时,
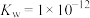 ,在该温度时将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a∶b=
,在该温度时将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a∶b=
您最近一年使用:0次
名校
5 . 已知几种含碳物质间的转化及能量变化关系如图所示。
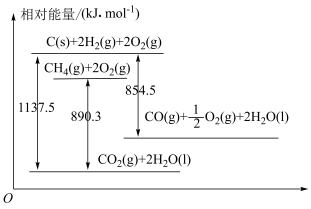
(1)写出表示CO燃烧热的热化学方程式:___________ 。
(2)反应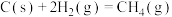

___________  ,该反应中反应物的总键能
,该反应中反应物的总键能___________ (填“大于”、“小于”或“等于”)生成物的总键能。若18gC(s)与 反应,完全转化成
反应,完全转化成 ,需要
,需要___________ (填“吸收”或“放出”)___________ kJ能量。
(3)在25℃、101kPa下,30g由 和CO组成的混合气体完全燃烧生成
和CO组成的混合气体完全燃烧生成 和液态水,放出热量1031.8kJ。则混合气体中
和液态水,放出热量1031.8kJ。则混合气体中 和CO的物质的量分别为
和CO的物质的量分别为___________ mol、___________ mol。

(1)写出表示CO燃烧热的热化学方程式:
(2)反应
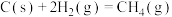

 ,该反应中反应物的总键能
,该反应中反应物的总键能 反应,完全转化成
反应,完全转化成 ,需要
,需要(3)在25℃、101kPa下,30g由
 和CO组成的混合气体完全燃烧生成
和CO组成的混合气体完全燃烧生成 和液态水,放出热量1031.8kJ。则混合气体中
和液态水,放出热量1031.8kJ。则混合气体中 和CO的物质的量分别为
和CO的物质的量分别为
您最近一年使用:0次
2023-11-21更新
|
142次组卷
|
2卷引用:河南省新乡市2023-2024学年高二上学期期中考试化学试题
解题方法
6 . I.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质,请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

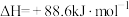
则M、N相比,较稳定的是___________ 。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,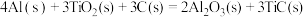
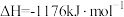 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为___________ kJ。
(3) 、
、 、C都是优质的能源物质,它们燃烧的热化学方程式分别为
、C都是优质的能源物质,它们燃烧的热化学方程式分别为
①
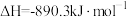 ;
;
②
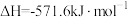 ;
;
③
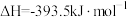 ;
;
已知 、
、 组成的混合气体
组成的混合气体 ,又
,又 与
与 的物质的量之比
的物质的量之比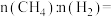 3:2,则该混合气体完全燃烧后放出的热量为
3:2,则该混合气体完全燃烧后放出的热量为___________ kJ; 的反应热无法直接测量,但通过上述反应可求出其反应热
的反应热无法直接测量,但通过上述反应可求出其反应热
___________  。
。
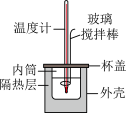
II. 的盐酸与
的盐酸与 的
的 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
(4)实验中若改用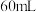
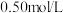 的盐酸与
的盐酸与
 的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热___________ (填“相等”或“不相等”)。
(5)下列说法正确的是___________(填字母)。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

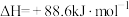
则M、N相比,较稳定的是
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
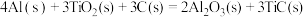
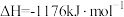 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为(3)
 、
、 、C都是优质的能源物质,它们燃烧的热化学方程式分别为
、C都是优质的能源物质,它们燃烧的热化学方程式分别为①

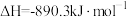 ;
;②

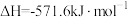 ;
;③

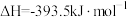 ;
;已知
 、
、 组成的混合气体
组成的混合气体 ,又
,又 与
与 的物质的量之比
的物质的量之比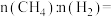 3:2,则该混合气体完全燃烧后放出的热量为
3:2,则该混合气体完全燃烧后放出的热量为 的反应热无法直接测量,但通过上述反应可求出其反应热
的反应热无法直接测量,但通过上述反应可求出其反应热
 。
。II.
 的盐酸与
的盐酸与 的
的 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
(4)实验中若改用
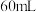
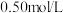 的盐酸与
的盐酸与
 的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热(5)下列说法正确的是___________(填字母)。
| A.玻璃搅拌棒可用铜丝搅拌棒替代 |
| B.向内筒中加入稀碱时,应当缓慢而匀速地加入 |
| C.实验中如果用相同体积、相同浓度的醋酸代替盐酸,测得的中和热数值将偏小 |
| D.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差 |
您最近一年使用:0次
解题方法
7 . 回答下列问题
(1)在25℃、101kPa下,1g甲醇( )液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出QkJ的热量,则表示甲醇燃烧热的热化学方程式为:
)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出QkJ的热量,则表示甲醇燃烧热的热化学方程式为:___________ 。
(2)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为
 。
。
已知:碳的燃烧热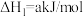 ,
,
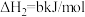 ,
, 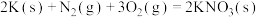
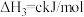 ,则x为
,则x为___________ kJ/mol。
(3)一定条件下,在水溶液中所含离子 、
、 、
、 、
、 、
、 各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应
各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应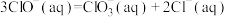 的
的
___________ kJ/mol。

(1)在25℃、101kPa下,1g甲醇(
 )液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出QkJ的热量,则表示甲醇燃烧热的热化学方程式为:
)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出QkJ的热量,则表示甲醇燃烧热的热化学方程式为:(2)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为

 。
。已知:碳的燃烧热
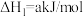 ,
,
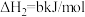 ,
, 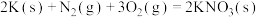
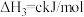 ,则x为
,则x为(3)一定条件下,在水溶液中所含离子
 、
、 、
、 、
、 、
、 各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应
各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应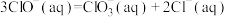 的
的

您最近一年使用:0次
名校
解题方法
8 . 研究化学反应中的能量变化对生产、生活有重要的意义。
(1)甲烷是一种高效清洁的新能源, 完全燃烧生成液态水时放出的热量为
完全燃烧生成液态水时放出的热量为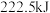 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
(2)已知:


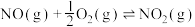


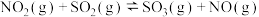


则
___________ (填含 、
、 的表达式),
的表达式),
___________ (填含 、
、 的表达式)。
的表达式)。
(3)已知: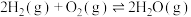
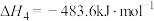 。查阅文献资料得部分化学键的键能如表所示:
。查阅文献资料得部分化学键的键能如表所示:
①合成氨反应 的活化能
的活化能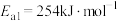 ,则氨分解反应
,则氨分解反应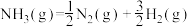 的活化能
的活化能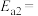
___________  。
。
②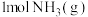 完全燃烧生成
完全燃烧生成 和水蒸气时放出
和水蒸气时放出___________ kJ的热量;又已知
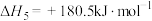 ,则氨催化氧化的热化学方程式为
,则氨催化氧化的热化学方程式为___________ 。
(4)研究氮氧化物与大气中悬浮的海盐粒子的相互作用时,涉及反应:

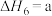
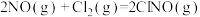
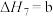
则反应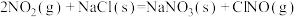 的
的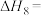
___________ (用含a、b的表达式表示)。
(1)甲烷是一种高效清洁的新能源,
 完全燃烧生成液态水时放出的热量为
完全燃烧生成液态水时放出的热量为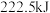 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)已知:



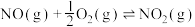


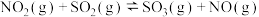


则

 、
、 的表达式),
的表达式),
 、
、 的表达式)。
的表达式)。(3)已知:
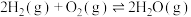
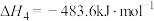 。查阅文献资料得部分化学键的键能如表所示:
。查阅文献资料得部分化学键的键能如表所示:| 化学键 | H—H |  | N—H |
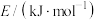 | 436 | 946 | 391 |
 的活化能
的活化能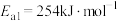 ,则氨分解反应
,则氨分解反应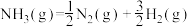 的活化能
的活化能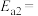
 。
。②
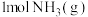 完全燃烧生成
完全燃烧生成 和水蒸气时放出
和水蒸气时放出
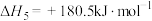 ,则氨催化氧化的热化学方程式为
,则氨催化氧化的热化学方程式为(4)研究氮氧化物与大气中悬浮的海盐粒子的相互作用时,涉及反应:

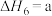
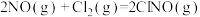
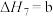
则反应
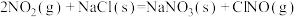 的
的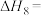
您最近一年使用:0次
2023-11-13更新
|
212次组卷
|
2卷引用:福建省泉州市2023-2024学年高二上学期期中考试化学试题
解题方法
9 . 已知几种含碳物质间的转化及能量变化关系如图所示。

(1)写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:___________ ,若有672mL(标准状况下) 完全燃烧,会放出
完全燃烧,会放出___________ kJ能量。
(2)反应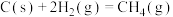
 =
=___________ kJ⋅mol-1,该反应中反应物的总键能___________ (填“大于”、“小于”或“等于”)生成物的总键能;若18gC(s)与 反应,完全转化成
反应,完全转化成 ,需要
,需要___________ (填“吸收”或“放出”)___________ kJ能量。
(3)在25℃、101kPa下,30g由 和
和 组成的混合气体完全燃烧生成
组成的混合气体完全燃烧生成 和液态水,放出热量1031.8kJ,则混合气体中
和液态水,放出热量1031.8kJ,则混合气体中 和
和 的物质的量分别为
的物质的量分别为___________ mol、___________ mol。

(1)写出表示
 燃烧热的热化学方程式:
燃烧热的热化学方程式: 完全燃烧,会放出
完全燃烧,会放出(2)反应
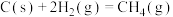
 =
= 反应,完全转化成
反应,完全转化成 ,需要
,需要(3)在25℃、101kPa下,30g由
 和
和 组成的混合气体完全燃烧生成
组成的混合气体完全燃烧生成 和液态水,放出热量1031.8kJ,则混合气体中
和液态水,放出热量1031.8kJ,则混合气体中 和
和 的物质的量分别为
的物质的量分别为
您最近一年使用:0次
名校
解题方法
10 . 完成下列计算:
(1)已知工业上制取硫酸需要发生以下反应
Ⅰ. ;Ⅱ.
;Ⅱ.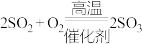 ;Ⅲ.
;Ⅲ.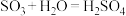
①假设在生产中所有反应完全进行,则每生产1.00吨98%的浓硫酸需要
______ 吨。(保留2位小数)
②实际生产中可能会有损耗(即存在反应物没有发生反应),假设反应Ⅰ中 损耗率为20%,反应Ⅱ中
损耗率为20%,反应Ⅱ中 损耗率为10%,则实际生产1吨98%浓硫酸需要
损耗率为10%,则实际生产1吨98%浓硫酸需要
______ 吨。(保留2位小数)
(2)取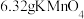 固体,加热一段时间后,剩余固体5.84g。该剩余固体与足量的浓盐酸在加热条件下充分反应生成氯气,产物中所有Mn元素均转化为
固体,加热一段时间后,剩余固体5.84g。该剩余固体与足量的浓盐酸在加热条件下充分反应生成氯气,产物中所有Mn元素均转化为 。
。
① 分解生成氧气的物质的量
分解生成氧气的物质的量
______ mol
② 分解的百分率为
分解的百分率为______ %;
③第二步反应中生成氯气的物质的量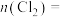
______ mol
(1)已知工业上制取硫酸需要发生以下反应
Ⅰ.
 ;Ⅱ.
;Ⅱ.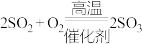 ;Ⅲ.
;Ⅲ.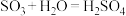
①假设在生产中所有反应完全进行,则每生产1.00吨98%的浓硫酸需要

②实际生产中可能会有损耗(即存在反应物没有发生反应),假设反应Ⅰ中
 损耗率为20%,反应Ⅱ中
损耗率为20%,反应Ⅱ中 损耗率为10%,则实际生产1吨98%浓硫酸需要
损耗率为10%,则实际生产1吨98%浓硫酸需要
(2)取
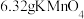 固体,加热一段时间后,剩余固体5.84g。该剩余固体与足量的浓盐酸在加热条件下充分反应生成氯气,产物中所有Mn元素均转化为
固体,加热一段时间后,剩余固体5.84g。该剩余固体与足量的浓盐酸在加热条件下充分反应生成氯气,产物中所有Mn元素均转化为 。
。①
 分解生成氧气的物质的量
分解生成氧气的物质的量
②
 分解的百分率为
分解的百分率为③第二步反应中生成氯气的物质的量
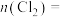
您最近一年使用:0次
2023-11-06更新
|
180次组卷
|
2卷引用:11-2023新东方高二上期中考化学11



