以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.5mol的H2在一定条件下发生反应:N2(g)+3H2(g)=2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5分钟内该反应的速率 (H2)=
(H2)=_______ ,当平衡时c(N2)=_______ ,此时H2的转化率为_______ %,此条件下该反应的平衡常数为_______ 。
(2)平衡后,若想提高H2的转化率,可以采取的措施有_______。
(3)若在上述2L的密闭容器中,一定量的氮气和氢气发生上述反应,其化学平衡常数K与温度T的关系如表所示:
①试比较K1、K2的大小,K1_______ K2(填“>”、“<”或“=”);
②400℃时,某时刻测得此容器中NH3、N2和H2物质的量分别为2mol、2mol和2mol,则此时该反应向_______ 进行(填“正反应”、“逆反应”或“已平衡”)。
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.5mol的H2在一定条件下发生反应:N2(g)+3H2(g)=2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5分钟内该反应的速率
 (H2)=
(H2)=(2)平衡后,若想提高H2的转化率,可以采取的措施有_______。
| A.加了催化剂 | B.增大容器体积 | C.降低反应体系的温度 | D.加入一定量N2 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,某时刻测得此容器中NH3、N2和H2物质的量分别为2mol、2mol和2mol,则此时该反应向
更新时间:2023-12-12 13:29:09
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】一定温度下,在容积为2 L的恒容密闭容器中分别充入2.4 mol NO和2.4 mol CO,发生可逆反应: △H<0,反应过程中部分反应物和生成物的物质的量的变化关系如图所示:
△H<0,反应过程中部分反应物和生成物的物质的量的变化关系如图所示:
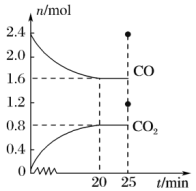
(1)当反应达到平衡时,NO和CO的转化率之比是___________ 。0~20 min内反应速率v(N2)=___________ 。
(2)该温度下的平衡常数K=___________ ,25 min时,若温度不变,向容器中再分别充入0.4 mol CO和0.4 mol N2,则化学平衡___________ 将 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。
移动。
(3)25 min时,保持其它条件不变,将反应体系中的c(CO)、c(NO)、c(N2)、c(CO2)均同时减半,化学平衡将___________ 将 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。
移动。
(4)若换用一个恒容、绝热的容器,使容器内温度迅速升至原来的2倍,则平衡将___________  填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。达到新平衡后,容器内温度
移动。达到新平衡后,容器内温度___________  填“大于”“小于”或“等于”
填“大于”“小于”或“等于” 原来的2倍。
原来的2倍。
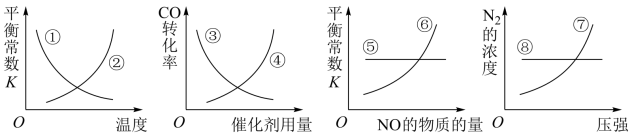
(5)反应达到平衡后,若改变某一个条件,下列八条曲线(①~⑧)正确的是___________  填序号
填序号 。
。
(6)汽车尾气治理的方法之一是使用催化转化装置,其中的反应原理之一是: ,△H=-113.0 kJ/mol,室温条件下,该反应的△S=-145.3 J/(mol·K),则该反应
,△H=-113.0 kJ/mol,室温条件下,该反应的△S=-145.3 J/(mol·K),则该反应___________  填“能”或“不能”
填“能”或“不能” 自发进行。
自发进行。
 △H<0,反应过程中部分反应物和生成物的物质的量的变化关系如图所示:
△H<0,反应过程中部分反应物和生成物的物质的量的变化关系如图所示:
(1)当反应达到平衡时,NO和CO的转化率之比是
(2)该温度下的平衡常数K=
 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。
移动。(3)25 min时,保持其它条件不变,将反应体系中的c(CO)、c(NO)、c(N2)、c(CO2)均同时减半,化学平衡将
 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。
移动。(4)若换用一个恒容、绝热的容器,使容器内温度迅速升至原来的2倍,则平衡将
 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。达到新平衡后,容器内温度
移动。达到新平衡后,容器内温度 填“大于”“小于”或“等于”
填“大于”“小于”或“等于” 原来的2倍。
原来的2倍。(5)反应达到平衡后,若改变某一个条件,下列八条曲线(①~⑧)正确的是
 填序号
填序号 。
。
(6)汽车尾气治理的方法之一是使用催化转化装置,其中的反应原理之一是:
 ,△H=-113.0 kJ/mol,室温条件下,该反应的△S=-145.3 J/(mol·K),则该反应
,△H=-113.0 kJ/mol,室温条件下,该反应的△S=-145.3 J/(mol·K),则该反应 填“能”或“不能”
填“能”或“不能” 自发进行。
自发进行。
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】恒温恒容下,将2 mol红棕色气体A和1.5 mol无色气体B通入体积为1 L的密闭容器中发生如下反应: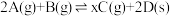 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_______ mol/(L·min)
(2)x=_______ ;A的转化率与B的转化率之比为_______
(3)写出该温度下的平衡常数表达式_______ (用相关字母表示),数值_______
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)_______ v(逆)。(填“>”、“=”或“<”)
 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)写出该温度下的平衡常数表达式
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐3】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
‘
(1)该密闭容器的容积是______________ L。
(2)达到平衡状态的时刻是_______________ min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率 (CO2)=
(CO2)=_____________ mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为______ 。
(5)该温度下,反应的化学平衡常数数值是____ 。
(6)已知: ① CO(g)+2H2(g) CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)
CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)  CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____ ,反应在10 min内所放出的热量为_____ kJ.
 CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:‘

(1)该密闭容器的容积是
(2)达到平衡状态的时刻是
(3)在前10min内,用CO2浓度的变化表示的反应速率
 (CO2)=
(CO2)=(4)10min时体系的压强与开始时压强之比为
(5)该温度下,反应的化学平衡常数数值是
(6)已知: ① CO(g)+2H2(g)
 CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)
CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)  CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】对氮及其化合物的研究具有重要意义。
(1)在1L密闭容器中,4mol氨气在一定条件下分解生成生成氮气和氢气。2min时反应吸收热量为46.1KJ,此时氨气的转化率为25%。该反应的热化学方程式为____________ 。
(2)某恒温恒压条件下,向容积为VL的密闭容器中,起始充入lmolN2、3molH2、16molNH3,发生N2(g)+3H2(g) 2NH3(g)。达到平衡后,N2、H2、NH3的物质的量分别amol、bmol、cmol,此时容器的容积为1.1VL,回答下列问题:
2NH3(g)。达到平衡后,N2、H2、NH3的物质的量分别amol、bmol、cmol,此时容器的容积为1.1VL,回答下列问题:
① 起始时反应速率V(正)______ V(逆)(填“>”“<”或“=”)
② 平衡时a=________ , b=________ .
③ 若平衡后再充入3.6mol NH3,重新建立平衡时容器的容积为________ .
(1)在1L密闭容器中,4mol氨气在一定条件下分解生成生成氮气和氢气。2min时反应吸收热量为46.1KJ,此时氨气的转化率为25%。该反应的热化学方程式为
(2)某恒温恒压条件下,向容积为VL的密闭容器中,起始充入lmolN2、3molH2、16molNH3,发生N2(g)+3H2(g)
 2NH3(g)。达到平衡后,N2、H2、NH3的物质的量分别amol、bmol、cmol,此时容器的容积为1.1VL,回答下列问题:
2NH3(g)。达到平衡后,N2、H2、NH3的物质的量分别amol、bmol、cmol,此时容器的容积为1.1VL,回答下列问题:① 起始时反应速率V(正)
② 平衡时a=
③ 若平衡后再充入3.6mol NH3,重新建立平衡时容器的容积为
您最近一年使用:0次
【推荐2】(1)反应Fe(s)+CO2(g)⇌FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)⇌FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
①反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______ (用ΔH1和ΔH2表示),K=_______ (用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)⇌CO(g)+H2O(g)是_______ 反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)⇌CO(g)+H2O(g)达到化学平衡状态的依据是_______ (填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)⇌ FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
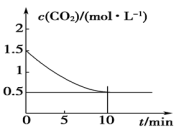
①该条件下反应的平衡常数为___ ;若铁粉足量,CO2的起始浓度为2.0mol·L-1,10分钟达到平衡,则平衡时CO2的浓度为____ mol·L-1,v(CO)为____ 。
②下列措施中能使平衡时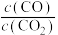 增大的是
增大的是___ (填字母)。
A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=
②能判断CO2(g)+H2(g)⇌CO(g)+H2O(g)达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)⇌ FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为
②下列措施中能使平衡时
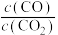 增大的是
增大的是A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】乙炔广泛用于焊接、焊割及有机合成等方面。
(1)已知下列热化学方程式:
4CH4 (g)+3O2(g)==2C2H2(g)+6H2O(g) △H1=a kJ•mol-1;
2H2(g)+O2(g)==2H2O(g) △H2=b kJ•mol-1;
2CH4(g)==C2H2(g)+3H2 (g) △H3
①△H3=____________________ (用含a、b的代数式表示)kJ•mol-1。
②已知下列共价键的键能数据:
则△H3=____________________ (填数值)kJ•mol-1。
(2)氯仿(CHCl3)与金属银共热可以制取乙炔,该反应的化学方程式为__________________________ 。
(3)向压强为1.0×104 kPa的恒压密闭容器中充入1 mol乙炔和1 mol HCl气体,在催化剂作用下乙炔与HCl发生反应:HC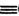 CH(g)+HCl(g)
CH(g)+HCl(g) CH2==CHCl(g),乙炔的平衡转化率与温度的关系如图所示。
CH2==CHCl(g),乙炔的平衡转化率与温度的关系如图所示。
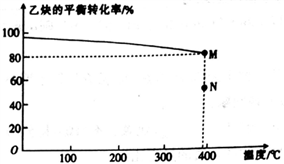
①该反应的△H__________ (填“>”或“<”)0,N点时乙炔的反应速率v(正)________ (填“>”或“<” 或“=”) v(逆)。
② M点对应温度下,该反应的平衡常数Kp=_________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(kPa)-1,
(1)已知下列热化学方程式:
4CH4 (g)+3O2(g)==2C2H2(g)+6H2O(g) △H1=a kJ•mol-1;
2H2(g)+O2(g)==2H2O(g) △H2=b kJ•mol-1;
2CH4(g)==C2H2(g)+3H2 (g) △H3
①△H3=
②已知下列共价键的键能数据:
| 共价键 | C—H | H—H | C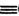 C C |
| 键能/ kJ•mol-1 | 413.4 | 436 | 812 |
(2)氯仿(CHCl3)与金属银共热可以制取乙炔,该反应的化学方程式为
(3)向压强为1.0×104 kPa的恒压密闭容器中充入1 mol乙炔和1 mol HCl气体,在催化剂作用下乙炔与HCl发生反应:HC
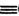 CH(g)+HCl(g)
CH(g)+HCl(g) CH2==CHCl(g),乙炔的平衡转化率与温度的关系如图所示。
CH2==CHCl(g),乙炔的平衡转化率与温度的关系如图所示。
①该反应的△H
② M点对应温度下,该反应的平衡常数Kp=
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】一定温度下,体积为2L的密闭容器中装有4molSO2和2molO2,发生反应2SO2+O2 2SO3。2min末达到平衡测得容器中有1.6molSO2,请计算:
2SO3。2min末达到平衡测得容器中有1.6molSO2,请计算:
(1)2min末SO3的浓度是___________ ;
(2)2min内SO2的平均反应速率是___________ 。
(3)2min内O2的转化率是___________ 。
(4)该温度下的平衡常数为K=___________ L·mol-1。(计算结果)
 2SO3。2min末达到平衡测得容器中有1.6molSO2,请计算:
2SO3。2min末达到平衡测得容器中有1.6molSO2,请计算:(1)2min末SO3的浓度是
(2)2min内SO2的平均反应速率是
(3)2min内O2的转化率是
(4)该温度下的平衡常数为K=
您最近一年使用:0次
【推荐2】把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g)  2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC.又知在此时D的平均速率为0.15mol•L-1•min-1.(要求写出计算过程)
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC.又知在此时D的平均速率为0.15mol•L-1•min-1.(要求写出计算过程)
求:
(1)平衡时A的物质的量浓度____ ;
(2)B的转化率____ ;
(3)x的值____ ;
(4)平衡时D的物质的量分数____ ;
(5)反应前后压强比(分数表示)____
(6)平衡常数K____
 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC.又知在此时D的平均速率为0.15mol•L-1•min-1.(要求写出计算过程)
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC.又知在此时D的平均速率为0.15mol•L-1•min-1.(要求写出计算过程)求:
(1)平衡时A的物质的量浓度
(2)B的转化率
(3)x的值
(4)平衡时D的物质的量分数
(5)反应前后压强比(分数表示)
(6)平衡常数K
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在, CrO42-和Cr2O72-在溶液中可相互转化2CrO42-+2H+ Cr2O72-+H2O。 室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:
Cr2O72-+H2O。 室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:

(1)由图可知,随着溶液酸性增强,CrO42-的平衡转化率__________ (填“增大“减小”或“不变”)。根据A(1.0,0.25)点数据,计算出该转化反应的平衡常数为__________ 。
(2)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH_______ 0(填“大于”“小于”或“等于”)。
(3) 在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为_______ mol/L,此时溶液中c(CrO42-)等于__________ mol/L。 (已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
 Cr2O72-+H2O。 室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:
Cr2O72-+H2O。 室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:
(1)由图可知,随着溶液酸性增强,CrO42-的平衡转化率
(2)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH
(3) 在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下2L的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g) CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
(1)在500s内用H2表示的化学反应速率是________________ 。
(2)在1000s内用CO表示的化学反应速率是________________ ,1000s时CO的转化率是________ 。
(3)在500s时生成的甲醇的浓度是________
 CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:| t/s | 0 | 500 | 1 000 |
| c(H2)/ mol.L-1 | 5.00 | 3.52 | 2.48 |
| c(CO)/ mol.L-1 | 2.50 |
(2)在1000s内用CO表示的化学反应速率是
(3)在500s时生成的甲醇的浓度是
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】某水煤气工厂在1 200 ℃时测得反应H2(g)+CO2(g)  H2O(g)+CO(g)的平衡常数K为2.25。若反应从H2(g)和CO2(g)开始,且H2(g)和CO2(g)的初始浓度均为0.010 mol/L时,计算
H2O(g)+CO(g)的平衡常数K为2.25。若反应从H2(g)和CO2(g)开始,且H2(g)和CO2(g)的初始浓度均为0.010 mol/L时,计算
(1)各物质的平衡浓度。
(2)H2(g)和CO2(g)的平衡转化率。
 H2O(g)+CO(g)的平衡常数K为2.25。若反应从H2(g)和CO2(g)开始,且H2(g)和CO2(g)的初始浓度均为0.010 mol/L时,计算
H2O(g)+CO(g)的平衡常数K为2.25。若反应从H2(g)和CO2(g)开始,且H2(g)和CO2(g)的初始浓度均为0.010 mol/L时,计算(1)各物质的平衡浓度。
(2)H2(g)和CO2(g)的平衡转化率。
您最近一年使用:0次
【推荐3】已知H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ==COS(g)+H2O(g),在610K时,将0.1mol CO2加入与0.40molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率a1=_______ %,反应平衡常数K=___________ 。
②在620K重复实验,平衡后水的物质的量分数为003,H2S的转化率a2____ a1,该反应的ΔH___ 0。(填“>”“<”或“=”)
①H2S的平衡转化率a1=
②在620K重复实验,平衡后水的物质的量分数为003,H2S的转化率a2
您最近一年使用:0次



