1 . 根据要求回答下列问题。
(1)工业上用碳酸钠与铝土矿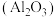 焙烧得到可溶性含铝化合物,写出该含铝化合物的化学式:
焙烧得到可溶性含铝化合物,写出该含铝化合物的化学式:___________ 。
(2)焦炭、 和
和 在高温下反应,得到
在高温下反应,得到 和一种可燃性气体,写出反应的化学方程式:
和一种可燃性气体,写出反应的化学方程式:___________ 。
(3)当 接触含有
接触含有 的空气时,其表面会逐渐发黑
的空气时,其表面会逐渐发黑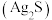 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)碱性条件下,向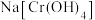 溶液中加入
溶液中加入 ,反应生成
,反应生成 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
(1)工业上用碳酸钠与铝土矿
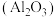 焙烧得到可溶性含铝化合物,写出该含铝化合物的化学式:
焙烧得到可溶性含铝化合物,写出该含铝化合物的化学式:(2)焦炭、
 和
和 在高温下反应,得到
在高温下反应,得到 和一种可燃性气体,写出反应的化学方程式:
和一种可燃性气体,写出反应的化学方程式:(3)当
 接触含有
接触含有 的空气时,其表面会逐渐发黑
的空气时,其表面会逐渐发黑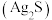 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)碱性条件下,向
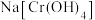 溶液中加入
溶液中加入 ,反应生成
,反应生成 ,写出反应的离子方程式:
,写出反应的离子方程式:
您最近一年使用:0次
名校
2 . 化学反应中会伴随放热和吸热的现象,请回答下列问题:
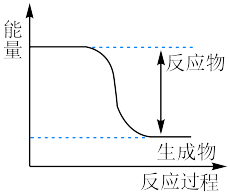
在人体内,O2与葡萄糖反应生成H2O和CO2的能量变化如图所示:___________ (填“放热”或“吸热”)反应,断开氧气分子中的化学键会___________ (填“放出”或“吸收”)能量,形成H-O键会___________ (填“放出”或“吸收”)能量,反应物的总能量___________ (填“大于”、“小于”或“等于”)生成物的总能量。
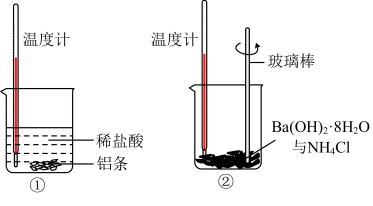
(2)某同学进行如下实验,研究化学反应中的热量变化。___________ (填“放热”或“吸热”)反应,Ba(OH)2·8H2O与NH4Cl的反应是___________ (填“放热”或“吸热”)反应。
(3)①中反应的离子方程式为___________ ,该反应的还原剂是___________ (填化学式)。
在人体内,O2与葡萄糖反应生成H2O和CO2的能量变化如图所示:
(2)某同学进行如下实验,研究化学反应中的热量变化。
(3)①中反应的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 卤族元素相关物质在生产、生活中应用广泛。回答下列问题:
(1) 的离子结构示意图为
的离子结构示意图为______ 。
(2)卤素单质有着相似的化学性质,但同时也有差别。比如 与NaOH反应生成NaCl、NaClO和水,而
与NaOH反应生成NaCl、NaClO和水,而 与NaOH发生如下反应:
与NaOH发生如下反应: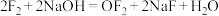 。其中
。其中 的电子式为
的电子式为______ ,用电子式描述NaF的形成过程:______ 。
(3)根据卤族元素性质的相似性和递变性,推测元素砹(At)的单质为有色固体,HAt的稳定性______ (填“大于”或“小于”)HI的稳定性,AgAt______ (填“易”或“难”)溶于水。
(4)不同卤素原子之间以共价键相结合形成的化合物称为卤素互化物,如 等。它们与卤素单质性质相似。
等。它们与卤素单质性质相似。
① 与水反应的产物可能为
与水反应的产物可能为______ (填化学式)。
②下列说法不正确的是______ 。
A.HF、HCl、HBr的沸点依次升高
B. 沸点依次升高
沸点依次升高
C.已知离子半径大小会影响离子键的强弱,从而影响物质的熔点:若离子半径越大,离子键越弱。据此推测NaF、NaCl、NaBr熔点依次降低
D. (X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(1)
 的离子结构示意图为
的离子结构示意图为(2)卤素单质有着相似的化学性质,但同时也有差别。比如
 与NaOH反应生成NaCl、NaClO和水,而
与NaOH反应生成NaCl、NaClO和水,而 与NaOH发生如下反应:
与NaOH发生如下反应: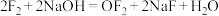 。其中
。其中 的电子式为
的电子式为(3)根据卤族元素性质的相似性和递变性,推测元素砹(At)的单质为有色固体,HAt的稳定性
(4)不同卤素原子之间以共价键相结合形成的化合物称为卤素互化物,如
 等。它们与卤素单质性质相似。
等。它们与卤素单质性质相似。①
 与水反应的产物可能为
与水反应的产物可能为②下列说法不正确的是
A.HF、HCl、HBr的沸点依次升高
B.
 沸点依次升高
沸点依次升高C.已知离子半径大小会影响离子键的强弱,从而影响物质的熔点:若离子半径越大,离子键越弱。据此推测NaF、NaCl、NaBr熔点依次降低
D.
 (X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
您最近一年使用:0次
2024-04-04更新
|
201次组卷
|
2卷引用:重庆市巴蜀中学校2023-2024学年高一下学期3月月考化学试题
名校
4 . 人类农业生产离不开氮肥,科学合理使用氰肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)某小组在实验室模拟以 为原料,制备少量硝态氮肥
为原料,制备少量硝态氮肥 ,转化途径如下(转化所需试剂及条件已略去)。
,转化途径如下(转化所需试剂及条件已略去)。
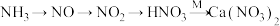
①工业合成氨是制取氮肥的基础。写出工业合成氨的化学反应方程式___________ 。
②写出实验室用NH4Cl和消石灰共热制备氨气的化学反应方程式_________________ 。
③写出NH3发生催化氧化反应生成NO的化学方程式____________________________ 。
向装置中通入4molNH3和2molO2,转移的电子数___________ (大于/小于/等于)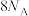 。
。
④工业上为了提高NO的转化率,可以适当增加O2的量,理论上在一定的温度和压强下将2LNO完全转化成HNO3,至少应该通入空气的体积为___________ 。
⑤将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M___________ (写化学式)。
(2)下列关于氮肥的使用说法正确的是___________。
(1)某小组在实验室模拟以
 为原料,制备少量硝态氮肥
为原料,制备少量硝态氮肥 ,转化途径如下(转化所需试剂及条件已略去)。
,转化途径如下(转化所需试剂及条件已略去)。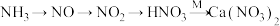
①工业合成氨是制取氮肥的基础。写出工业合成氨的化学反应方程式
②写出实验室用NH4Cl和消石灰共热制备氨气的化学反应方程式
③写出NH3发生催化氧化反应生成NO的化学方程式
向装置中通入4molNH3和2molO2,转移的电子数
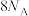 。
。④工业上为了提高NO的转化率,可以适当增加O2的量,理论上在一定的温度和压强下将2LNO完全转化成HNO3,至少应该通入空气的体积为
⑤将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M
(2)下列关于氮肥的使用说法正确的是___________。
| A.硝酸铵是一种常用的氮肥,在贮存和使用该化肥时不能剧烈撞击 |
| B.过度使用氮肥不会引起土壤和水体污染 |
| C.铵态氮肥和草木灰混合使用可以增强肥效 |
| D.铵态氮肥易与空气反应,因此需要深埋土壤中施用 |
您最近一年使用:0次
名校
解题方法
5 . 材料是人类赖以生存的重要物质基础。材料种类很多,通常可分为金属材料、无机非金属材料、高分子合成材料及复合材料。
(1)合金是被广泛应用的金属材料。
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点_______ (填“高”或者“低”)。
②下列有关合金性质的说法不正确的是_______ (填字母)。
A.生铁和钢都属于铁碳合金,生铁的含碳量更高
B.不锈钢是在碳素钢中加入其他合金元素,改变钢的结构使其具有耐腐蚀性
C.硬铝的强度比纯铝小但耐腐蚀,可用于制造宇宙飞船等
D.储氢合金可有效解决氢能源的安全存储和运输等问题
E.铁在地壳中的含量比铜丰富,所以人类发展经历了从石器时代到铁器时代,再到青铜器时代
F.稀土元素被称为“冶金工业的维生素”,在合金中加入适量稀土金属,能大大改善合金的性能
(2)镁、铝、铁的单质及其化合物在生产和生活中有广泛的用途。回答下列问题:
①铁元素的常见化合价有 和
和 价,
价,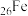 元素有
元素有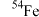 、
、 、
、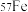 、
、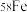 四种核素,它们互为
四种核素,它们互为_______ 。
② 、
、 、
、 、
、 、
、 (过氧化镁)中,属于碱性氧化物的有
(过氧化镁)中,属于碱性氧化物的有_______ 。
③纳米铁粉可以高效地去除被污染水体中的 等重金属离子,其本质是
等重金属离子,其本质是_______ (用离子方程式表示)。
④纳米铁粉还可用于处理含氧酸性废水中的 ,反应原理如图所示。
,反应原理如图所示。

该过程中体现了纳米铁粉的_______ 性(填“氧化”或“还原”);在铁粉总量一定的条件下,废水中的溶解氧过多不利于 的去除,原因是
的去除,原因是_______ 。
(1)合金是被广泛应用的金属材料。
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点
②下列有关合金性质的说法不正确的是
A.生铁和钢都属于铁碳合金,生铁的含碳量更高
B.不锈钢是在碳素钢中加入其他合金元素,改变钢的结构使其具有耐腐蚀性
C.硬铝的强度比纯铝小但耐腐蚀,可用于制造宇宙飞船等
D.储氢合金可有效解决氢能源的安全存储和运输等问题
E.铁在地壳中的含量比铜丰富,所以人类发展经历了从石器时代到铁器时代,再到青铜器时代
F.稀土元素被称为“冶金工业的维生素”,在合金中加入适量稀土金属,能大大改善合金的性能
(2)镁、铝、铁的单质及其化合物在生产和生活中有广泛的用途。回答下列问题:
①铁元素的常见化合价有
 和
和 价,
价,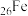 元素有
元素有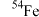 、
、 、
、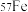 、
、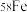 四种核素,它们互为
四种核素,它们互为②
 、
、 、
、 、
、 、
、 (过氧化镁)中,属于碱性氧化物的有
(过氧化镁)中,属于碱性氧化物的有③纳米铁粉可以高效地去除被污染水体中的
 等重金属离子,其本质是
等重金属离子,其本质是④纳米铁粉还可用于处理含氧酸性废水中的
 ,反应原理如图所示。
,反应原理如图所示。
该过程中体现了纳米铁粉的
 的去除,原因是
的去除,原因是
您最近一年使用:0次
2024-02-20更新
|
124次组卷
|
2卷引用:重庆市巴蜀中学校2023-2024学年高一上学期1月期末化学试题
名校
解题方法
6 . 将少量饱和 溶液分别滴加到下列物质中,得到三种不同的分散系,回答下列问题。
溶液分别滴加到下列物质中,得到三种不同的分散系,回答下列问题。
甲:将饱和 溶液滴加到冷水中。
溶液滴加到冷水中。
乙:将饱和 溶液滴加到NaOH溶液中。
溶液滴加到NaOH溶液中。
丙:将饱和 溶液滴加到沸水中。
溶液滴加到沸水中。
(1)甲属于_______ (填“溶液”或“胶体”或“浊液”),其颜色是_______ 。
(2)乙中分散质粒子直径范围是_______ 。
(3)将乙分散系过滤,向滤渣中加入盐酸,反应的离子方程式为_______ 。
(4)将丙继续加热煮沸得到红褐色透明液体,反应的离子方程式为_______ 。可以用简单的方法判断丙中是否成功制备胶体,该方法是_______ 。
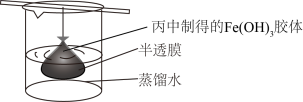
(5)可用如图所示的装置除去 胶体中的杂质离子来提纯
胶体中的杂质离子来提纯 胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入
胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入 溶液,若
溶液,若_______ (填实验现象),则说明该 胶体中的杂质离子已经完全除去。
胶体中的杂质离子已经完全除去。
 溶液分别滴加到下列物质中,得到三种不同的分散系,回答下列问题。
溶液分别滴加到下列物质中,得到三种不同的分散系,回答下列问题。甲:将饱和
 溶液滴加到冷水中。
溶液滴加到冷水中。乙:将饱和
 溶液滴加到NaOH溶液中。
溶液滴加到NaOH溶液中。丙:将饱和
 溶液滴加到沸水中。
溶液滴加到沸水中。(1)甲属于
(2)乙中分散质粒子直径范围是
(3)将乙分散系过滤,向滤渣中加入盐酸,反应的离子方程式为
(4)将丙继续加热煮沸得到红褐色透明液体,反应的离子方程式为
(5)可用如图所示的装置除去
 胶体中的杂质离子来提纯
胶体中的杂质离子来提纯 胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入
胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入 溶液,若
溶液,若 胶体中的杂质离子已经完全除去。
胶体中的杂质离子已经完全除去。
您最近一年使用:0次
名校
解题方法
7 . 填空题(共12分)
(1)室温下,将等体积的氨水与盐酸溶液混合后,若混合溶液中c( )=c(Cl-),则溶液中的pH值
)=c(Cl-),则溶液中的pH值____ 7(填“>”、“<”或“=”,下同),混合前c(NH3·H2O)_____ c(HCl)
(2)等浓度的NH4Cl和氨水溶液中,水电离出的H+浓度,前者______ 后者。
(3)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______ 。
(4)在配制硫化钠溶液时,为了抑制水解,可以加入少量的________ 。
(5)Na2SO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10−1),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液浓度为2×10−1 mol∙L−1,则生成沉淀所需CaCl2溶液的最小浓度为________ 。
(1)室温下,将等体积的氨水与盐酸溶液混合后,若混合溶液中c(
 )=c(Cl-),则溶液中的pH值
)=c(Cl-),则溶液中的pH值(2)等浓度的NH4Cl和氨水溶液中,水电离出的H+浓度,前者
(3)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(4)在配制硫化钠溶液时,为了抑制水解,可以加入少量的
(5)Na2SO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10−1),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液浓度为2×10−1 mol∙L−1,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
名校
解题方法
8 . 按要求填空:
(1)以下为中学化学中常见的几种物质:①二氧化碳 ②熔融 KCl ③NaHSO4固体④铜 ⑤稀硫酸 ⑥澄清石灰水,其中属于电解质的有_______ (填编号,下同),属于非电解质的 有_______ ,能导电的有_______ 。
(2)高铁酸钠(Na2FeO4)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O;该反应中氧化剂是_______ (用化学式表示,下同) ,_______ 元素被氧化,还原产物与氧化产物之比为_______ 。
(3)已知次磷酸(H3PO2)是一元弱酸,其与氢氧化钠溶液反应的离子方程式为_______ 。
(1)以下为中学化学中常见的几种物质:①二氧化碳 ②熔融 KCl ③NaHSO4固体④铜 ⑤稀硫酸 ⑥澄清石灰水,其中属于电解质的有
(2)高铁酸钠(Na2FeO4)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O;该反应中氧化剂是
(3)已知次磷酸(H3PO2)是一元弱酸,其与氢氧化钠溶液反应的离子方程式为
您最近一年使用:0次
解题方法
9 . 有个成语叫“物以类聚”,本意就是物质的分类。对物质进行分类,我们不仅能够根据类别通性预测物质的性质,还能探索各类物质的共性和特性。化学家根据需要将众多物质进行分类,现有下列几种物质:
①冰水混合物②N2③CO④ 胶体⑤Mg⑥熔融
胶体⑤Mg⑥熔融 ⑦漂白粉⑧乙醇⑨盐酸
⑦漂白粉⑧乙醇⑨盐酸
(1)以上物质属于能导电的化合物的是______ (填序号,下同);属于非电解质的是______ ;属于强电解质的是______ ;上述物质中弱电解质的电离方程式:______ 。
(2)写出实验室制取④的化学方程式:______ 。
(3)生活中“84”消毒液和洁厕灵(主要成分是⑨)不能混合使用,原因是______ (用离子方程式表示)。
(4)新型陶瓷氮化铝可用氧化铝高温还原法制备: (未配平),若反应中共转移
(未配平),若反应中共转移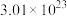 个电子,则产生
个电子,则产生 气体的物质的量为
气体的物质的量为______ mol。
①冰水混合物②N2③CO④
 胶体⑤Mg⑥熔融
胶体⑤Mg⑥熔融 ⑦漂白粉⑧乙醇⑨盐酸
⑦漂白粉⑧乙醇⑨盐酸(1)以上物质属于能导电的化合物的是
(2)写出实验室制取④的化学方程式:
(3)生活中“84”消毒液和洁厕灵(主要成分是⑨)不能混合使用,原因是
(4)新型陶瓷氮化铝可用氧化铝高温还原法制备:
 (未配平),若反应中共转移
(未配平),若反应中共转移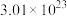 个电子,则产生
个电子,则产生 气体的物质的量为
气体的物质的量为
您最近一年使用:0次
名校
10 . 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+ 6CO(g)。
Si3N4(s)+ 6CO(g)。
(1)该反应的氧化剂是________ ,该反应的平衡常数表达式为K=________ 。
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率 与时间t的关系如图。
与时间t的关系如图。
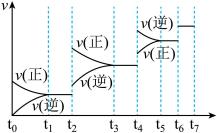
若t2时改变的条件为加热,则此反应的反应热ΔH______ 0(填“>”、“<”或“=”);降低温度,其平衡常数值_______ (填“增大”、“减小”或“不变”);
(3)t4时引起平衡移动的条件可能是_______ ;图中表示平衡混合物中CO的含量最高的时间段是______ 。
(4)若该反应的平衡常数为 K=729,则在同温度下1L固定密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是_______ (提示:272 = 729);若平衡后再向此容器中加入3molN2,N2的转化率将______ (填“增大”、“减小”或“不变”)。
 Si3N4(s)+ 6CO(g)。
Si3N4(s)+ 6CO(g)。(1)该反应的氧化剂是
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率
 与时间t的关系如图。
与时间t的关系如图。
若t2时改变的条件为加热,则此反应的反应热ΔH
(3)t4时引起平衡移动的条件可能是
(4)若该反应的平衡常数为 K=729,则在同温度下1L固定密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是
您最近一年使用:0次



