1 . 研究铁及其化合物的性质与转化关系是中学化学重要的学习内容。回答下列问题:
(1)人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是 )作用下转化成亚铁盐。写出该反应的离子方程式:
)作用下转化成亚铁盐。写出该反应的离子方程式:_______ 。
(2)高铁酸钠 是一种新型绿色消毒剂,主要用于饮用水处理,工业上常用向
是一种新型绿色消毒剂,主要用于饮用水处理,工业上常用向 和
和 混合溶液中滴加
混合溶液中滴加 溶液的方法制备
溶液的方法制备 ,反应中氧化剂与还原剂物质的量之比为
,反应中氧化剂与还原剂物质的量之比为_______ ,制备 转移的电子数目为
转移的电子数目为_______ 。
(3)某兴趣小组通过下列实验探究 、
、 的性质。
的性质。
已知: 可与
可与 溶液反应生成蓝色沉淀。
溶液反应生成蓝色沉淀。
①甲组同学得出结论“ 可将
可将 氧化”,其反应的离子方程式为
氧化”,其反应的离子方程式为_______ ;同学们认为甲组实验不够严谨,改进了实验:用煮沸冷却后的水配制溶液,向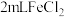 溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴
溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴 溶液,溶液变红,证明了结论正确,煮沸的作用是
溶液,溶液变红,证明了结论正确,煮沸的作用是_______ 。
②其他组同学认为乙组的实验同样不够严谨,可能是_______ 使溶液紫色褪去。请设计补充实验:取a溶液少许,滴加_______ ,若出现_______ ,则结论正确。
(1)人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是
 )作用下转化成亚铁盐。写出该反应的离子方程式:
)作用下转化成亚铁盐。写出该反应的离子方程式:(2)高铁酸钠
 是一种新型绿色消毒剂,主要用于饮用水处理,工业上常用向
是一种新型绿色消毒剂,主要用于饮用水处理,工业上常用向 和
和 混合溶液中滴加
混合溶液中滴加 溶液的方法制备
溶液的方法制备 ,反应中氧化剂与还原剂物质的量之比为
,反应中氧化剂与还原剂物质的量之比为 转移的电子数目为
转移的电子数目为(3)某兴趣小组通过下列实验探究
 、
、 的性质。
的性质。已知:
 可与
可与 溶液反应生成蓝色沉淀。
溶液反应生成蓝色沉淀。| 实验操作 | 实验现象 | 得出结论 | |
| 甲组 | 向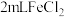 溶液中加入几滴氯水,再加入1滴 溶液中加入几滴氯水,再加入1滴 溶液 溶液 | 溶液变红 |  可将 可将 氧化 氧化 |
| 乙组 | 取一定量 溶液于试管中,加入维生素C片,振荡溶解得到溶液a.取a溶液少许,滴加酸性 溶液于试管中,加入维生素C片,振荡溶解得到溶液a.取a溶液少许,滴加酸性 溶液 溶液 | 紫色褪去 | 维生素C可将 还原为 还原为 |
 可将
可将 氧化”,其反应的离子方程式为
氧化”,其反应的离子方程式为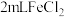 溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴
溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴 溶液,溶液变红,证明了结论正确,煮沸的作用是
溶液,溶液变红,证明了结论正确,煮沸的作用是②其他组同学认为乙组的实验同样不够严谨,可能是
您最近一年使用:0次
7日内更新
|
23次组卷
|
2卷引用:广东省肇庆市2023-2024学年高一上学期期末教学质量检测化学试卷
2 . 如图是8种元素在元素周期表中的位置,回答下列问题:________ 、________ 。
(2)写出元素②的简单阴离子的结构示意图:________ 。
(3)①、④、⑤、⑥的最高价氧化物对应的水化物中,碱性最强的是________ (填化学式),该化合物中所含的化学键类型有________ 。
(4)元素③、⑥、⑦的简单离子半径由大到小的顺序是________ (用离子符号表示)。
(5)写出元素④的最高价氧化物对应的水化物的水溶液与元素⑥的单质反应的离子方程式:________________ 。
(6)锗为第四周期与硅同主族,根据元素周期律推测其单质、化合物的性质正确的是________(填字母)。
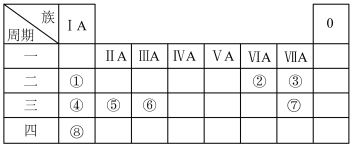
(2)写出元素②的简单阴离子的结构示意图:
(3)①、④、⑤、⑥的最高价氧化物对应的水化物中,碱性最强的是
(4)元素③、⑥、⑦的简单离子半径由大到小的顺序是
(5)写出元素④的最高价氧化物对应的水化物的水溶液与元素⑥的单质反应的离子方程式:
(6)锗为第四周期与硅同主族,根据元素周期律推测其单质、化合物的性质正确的是________(填字母)。
| A.锗的非金属性比②弱 | B.锗的原子半径比⑧大 |
| C.储的单质可用作半导体材料 | D.锗的最高正价为 价 价 |
您最近一年使用:0次
3 . Ⅰ.单质到盐的转化关系可表示为: (单质)
(单质)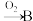 (氧化物)
(氧化物)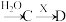 (盐)。
(盐)。
(1)若 是碳单质,则
是碳单质,则 的水溶液呈
的水溶液呈________ (填“酸”“碱”或“中”)性。
(2)若 的转化可用于工业制漂白粉,则反应的化学方程式为
的转化可用于工业制漂白粉,则反应的化学方程式为________________ 。
(3)若 是一种淡黄色固体,
是一种淡黄色固体, 是
是 ,则
,则 的用途是
的用途是________ (举一例), 的化学式可能是
的化学式可能是________ 。
Ⅱ.某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(假设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制 溶液;
溶液;
②配制 稀盐酸;
稀盐酸;
③向一粒研碎后的药片 中加入
中加入 ,蒸馏水充分溶解,再加
,蒸馏水充分溶解,再加 稀盐酸;
稀盐酸;
④用 溶液中和过量的稀盐酸,记录所消耗的
溶液中和过量的稀盐酸,记录所消耗的 溶液的体积;
溶液的体积;
⑤再重复上述操作③④三次。
(4)完成上述操作①所需要的仪器除容量瓶、量筒外还需要________ (填字母)。
(5)下列操作会使配制的氢氧化钠溶液浓度偏高的是________(填字母)。
(6)实验室现有 四种规格的容量瓶,则配制稀盐酸应选用的容量瓶的规格为
四种规格的容量瓶,则配制稀盐酸应选用的容量瓶的规格为________ 。
(7)某同学测定消耗的 溶液体积如下,计算这种药片中碳酸钙的质量分数为
溶液体积如下,计算这种药片中碳酸钙的质量分数为________ (保留整数)。
 (单质)
(单质)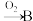 (氧化物)
(氧化物)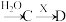 (盐)。
(盐)。(1)若
 是碳单质,则
是碳单质,则 的水溶液呈
的水溶液呈(2)若
 的转化可用于工业制漂白粉,则反应的化学方程式为
的转化可用于工业制漂白粉,则反应的化学方程式为(3)若
 是一种淡黄色固体,
是一种淡黄色固体, 是
是 ,则
,则 的用途是
的用途是 的化学式可能是
的化学式可能是Ⅱ.某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(假设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制
 溶液;
溶液;②配制
 稀盐酸;
稀盐酸;③向一粒研碎后的药片
 中加入
中加入 ,蒸馏水充分溶解,再加
,蒸馏水充分溶解,再加 稀盐酸;
稀盐酸;④用
 溶液中和过量的稀盐酸,记录所消耗的
溶液中和过量的稀盐酸,记录所消耗的 溶液的体积;
溶液的体积;⑤再重复上述操作③④三次。
(4)完成上述操作①所需要的仪器除容量瓶、量筒外还需要
| 序号 | a | b | c | d | e | f | g |
| 仪器 |
|
|
|
|
|
|
|
(5)下列操作会使配制的氢氧化钠溶液浓度偏高的是________(填字母)。
| A.用称量纸称量NaOH固体 |
| B.转移浓NaOH溶液到容量瓶后未洗涤烧杯、玻璃棒 |
| C.容量瓶底部有少量水 |
| D.定容时俯视容量瓶刻线 |
(6)实验室现有
 四种规格的容量瓶,则配制稀盐酸应选用的容量瓶的规格为
四种规格的容量瓶,则配制稀盐酸应选用的容量瓶的规格为(7)某同学测定消耗的
 溶液体积如下,计算这种药片中碳酸钙的质量分数为
溶液体积如下,计算这种药片中碳酸钙的质量分数为| 测定次数 | 第1次 | 第2次 | 第3次 |
V[ 溶液] 溶液] | 13.00 | 12.90 | 13.10 |
您最近一年使用:0次
名校
解题方法
4 . 已知i.2CO(g)+O2(g)=2CO2(g) ΔH1=﹣566.0kJ•mol﹣1;
ⅱ.2H2(g)+O2(g)=2H2O(l) ΔH2=﹣483.6 kJ•mol﹣1;
ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=﹣574.4 kJ•mol﹣1;
写出CH3OH燃烧热的热化学方程式:___________ 。
ⅱ.2H2(g)+O2(g)=2H2O(l) ΔH2=﹣483.6 kJ•mol﹣1;
ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=﹣574.4 kJ•mol﹣1;
写出CH3OH燃烧热的热化学方程式:
您最近一年使用:0次
名校
5 . 现有下列十种物质:
①铝;②NaCl;③CO2;④H2SO4;⑤Ba(OH)2;⑥氨水;⑦红褐色的氢氧化铁胶体;⑧盐酸;⑨CaCO3;⑩蔗糖
(1)按物质的树状分类法填写表格的空白处:
(2)写出⑤的电离方程式___________ 。
(3)上述十种物质中,有两种物质之间可发生H++OH-=H2O,该离子反应对应的化学方程式为___________ 。
(4)写出制备⑦的化学方程式:___________ 。
①铝;②NaCl;③CO2;④H2SO4;⑤Ba(OH)2;⑥氨水;⑦红褐色的氢氧化铁胶体;⑧盐酸;⑨CaCO3;⑩蔗糖
(1)按物质的树状分类法填写表格的空白处:
| 类别 | 金属单质 | 氧化物 | 电解质 | 非电解质 | |
| 属于该类的物质(填标号) | ① | ⑥⑧ |
(3)上述十种物质中,有两种物质之间可发生H++OH-=H2O,该离子反应对应的化学方程式为
(4)写出制备⑦的化学方程式:
您最近一年使用:0次
解题方法
6 . 写出下列反应的离子反应方程式。
(1)氧化铜与硫酸反应:___________ ;
(2)铁与稀盐酸反应:___________ ;
(3)氯气与NaOH溶液反应:___________ ;
(4)过氧化钠与水反应:___________ ;
(5)氢氧化钡溶液与稀硫酸反应:___________ ;
(6)二氧化氮通入水中反应:___________ ;
(7)稀硝酸与Cu的反应:___________ 。
(1)氧化铜与硫酸反应:
(2)铁与稀盐酸反应:
(3)氯气与NaOH溶液反应:
(4)过氧化钠与水反应:
(5)氢氧化钡溶液与稀硫酸反应:
(6)二氧化氮通入水中反应:
(7)稀硝酸与Cu的反应:
您最近一年使用:0次
解题方法
7 . 如表是 25℃时某些弱酸的电离平衡常数。
(1)25℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,用离子方程式解释其主要原因_______ 。
(2)pH相同的NaC1O和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK_______ NaC1O,两溶液中:[c(Na+)-c(ClO-)]_______ [c(K+)-c(CH3COO-)](填“>”“<” 或“=”)。
(3)25℃时,向0.1mol·L-1CH3COOH 溶液中滴加 NaOH 溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的 pH=_______ 。
(4)H2CO3与含等物质的量的 KOH 的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序_______ 。
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(2)pH相同的NaC1O和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK
(3)25℃时,向0.1mol·L-1CH3COOH 溶液中滴加 NaOH 溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的 pH=
(4)H2CO3与含等物质的量的 KOH 的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序
您最近一年使用:0次
8 . I.已知:①H₂O(g)=H₂(g)+ O₂(g) ΔH =+241.8kJ/mol
O₂(g) ΔH =+241.8kJ/mol
②C(s)+ O₂(g) =CO(g) ΔH =-110.5kJ/mol
O₂(g) =CO(g) ΔH =-110.5kJ/mol
③C(s)+O₂(g)=CO₂(g) ΔH=-393.5kJ/mol
请填写下列空白。
(1)上述反应中属于吸热反应的是_________ (填号)。
(2)表示C燃烧的热化学方程式为_______ (填号)
(3)10g H₂完全燃烧生成水蒸气,放出的热量为____________ .
(4)比较②的ΔH_____ ③的ΔH大小 (填“大于”“等于”或“小于”)。
Ⅱ.如图所示,某反应在不同条件下的反应历程分别为a、b。_______ (填“>“<”或”=”)生成物的总键能,则该反应的反应热ΔH=_______________ (用E1,E2表示)。
 O₂(g) ΔH =+241.8kJ/mol
O₂(g) ΔH =+241.8kJ/mol②C(s)+
 O₂(g) =CO(g) ΔH =-110.5kJ/mol
O₂(g) =CO(g) ΔH =-110.5kJ/mol ③C(s)+O₂(g)=CO₂(g) ΔH=-393.5kJ/mol
请填写下列空白。
(1)上述反应中属于吸热反应的是
(2)表示C燃烧的热化学方程式为
(3)10g H₂完全燃烧生成水蒸气,放出的热量为
(4)比较②的ΔH
Ⅱ.如图所示,某反应在不同条件下的反应历程分别为a、b。
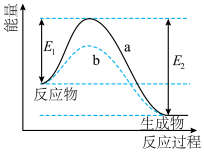
您最近一年使用:0次
9 . 写出下列有关的化学方程式:
(1)碳酸钙和醋酸溶液反应:___________ ;
(2)硫酸铁和氢氧化钡溶液反应:___________ ;
(3)硫酸铜溶液和铁反应:___________ ;
(4)氯化钡溶液和碳酸钠溶液反应:___________ 。
(1)碳酸钙和醋酸溶液反应:
(2)硫酸铁和氢氧化钡溶液反应:
(3)硫酸铜溶液和铁反应:
(4)氯化钡溶液和碳酸钠溶液反应:
您最近一年使用:0次
解题方法
10 . 按要求完成下列填空:
(1)AlCl3溶液蒸干并灼烧得到的物质是__________ (填化学式)。
(2)泡沫灭火器灭火时发生反应的离子方程式__________ 。
(3)已知25℃时,Ksp[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol•L﹣1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于__________ 。
(1)AlCl3溶液蒸干并灼烧得到的物质是
(2)泡沫灭火器灭火时发生反应的离子方程式
(3)已知25℃时,Ksp[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol•L﹣1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于
您最近一年使用:0次