2025高三上·全国·专题练习
1 . 某消毒小组人员用18.4mol•L-1的浓硫酸配制500mL0.1mol•L-1的稀硫酸用于84消毒液消毒能力的实验探究,在配制过程中,下列操作中能使所配溶液的浓度偏低的有___________ (填代号)。
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④转移过程中,有少量液体溅出
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④转移过程中,有少量液体溅出
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
您最近一年使用:0次
2025高三·全国·专题练习
解题方法
2 . 请回答下列问题:
(1)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质:
铬铁矿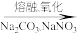 熔块
熔块
该步骤的主要反应为FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2↑+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为
Na2CrO4+Fe2O3+CO2↑+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为___________ 。
(2)酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)。配平该反应的方程式,其化学计量数依次为___________ 。
(1)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质:
铬铁矿
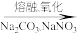 熔块
熔块该步骤的主要反应为FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+Fe2O3+CO2↑+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为
Na2CrO4+Fe2O3+CO2↑+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为(2)酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)。配平该反应的方程式,其化学计量数依次为
您最近一年使用:0次
23-24高一下·全国·期末
3 . 回答下列问题:
(1)用20% H2SO4浸取软锰矿(主要成分为MnO2、SiO2等)制备高纯MnO2,酸浸时,通常加入FeSO4作催化剂加快反应速率。为提高酸浸速率,还可以采取的措施有______________ (写一种)。
(2)工业上用稀硫酸浸取碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)生产锰酸锂(LiMn2O4),为了提高碳酸锰矿浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_______________ 等。
(3)用NaOH熔盐高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)制备白色颜料TiO2,为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是________________ 。
(1)用20% H2SO4浸取软锰矿(主要成分为MnO2、SiO2等)制备高纯MnO2,酸浸时,通常加入FeSO4作催化剂加快反应速率。为提高酸浸速率,还可以采取的措施有
(2)工业上用稀硫酸浸取碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)生产锰酸锂(LiMn2O4),为了提高碳酸锰矿浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③
(3)用NaOH熔盐高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)制备白色颜料TiO2,为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是
您最近一年使用:0次
23-24高一下·全国·课前预习
解题方法
4 . “乙醇燃料电池”的工作原理为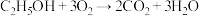 ,装置如图所示。
,装置如图所示。 的移动方向为由
的移动方向为由_______ (填“A到B”或“B到A”)。写出A电极的电极反应式:_____________ 。
②若标况下有11.2L 参与反应,理论上通过质子交换膜的
参与反应,理论上通过质子交换膜的 数目为
数目为_______ 。
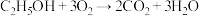 ,装置如图所示。
,装置如图所示。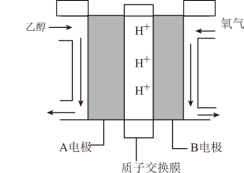
 的移动方向为由
的移动方向为由②若标况下有11.2L
 参与反应,理论上通过质子交换膜的
参与反应,理论上通过质子交换膜的 数目为
数目为
您最近一年使用:0次
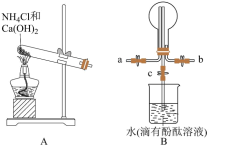
5 . 某化学实验小组同学利用如图所示装置制备氨气,并探究氨气的性质(部分仪器已略去)。___________ ;干燥氨气常用的干燥剂是___________ 。
(2)收集氨气时,请你选择氨气的进气口___________ (填“a”或“b”),理由是___________ 。
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是___________ 。
(2)收集氨气时,请你选择氨气的进气口
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是
您最近一年使用:0次
2024-05-21更新
|
156次组卷
|
2卷引用:名校期末好题汇编-非金属元素(非选择题)
6 . 阅读下列材料,按要求回答问题。
材料1 酒精、苯、CCl4都是有机溶剂,有机溶剂之间大多能互溶;
材料2 碘(I2)易溶于有机溶剂;
材料3 溴微溶于水,易溶于有机溶剂,其溶液呈橙红色。
在酒精、苯、CCl4、蒸馏水四种试剂中:
(1)能把碘单质从碘水中萃取出来的是___________ ,进行分液之后___________ (填“能”或“不能”)得到纯净的碘单质。
(2)能把溴从溴水中萃取出来,并在分液时使含溴液体从分液漏斗下口流出的是___________ 。
(3)CCl4___________ (填“能”或“不能”)把碘酒中的碘萃取出来,原因是___________ 。
材料1 酒精、苯、CCl4都是有机溶剂,有机溶剂之间大多能互溶;
材料2 碘(I2)易溶于有机溶剂;
材料3 溴微溶于水,易溶于有机溶剂,其溶液呈橙红色。
在酒精、苯、CCl4、蒸馏水四种试剂中:
(1)能把碘单质从碘水中萃取出来的是
(2)能把溴从溴水中萃取出来,并在分液时使含溴液体从分液漏斗下口流出的是
(3)CCl4
您最近一年使用:0次
7 . 价类二维图是学习和研究物质转化及其性质的有效方法,如图是氮元素的价类二维图。回答下列问题:_______ ,B_______ 。
(2)从N元素的化合价分析,N2具有氧化性和还原性,请写出N2还原性化学方程式:_______ 。
(3)写出铜与硝酸反应生成物质A的离子方程式_______ 。
(4)HNO3与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为_______ 。
(5)物质D是一种重要的氮肥,写出检验D的阳离子的方法_______ 。

(2)从N元素的化合价分析,N2具有氧化性和还原性,请写出N2还原性化学方程式:
(3)写出铜与硝酸反应生成物质A的离子方程式
(4)HNO3与图中的物质C常用于检验
 的存在,则C的化学式为
的存在,则C的化学式为(5)物质D是一种重要的氮肥,写出检验D的阳离子的方法
您最近一年使用:0次
2024-05-08更新
|
135次组卷
|
2卷引用:名校期末好题汇编-非金属元素(非选择题)
21-22高一下·全国·单元测试
解题方法
8 . 氨气( )
)
(1)分子结构:由极性键形成的_______ 形的极性分子,N原子有一孤对电子;N为_______ 价,为N元素的最低价态;
(2)物理性质:_______ 气味的气体,密度比空气_______ ,_______ 溶于水,常温常压下1体积水能溶解_______ 体积的氨气,易_______ ;
(3)化学性质:
①与 反应:
反应:_______ ,溶液呈弱碱性,氨水的成分为:_______ ;氨水易_______ ;
②与酸反应:硫酸_______ ,盐酸_______ (有白烟生成);
③还原性(催化氧化):_______ (N为 价,最低价态,具有还原性);
价,最低价态,具有还原性);
(4)实验室制法_______ ;工业上采取 与
与 在高温高压催化剂条件下合成氨气;
在高温高压催化剂条件下合成氨气;
(5)用途:化工原料,制硝酸、氮肥等,做_______ 剂。
 )
)(1)分子结构:由极性键形成的
(2)物理性质:
(3)化学性质:
①与
 反应:
反应:②与酸反应:硫酸
③还原性(催化氧化):
 价,最低价态,具有还原性);
价,最低价态,具有还原性);(4)实验室制法
 与
与 在高温高压催化剂条件下合成氨气;
在高温高压催化剂条件下合成氨气;(5)用途:化工原料,制硝酸、氮肥等,做
您最近一年使用:0次
21-22高一下·全国·单元测试
解题方法
9 . 无机非金属材料
(1)传统无机非金属材料_______ 。
(2)传统的硅酸盐材料有什么优、缺点?
优点:抗_______ 、耐_______ ;
缺点:质_______ 、经不起热冲击。
(3)新型无机非金属材料_______ 。
(4)新型无机非金属材料有哪些特性?
①_______ 。
②具有_______ 特性。
③具有_______ 特性。
④具有生物功能
(1)传统无机非金属材料
(2)传统的硅酸盐材料有什么优、缺点?
优点:抗
缺点:质
(3)新型无机非金属材料
(4)新型无机非金属材料有哪些特性?
①
②具有
③具有
④具有生物功能
您最近一年使用:0次
21-22高一下·全国·单元测试
解题方法
10 . 1.氮的氧化物
(1)氮的氧化物
简介:氮元素有_______ 五种正价态,对应有六种氧化物
(2)NO和 的重要性质和制法(横线部分书写化学方程式)
的重要性质和制法(横线部分书写化学方程式)
①性质:_______ (易被氧气氧化,无色气体转化为红棕色);
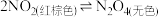 (平衡体系);
(平衡体系);
_______ (工业制硝酸);
_______ (尾气吸收);
 有较强的氧化性,能使湿润的KI淀粉试纸
有较强的氧化性,能使湿润的KI淀粉试纸_______ 。
②制法:
NO: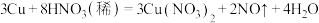 (必须
(必须_______ 法收集NO);
 :
: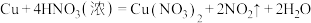 (必须
(必须_______ 法收集 )
)
(3)氮的氧化物溶于水的计算
① 或
或 与
与 (非
(非 )的混合气体溶于水可依据
)的混合气体溶于水可依据 利用气体体积变化差值进行计算。
利用气体体积变化差值进行计算。
② 和O2的混合气体溶于水时,由
和O2的混合气体溶于水时,由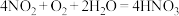 进行计算,当体积比
进行计算,当体积比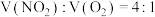 时,恰好反应;
时,恰好反应; 时,
时, 过量,剩余NO;
过量,剩余NO; 时,
时, 过量,剩余
过量,剩余 。
。
③NO和 同时通入水中时,由
同时通入水中时,由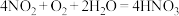 进行计算,原理同②。
进行计算,原理同②。
④NO、 、
、 的混合气体通入水中,先按①求出NO的体积,再加上混合气体中NO的体积再按③方法进行计算。
的混合气体通入水中,先按①求出NO的体积,再加上混合气体中NO的体积再按③方法进行计算。
(1)氮的氧化物
简介:氮元素有
| 种类 | 色态 | 化学性质 |
 | 无色气体 | 较不活泼 |
| NO | 活泼,不溶于水 | |
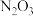 (亚硝酸酐) (亚硝酸酐) | 蓝色液体(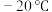 ) ) | 常温极易分解为NO, |
 | 较活泼,与水反应 | |
 | 无色气体 | 较活泼,受热易分解 |
 (硝酸酸酐) (硝酸酸酐) | 无色固体 | 气态时不稳定,易分解 |
 的重要性质和制法(横线部分书写化学方程式)
的重要性质和制法(横线部分书写化学方程式)①性质:
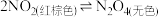 (平衡体系);
(平衡体系); 有较强的氧化性,能使湿润的KI淀粉试纸
有较强的氧化性,能使湿润的KI淀粉试纸②制法:
NO:
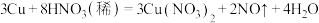 (必须
(必须 :
: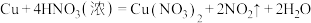 (必须
(必须 )
)(3)氮的氧化物溶于水的计算
①
 或
或 与
与 (非
(非 )的混合气体溶于水可依据
)的混合气体溶于水可依据 利用气体体积变化差值进行计算。
利用气体体积变化差值进行计算。②
 和O2的混合气体溶于水时,由
和O2的混合气体溶于水时,由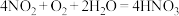 进行计算,当体积比
进行计算,当体积比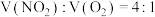 时,恰好反应;
时,恰好反应; 时,
时, 过量,剩余NO;
过量,剩余NO; 时,
时, 过量,剩余
过量,剩余 。
。③NO和
 同时通入水中时,由
同时通入水中时,由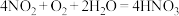 进行计算,原理同②。
进行计算,原理同②。④NO、
 、
、 的混合气体通入水中,先按①求出NO的体积,再加上混合气体中NO的体积再按③方法进行计算。
的混合气体通入水中,先按①求出NO的体积,再加上混合气体中NO的体积再按③方法进行计算。
您最近一年使用:0次



