名校
解题方法
1 . I.某有机物M分子的结构式如图所示:
(1)写出M的结构简式和键线式:___________ 、___________ 。
(2)下列给出了四种有机物的结构简式:A.HOCH2CH2CH=CH2;B.CH3OCH2CH=CH2;C.CH3CH2CH2CHO;D.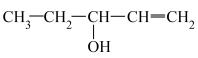 ;E.
;E. ;
;
与M属于同系物的是___________ (填选项字母,下同),互为同分异构体且官能团种类不同的是___________ ,互为同分异构体且官能团种类相同的是___________ 。
Ⅱ.利用核磁共振技术测定有机物分子三维结构的研究获得了2002年诺贝尔化学奖。某研究小组为测定某有机化合物A的结构,进行如下实验:
(3)①将有机物A置于氧气流中充分燃烧,实验测得:生成18.0gH2O和44.0gCO2,消耗氧气28.0L(标准状况),则该物质的实验式是___________ 。
②使用现代分析仪器对有机化合物A的分子结构进行测定,相关结果如图所示:___________ ,根据图2、图3(只有一组吸收峰)推测:A的结构简式为___________ (分子中有1个六元环)。
③写出化合物A属于酯类的同分异构体的结构简式:___________ (任写一种即可)。

(1)写出M的结构简式和键线式:
(2)下列给出了四种有机物的结构简式:A.HOCH2CH2CH=CH2;B.CH3OCH2CH=CH2;C.CH3CH2CH2CHO;D.
 ;E.
;E. ;
;与M属于同系物的是
Ⅱ.利用核磁共振技术测定有机物分子三维结构的研究获得了2002年诺贝尔化学奖。某研究小组为测定某有机化合物A的结构,进行如下实验:
(3)①将有机物A置于氧气流中充分燃烧,实验测得:生成18.0gH2O和44.0gCO2,消耗氧气28.0L(标准状况),则该物质的实验式是
②使用现代分析仪器对有机化合物A的分子结构进行测定,相关结果如图所示:
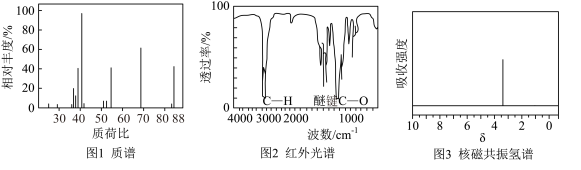
③写出化合物A属于酯类的同分异构体的结构简式:
您最近一年使用:0次
名校
2 . 化学电池的发明,是贮能和供能技术的巨大进步。
(1)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是___________ (填字母)。
A.锌锰电池工作一段时间后碳棒会变细
B.氢氧燃料电池可将化学能直接转变为电能
C.铅蓄电池负极是PbO2,正极是Pb
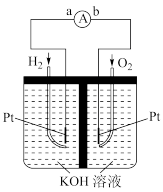
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。___________ (填“A”或“B”)电极入口通甲烷,其电极反应式为___________ 。工作一段时间后,电解质溶液的pH将___________ (填“变大”、“变小”或“不变”)。
(3)有人设想利用电化学原理除去SO2,并将化学能转化为电能。装置图如下。___________ 。(填“a”或“b”)
②写出a电极的电极反应___________ 。
(4)某同学欲把反应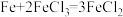 设计成原电池,请画出简易的原电池装置图
设计成原电池,请画出简易的原电池装置图________ 。
(1)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是
A.锌锰电池工作一段时间后碳棒会变细
B.氢氧燃料电池可将化学能直接转变为电能
C.铅蓄电池负极是PbO2,正极是Pb
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
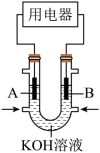
(3)有人设想利用电化学原理除去SO2,并将化学能转化为电能。装置图如下。

②写出a电极的电极反应
(4)某同学欲把反应
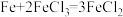 设计成原电池,请画出简易的原电池装置图
设计成原电池,请画出简易的原电池装置图
您最近一年使用:0次
名校
3 . 根据已学知识,请回答下列问题
(1)物质A的结构简式为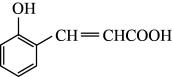 ,写出A中的含氧官能团名称
,写出A中的含氧官能团名称_____________________________ 。
(2)有机化合物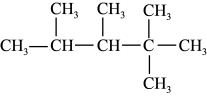 的名称是
的名称是_________________ ,其在核磁共振氢谱上有_________ 组峰。
(3)键线式 表示的有机物的分子式为
表示的有机物的分子式为 _________ ,其中等效氢个数比为_________________ 。
(4)写出1,3一丁二烯与 发生1,4-加成的反应方程式:
发生1,4-加成的反应方程式:_________________________________________________ 。
(5)与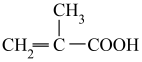 具有相同官能团的一种同分异构体的结构简式为
具有相同官能团的一种同分异构体的结构简式为_____________________ 。
(1)物质A的结构简式为
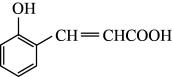 ,写出A中的含氧官能团名称
,写出A中的含氧官能团名称(2)有机化合物
 的名称是
的名称是(3)键线式
 表示的有机物的分子式为
表示的有机物的分子式为 (4)写出1,3一丁二烯与
 发生1,4-加成的反应方程式:
发生1,4-加成的反应方程式:(5)与
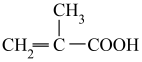 具有相同官能团的一种同分异构体的结构简式为
具有相同官能团的一种同分异构体的结构简式为
您最近一年使用:0次
名校
4 . 工业制硫酸的反应之一为:2SO2(g)+O2(g) 2SO3(g),在2L恒容绝热密闭容器中投入2molSO2和适当过量的O2,在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。
2SO3(g),在2L恒容绝热密闭容器中投入2molSO2和适当过量的O2,在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。_______ (填“是”或“否”),25 min时,v(正)_______ v(逆) (填“>”、“<”或“=”)。
(2)10min内,O2的反应速率为_______ ;平衡时SO2的转化率为_______ 。
(3)下列叙述不能 判断该反应达到平衡状态的是_______;
(4)在密闭容器里,通入a mol SO2 (g)、b mol O2 (g)、c mol SO3 (g),发生上述反应,当改变某种条件时,反应速率会减小的是 _______(填字母)。
 2SO3(g),在2L恒容绝热密闭容器中投入2molSO2和适当过量的O2,在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。
2SO3(g),在2L恒容绝热密闭容器中投入2molSO2和适当过量的O2,在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。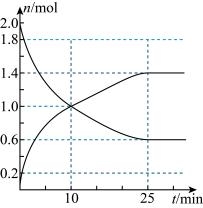
(2)10min内,O2的反应速率为
(3)下列叙述
| A.容器中压强不再改变 | B.容器中气体密度不再改变 |
| C.O2的物质的量浓度不再改变 | D.2V正(SO2)=V逆(O2) |
(4)在密闭容器里,通入a mol SO2 (g)、b mol O2 (g)、c mol SO3 (g),发生上述反应,当改变某种条件时,反应速率会减小的是 _______(填字母)。
| A.降低温度 | B.加入催化剂 | C.缩小容器体积 | D.恒容下,充入He |
您最近一年使用:0次
名校
5 . 铁及铁的化合物应用广泛。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式___________ 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图___________ ,标出电极名称及电极材料、电解质溶液、电流方向,并写出正极反应式___________ ,负极反应式___________ 。
(3)高铁酸钾(K2FeO4)是一种理想的水处理剂,目前高铁电池的研制正在进行中。如图甲所示是高铁电池的模拟实验装置。
①该电池放电时正极产生Fe(OH)3,正极电极反应为___________ 。
②电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择___________ 作为电解质。
③图乙为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___________ 。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图
(3)高铁酸钾(K2FeO4)是一种理想的水处理剂,目前高铁电池的研制正在进行中。如图甲所示是高铁电池的模拟实验装置。

①该电池放电时正极产生Fe(OH)3,正极电极反应为
②电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择
| 阳离子 | 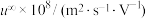 | 阴离子 | 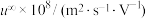 |
| Li+ | 4.07 |  | 4.61 |
| Na+ | 5.19 |  | 7.40 |
| K+ | 7.62 |  | 8.27 |
您最近一年使用:0次
名校
6 . Ⅰ.有如图所示各步变化(部分产物未写出),A为金属单质,B为淡黄色固体,物质A~E均含有钠元素。___________ ,D.___________ 。
(2)写出A→E的化学方程式并用双线桥标出电子转移的方向和数目:___________ 。
Ⅱ.完成下列问题
(3)+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。亚铁离子极不稳定,二价铁易被空气或Cl2___________ (填“氧化”或“还原”)成三价铁,请写出亚铁离子与Cl2反应的离子方程式:___________ 。
(4)某实验小组用“套管实验”来探究Na2CO3和NaHCO3的性质。___________ 。
②该实验可证明NaHCO3的热稳定性___________ (填“强于”“弱于”或“等于”)Na2CO3;___________ (填“能”或“不能”)将NaHCO3、Na2CO3的位置互换。
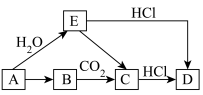
(2)写出A→E的化学方程式并用双线桥标出电子转移的方向和数目:
Ⅱ.完成下列问题
(3)+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。亚铁离子极不稳定,二价铁易被空气或Cl2
(4)某实验小组用“套管实验”来探究Na2CO3和NaHCO3的性质。
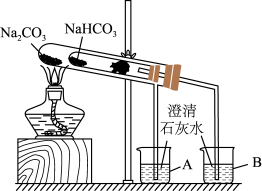
②该实验可证明NaHCO3的热稳定性
您最近一年使用:0次
名校
7 . 图所示为利用分类法对一组物质进行的分类。回答下列问题  属于
属于___________  填“酸性”或“碱性”
填“酸性”或“碱性” 氧化物,书写
氧化物,书写 与
与 反应的化学方程式
反应的化学方程式___________ ,依据该反应,可以说明
___________  填“属于”或“不属于”
填“属于”或“不属于” 碱性氧化物。
碱性氧化物。
(2)上述物质中属于电解质的是___________ 。
(3)某学生完成钠与水反应的实验,实验过程如图 、
、 、
、 所示,下列有关实验现象及结论的叙述
所示,下列有关实验现象及结论的叙述不正确 的是___________。 填序号
填序号
(4)工业上常用 与
与 溶液反应制取消毒液,该反应的化学方程式为
溶液反应制取消毒液,该反应的化学方程式为___________ 。
(5)向 溶液中加入NaOH溶液,对应的离子方程式为
溶液中加入NaOH溶液,对应的离子方程式为___________ 。
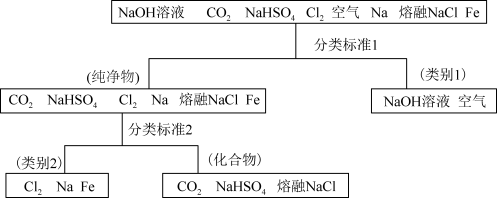
 属于
属于 填“酸性”或“碱性”
填“酸性”或“碱性” 氧化物,书写
氧化物,书写 与
与 反应的化学方程式
反应的化学方程式
 填“属于”或“不属于”
填“属于”或“不属于” 碱性氧化物。
碱性氧化物。(2)上述物质中属于电解质的是
(3)某学生完成钠与水反应的实验,实验过程如图
 、
、 、
、 所示,下列有关实验现象及结论的叙述
所示,下列有关实验现象及结论的叙述 填序号
填序号
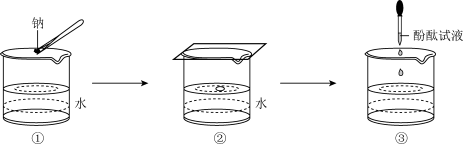
A.图 中钠熔成小球,说明钠与水反应放热且钠的熔点低 中钠熔成小球,说明钠与水反应放热且钠的熔点低 |
B.图 中钠四处游动并嘶嘶作响,说明反应产生了气体 中钠四处游动并嘶嘶作响,说明反应产生了气体 |
C.图 中滴加酚酞试液后溶液变红,说明有碱性物质生成 中滴加酚酞试液后溶液变红,说明有碱性物质生成 |
D.钠与水反应的离子方程式是: 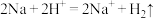 |
(4)工业上常用
 与
与 溶液反应制取消毒液,该反应的化学方程式为
溶液反应制取消毒液,该反应的化学方程式为(5)向
 溶液中加入NaOH溶液,对应的离子方程式为
溶液中加入NaOH溶液,对应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随能量变化,能量、速率与限度是认识和研究化学反应的重要视角。
(1)已知破坏1 mol H-H、1 mol O=O、1 mol H-O时分别需要吸收436 kJ、498 kJ、465kJ的能量。H2、O2转化为H2O(g)反应过程的能量变化如图,则b表示的能量为________ 。_______________________________ 。
②电池工作一段时间后电解质溶液的pH___________ (填“增大”“减小”或“不变”)。
(3)CO2可通过反应 转化成有机物,实现碳循环。一定条件下,在体积为2L的恒容密闭容器中,充入2mol CO2(g)和6mol H2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
转化成有机物,实现碳循环。一定条件下,在体积为2L的恒容密闭容器中,充入2mol CO2(g)和6mol H2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。___________ 。
a.气体密度不再改变
b.混合气体的平均相对分子质量不再改变
c.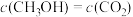
d.单位时间CO2和CH3OH(g)的消耗速率相等
②反应进行到3min时,正反应速率________ (填“>”“<”或“=”)逆反应速率。
③0 min~9 min 内,v(H2)=________ mol/(L·min)。
④平衡时CO2的转化率为________ 。
(1)已知破坏1 mol H-H、1 mol O=O、1 mol H-O时分别需要吸收436 kJ、498 kJ、465kJ的能量。H2、O2转化为H2O(g)反应过程的能量变化如图,则b表示的能量为
②电池工作一段时间后电解质溶液的pH
(3)CO2可通过反应
 转化成有机物,实现碳循环。一定条件下,在体积为2L的恒容密闭容器中,充入2mol CO2(g)和6mol H2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
转化成有机物,实现碳循环。一定条件下,在体积为2L的恒容密闭容器中,充入2mol CO2(g)和6mol H2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。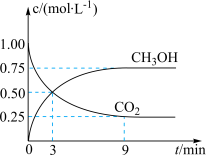
a.气体密度不再改变
b.混合气体的平均相对分子质量不再改变
c.
d.单位时间CO2和CH3OH(g)的消耗速率相等
②反应进行到3min时,正反应速率
③0 min~9 min 内,v(H2)=
④平衡时CO2的转化率为
您最近一年使用:0次
名校
9 . 氯气是现代工业和生活中常用的杀菌消毒剂。回答下列问题:
(1)实验室常用 固体和浓盐酸在加热条件下制取
固体和浓盐酸在加热条件下制取 ,反应的离子方程式为
,反应的离子方程式为___________ 。实验室还可用 固体和浓盐酸在室温条件下制取少量氯气(同时生成
固体和浓盐酸在室温条件下制取少量氯气(同时生成 和
和 ),可选用图中的
),可选用图中的___________ (选填“A”或“B”)作为发生装置,反应的离子方程式为___________ 。
(说明:试管中溶液均为 ,均滴入氯水5滴;淀粉遇
,均滴入氯水5滴;淀粉遇 变蓝)
变蓝)
①实验I中反应方程式为___________ ,由此推断氧化性:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
②实验Ⅱ中溶液变红是由于溶液中含有___________ (填微粒符号,下同);使溶液褪色的微粒是___________ 。
(1)实验室常用
 固体和浓盐酸在加热条件下制取
固体和浓盐酸在加热条件下制取 ,反应的离子方程式为
,反应的离子方程式为 固体和浓盐酸在室温条件下制取少量氯气(同时生成
固体和浓盐酸在室温条件下制取少量氯气(同时生成 和
和 ),可选用图中的
),可选用图中的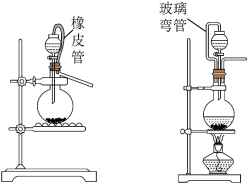
| 实验Ⅰ | 实验Ⅱ | |
| 实验操作 |
|
|
| 实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 |
 ,均滴入氯水5滴;淀粉遇
,均滴入氯水5滴;淀粉遇 变蓝)
变蓝)①实验I中反应方程式为

 (填“
(填“ ”或“
”或“ ”)。
”)。②实验Ⅱ中溶液变红是由于溶液中含有
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.硫酸是重要的化工原料,工业制硫酸的其中一步重要反应是2SO2+O2 2SO3,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
2SO3,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。___________ 。
(2)图中a点,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
(3)反应进行到第___________ 分钟时恰好达到平衡,结合图像分析,能说明SO2转化成SO3的反应在该条件下达到限度的证据是___________ 。
(4)下列说法错误的是___________。
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
(5)该实验目的是研究水果种类和___________ 对水果电池电流大小的影响。
(6)该实验装置中,正极的材料是___________ ,负极的电极反应式是___________ 。
 2SO3,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
2SO3,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。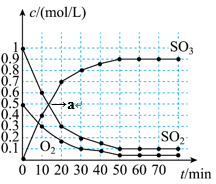
(2)图中a点,正反应速率
(3)反应进行到第
(4)下列说法错误的是___________。
| A.上述条件下,SO2不可能100%转化为SO3 |
| B.升高温度,可以实现SO2的完全转化 |
| C.通过调控反应条件,可以提高该反应进行的程度 |
| D.使用催化剂可以增大反应速率,提高生产效率 |
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
| 实验编号 | 水果种类 | 电极间距离/cm | 电流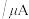 |
|
| 1 | 番茄 | 1 | 98.7 | |
| 2 | 番茄 | 2 | 72.5 | |
| 3 | 苹果 | 2 | 27.2 |
(6)该实验装置中,正极的材料是
您最近一年使用:0次