1 . 某温度下,在容积为 的密闭容器中发生M、N两种气体间的转化,M、N物质的量随时间变化的曲线如图所示。分析图中数据,回答下列问题。
的密闭容器中发生M、N两种气体间的转化,M、N物质的量随时间变化的曲线如图所示。分析图中数据,回答下列问题。
(2)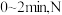 的平均反应速率为
的平均反应速率为_______  ;
; 时,反应是否达平衡?
时,反应是否达平衡?_______ (填“是”或“否”);
(3)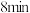 时,正反应速率
时,正反应速率_______ (填“>”,“<”或“=”)逆反应速率;该反应达到平衡时M的转化率为_______ ;
(4)下列描述中能说明该反应已达平衡状态的是_______ (填标号);
a.M的质量保持不变
b.混合气体的密度保持不变
c.混合气体的压强保持不变
d.单位时间内消耗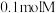 同时生成
同时生成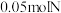
(5)若改变下列一个条件,推测该反应的速率发生的变化(填“增大”、“减小”或“不变”):
①升高温度,化学反应速率_______ ;
②充入 ,化学反应速率
,化学反应速率_______ ;
③将容器的容积变为 ,化学反应速率
,化学反应速率_______ 。
 的密闭容器中发生M、N两种气体间的转化,M、N物质的量随时间变化的曲线如图所示。分析图中数据,回答下列问题。
的密闭容器中发生M、N两种气体间的转化,M、N物质的量随时间变化的曲线如图所示。分析图中数据,回答下列问题。
(2)
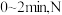 的平均反应速率为
的平均反应速率为 ;
; 时,反应是否达平衡?
时,反应是否达平衡?(3)
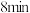 时,正反应速率
时,正反应速率(4)下列描述中能说明该反应已达平衡状态的是
a.M的质量保持不变
b.混合气体的密度保持不变
c.混合气体的压强保持不变
d.单位时间内消耗
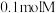 同时生成
同时生成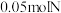
(5)若改变下列一个条件,推测该反应的速率发生的变化(填“增大”、“减小”或“不变”):
①升高温度,化学反应速率
②充入
 ,化学反应速率
,化学反应速率③将容器的容积变为
 ,化学反应速率
,化学反应速率
您最近一年使用:0次
解题方法
2 . 含氮化合物在农业、工业、国防等领域都有着广泛的应用。氮元素的价一类二维图如图,请回答下列问题:____________ ;丙为钠盐,其化学式为___________ 。
(2)甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为___________ 。
(3)甲的催化氧化是制备硝酸的重要反应,写出反应的化学方程式:___________ 。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:
NH3还原法:_________NH3+_________NO2 __________N2+_________H2O
__________N2+_________H2O
①配平NH3还原法的化学方程式:_________ 。
②碱液吸收法中,被氧化的物质是________ (填化学式)。
③同温同压下,将体积分别为V1、V2、V3的NO、NO2、O2混合于一个容积为V1+V2+V3的容器中后,倒立于水槽中,最终容器内充满水。则V2=__________ (用含V1、V3的代数式表示)。
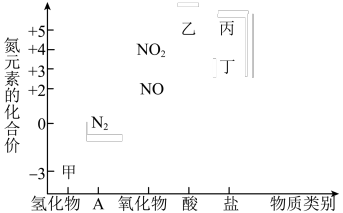
(2)甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为
(3)甲的催化氧化是制备硝酸的重要反应,写出反应的化学方程式:
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:

NH3还原法:_________NH3+_________NO2
 __________N2+_________H2O
__________N2+_________H2O①配平NH3还原法的化学方程式:
②碱液吸收法中,被氧化的物质是
③同温同压下,将体积分别为V1、V2、V3的NO、NO2、O2混合于一个容积为V1+V2+V3的容器中后,倒立于水槽中,最终容器内充满水。则V2=
您最近一年使用:0次
解题方法
3 . 认识氧化物的性质,能帮助我们更好地认识自然和保护环境。
(1)摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
①SiO2除用作摩擦剂外,其常用作_________ 。
②根据用途推测SiO2在水中的溶解性:__________ (填“易溶”或“难溶”)。
③比较酸性强弱:H2SO4_________ (填“>”或“<”)H2SiO3。
(2)SO2和NO2的任意排放均会污染环境。
①从物质分类角度看,SO2属于酸性氧化物,能与NaOH溶液反应生成亚硫酸盐。写出SO2与过量的NaOH溶液反应的离子方程式:___________ 。
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。则反应 中体现了SO2的
中体现了SO2的___________ (填“氧化性”或“还原性”)。
③NO2是一种____________ 色的有毒气体,易溶于水,与水反应有无色气体生成,写出NO2与水反应的化学方程式:____________ ,反应中每生成标准状况下的气体2.24L,则转移电子的物质的量为__________ mol。
(1)摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
①SiO2除用作摩擦剂外,其常用作
②根据用途推测SiO2在水中的溶解性:
③比较酸性强弱:H2SO4
(2)SO2和NO2的任意排放均会污染环境。
①从物质分类角度看,SO2属于酸性氧化物,能与NaOH溶液反应生成亚硫酸盐。写出SO2与过量的NaOH溶液反应的离子方程式:
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。则反应
 中体现了SO2的
中体现了SO2的③NO2是一种
您最近一年使用:0次
解题方法
4 . 在H2O、NH3、CS2、CH4、BF3分子中:
(1)存在π键的共价化合物分子是_______ (填分子式,下同)。
(2)具有直线形结构的分子是_______ 。
(3)具有正四面体形结构的分子是_______ 。
(4)具有三角锥形结构的分子是_______ 。
(5)具有sp2杂化轨道类型的分子是_______ 。
(6)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为_______ 。OF2分子的空间构型为_______ 。
(1)存在π键的共价化合物分子是
(2)具有直线形结构的分子是
(3)具有正四面体形结构的分子是
(4)具有三角锥形结构的分子是
(5)具有sp2杂化轨道类型的分子是
(6)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
您最近一年使用:0次
解题方法
5 . 回答下列问题
(1)基态Se原子的核外电子排布式为[Ar]_______ 。
(2)基态S原子的价电子中,两种自旋状态的电子数之比为_______ 。
(3)基态O原子的电子排布式_______ ,其中未成对电子有_______ 个。
(4)基态F原子的价电子排布图(轨道表示式)为_______ 。
(5)研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为_______ 。
(6)比较 和H2O分子中的键角大小并给出相应解释:
和H2O分子中的键角大小并给出相应解释:_______ 。
(1)基态Se原子的核外电子排布式为[Ar]
(2)基态S原子的价电子中,两种自旋状态的电子数之比为
(3)基态O原子的电子排布式
(4)基态F原子的价电子排布图(轨道表示式)为
(5)研究发现,给小鼠喂食适量硒酸钠(
 )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为(6)比较
 和H2O分子中的键角大小并给出相应解释:
和H2O分子中的键角大小并给出相应解释:
您最近一年使用:0次
6 . 根据下列四种晶体的晶胞示意图回答问题: 的晶胞平均含有的原子数是
的晶胞平均含有的原子数是___________ 。
(2)根据图Ⅱ分析,干冰晶胞平均含有的 分子数是
分子数是___________ 。
(3)根据图Ⅲ分析,碘晶体中碘分子的排列有___________ 种不同的取向。
(4)根据图Ⅳ分析,晶体M的化学式是___________ 。
(5)手性分子的判断方法:有机化合物分子中是否存在___________ 。
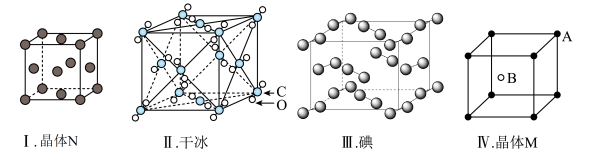
 的晶胞平均含有的原子数是
的晶胞平均含有的原子数是(2)根据图Ⅱ分析,干冰晶胞平均含有的
 分子数是
分子数是(3)根据图Ⅲ分析,碘晶体中碘分子的排列有
(4)根据图Ⅳ分析,晶体M的化学式是
(5)手性分子的判断方法:有机化合物分子中是否存在
您最近一年使用:0次
7 . 氨具有较高的含氢量,可用作内燃机的燃料。
(1)液氨是重要的非水溶剂,和水类似,液氨的电离平衡为 。写出
。写出 与
与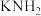 在液氨中发生中和反应的离子方程式为
在液氨中发生中和反应的离子方程式为__________ 。
(2)合成氨反应的方程式为 ,恒压密闭容器中,起始时
,恒压密闭容器中,起始时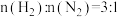 ,不同温度(T)下平衡混合物中
,不同温度(T)下平衡混合物中 物质的量分数随压强的变化曲线如图所示。
物质的量分数随压强的变化曲线如图所示。

①25℃时, 和
和 的燃烧热
的燃烧热 分别为
分别为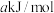 和
和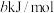 ,上述合成氨反应的焓变为
,上述合成氨反应的焓变为__________  。
。
②A点温度迅速从 变为
变为 ,则此时浓度商Q
,则此时浓度商Q______ 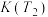 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③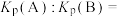
__________ ( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
④合成氨逆反应速率方程为v(逆)=k(逆)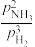 ,式中k(逆)为逆反应的速率常数(只与温度有关)。从C点开始减小压强,平衡发生移动,直至达到新的平衡,v(逆)的变化过程为
,式中k(逆)为逆反应的速率常数(只与温度有关)。从C点开始减小压强,平衡发生移动,直至达到新的平衡,v(逆)的变化过程为__________ 。
(3) 、
、 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
① 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为__________ 。
② 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是__________ 。
③比较熔点:
______  (填“>”或“<”)。
(填“>”或“<”)。
(1)液氨是重要的非水溶剂,和水类似,液氨的电离平衡为
 。写出
。写出 与
与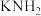 在液氨中发生中和反应的离子方程式为
在液氨中发生中和反应的离子方程式为(2)合成氨反应的方程式为
 ,恒压密闭容器中,起始时
,恒压密闭容器中,起始时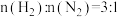 ,不同温度(T)下平衡混合物中
,不同温度(T)下平衡混合物中 物质的量分数随压强的变化曲线如图所示。
物质的量分数随压强的变化曲线如图所示。
①25℃时,
 和
和 的燃烧热
的燃烧热 分别为
分别为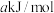 和
和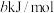 ,上述合成氨反应的焓变为
,上述合成氨反应的焓变为 。
。②A点温度迅速从
 变为
变为 ,则此时浓度商Q
,则此时浓度商Q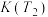 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③
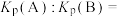
 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。④合成氨逆反应速率方程为v(逆)=k(逆)
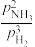 ,式中k(逆)为逆反应的速率常数(只与温度有关)。从C点开始减小压强,平衡发生移动,直至达到新的平衡,v(逆)的变化过程为
,式中k(逆)为逆反应的速率常数(只与温度有关)。从C点开始减小压强,平衡发生移动,直至达到新的平衡,v(逆)的变化过程为(3)
 、
、 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。元素 | H | B | N |
电负性 | 2.1 | 2.0 | 3.0 |
 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为②
 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是③比较熔点:

 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
8 . 回答下列问题:
(1)质量相同的SO2和SO3的物质的量之比是_______ ,摩尔质量之比是_______ ,含氧原子个数比是_______ ,硫原子个数比是_______ 。
(2)1.204×1024个NH3分子所含的氢原子数_______ 。
(3)amol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为_______ 。
(4)32 g SO2标况下的体积为_______ L,含有_______ 个氧原子。
(5)1.204×1024个CO2分子的摩尔质量是_______ 。
(1)质量相同的SO2和SO3的物质的量之比是
(2)1.204×1024个NH3分子所含的氢原子数
(3)amol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为
(4)32 g SO2标况下的体积为
(5)1.204×1024个CO2分子的摩尔质量是
您最近一年使用:0次
解题方法
9 . 实验室用固体烧碱配制480mL0.1mol•L-1NaOH溶液。
(1)配制过程中不需要使用下列仪器中的_______ (填仪器序号)。

(2)配制时应选择的容量瓶规格为_______ mL,需称量NaOH固体的质量为_______ g。
(3)定容时,加少量水需用到的玻璃仪器是_______ 。
(4)若遇下列情况,可能导致所配溶液的物质的量浓度(填“偏高”“偏低”或“无影响”)。
①容量瓶在使用前未干燥,里面有少量蒸馏水:_______ 。
②定容时俯视刻度线读数:_______ 。
③转移溶液至容量瓶过程中,有少量溶液溅出:_______ 。
(1)配制过程中不需要使用下列仪器中的

(2)配制时应选择的容量瓶规格为
(3)定容时,加少量水需用到的玻璃仪器是
(4)若遇下列情况,可能导致所配溶液的物质的量浓度(填“偏高”“偏低”或“无影响”)。
①容量瓶在使用前未干燥,里面有少量蒸馏水:
②定容时俯视刻度线读数:
③转移溶液至容量瓶过程中,有少量溶液溅出:
您最近一年使用:0次
10 . 已知,在铁触媒的催化下N2 (g)+ 3H2(g) 2NH3 (g) ∆H,请完成下列填空:
2NH3 (g) ∆H,请完成下列填空:
(1)反应过程的能量变化示意图如下图所示,已知N≡N和H-H的键能分别为946kJ·mol-1、436kJ·mol-1,则N-H的键能为________ kJ·mol-1。

(2)当达到平衡后,在某时刻降低温度,正、逆反应速率的变化情况符合像下图________(填“标号”)。
(3)下列措施能够提高H2平衡转化率的是________ 。
A升高温度 B增大压强 C.恒温恒压下通入Ar
D.恒温恒容下通入N2 E. 恒温恒容下通入H2 F.及时分离出NH3
(4)在一定温度下,在10L的密闭容器中充入3mol N2和10 mol H2和适量的铁触媒,产生NH3的物质的量变化情况如下表所示:
①在0~2min,用N2表示的化学反应速率v(N2)= ________ 。
②H2的平衡转化率为________ ,达到平衡时放出的热量为________ 。
③在该温度下,合成氨反应的化学平衡常数K=________ 可以不写“单位”)。
 2NH3 (g) ∆H,请完成下列填空:
2NH3 (g) ∆H,请完成下列填空:(1)反应过程的能量变化示意图如下图所示,已知N≡N和H-H的键能分别为946kJ·mol-1、436kJ·mol-1,则N-H的键能为

(2)当达到平衡后,在某时刻降低温度,正、逆反应速率的变化情况符合像下图________(填“标号”)。
A.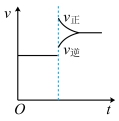 | B.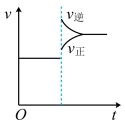 |
C.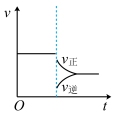 | D. |
(3)下列措施能够提高H2平衡转化率的是
A升高温度 B增大压强 C.恒温恒压下通入Ar
D.恒温恒容下通入N2 E. 恒温恒容下通入H2 F.及时分离出NH3
(4)在一定温度下,在10L的密闭容器中充入3mol N2和10 mol H2和适量的铁触媒,产生NH3的物质的量变化情况如下表所示:
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NH3)/mol | 0 | 1.8 | 2.8 | 3.5 | 4 | 4 |
②H2的平衡转化率为
③在该温度下,合成氨反应的化学平衡常数K=
您最近一年使用:0次



