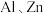名校
解题方法
1 . 碳在地壳中的含量很低,但是含有碳元素的有机物却分布极广。
(1)观察下面几种烷烃的球棍模型:______________ (填字母,下同),与C互为同分异构体的是______________ .
(2)写出下列链状烷烃的分子式:
①含有30个氢原子的烷烃的分子式为______________ .
②假如某烷烃的相对分子质量为142,则该烷烃的分子式为______________ .
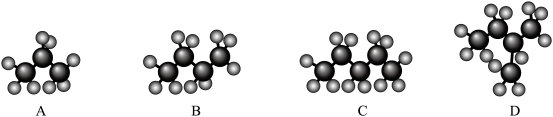
(3)利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室模拟上述过程,其设计的模拟装置如图.
①装置B有三种功能:a.控制气流速度;b.均匀混合气体;c.______________ .
②设 ,若理论上欲获得最多的氯化氢,则x值应
,若理论上欲获得最多的氯化氢,则x值应______________ .
③装置D的石棉中均匀混有 粉末,其作用是
粉末,其作用是__________________________________________ .
④装置E的作用是______________ (填序号).
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(1)观察下面几种烷烃的球棍模型:
(2)写出下列链状烷烃的分子式:
①含有30个氢原子的烷烃的分子式为
②假如某烷烃的相对分子质量为142,则该烷烃的分子式为
(3)利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室模拟上述过程,其设计的模拟装置如图.
①装置B有三种功能:a.控制气流速度;b.均匀混合气体;c.
②设
 ,若理论上欲获得最多的氯化氢,则x值应
,若理论上欲获得最多的氯化氢,则x值应③装置D的石棉中均匀混有
 粉末,其作用是
粉末,其作用是④装置E的作用是
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
您最近一年使用:0次
名校
2 . 我国科学家将聚酰亚胺(组成元素为H、C、N、O等)介电聚合物与高绝缘纳米氧化镁(MgO)填料混合,成功制得聚酰亚胺/纳米氧化镁复合材料。该复合材料特点为具有高击穿强度、宽温度范围和低介电损耗。结合所学知识,回答下列问题。
(1)基态Mg原子的电子排布式为_________ 。
(2)C、N、O第一电离能由大到小的顺序为_________ ;C、N、O电负性由大到小的顺序为_________ ,理由是________________ 。
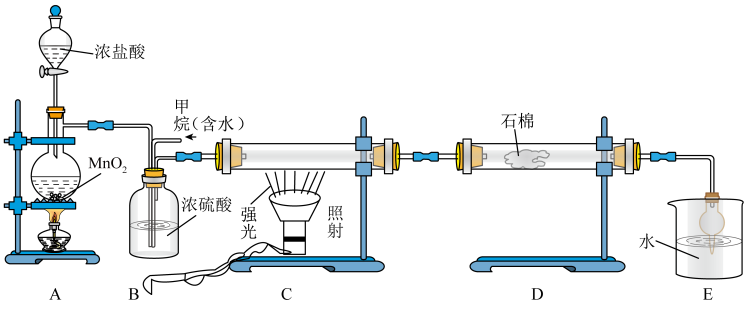
(3) 三种分子的空间结构和相应的键角如图1所示。
三种分子的空间结构和相应的键角如图1所示。 中O的未成对电子所在原子轨道的形状为
中O的未成对电子所在原子轨道的形状为_________ ; 的沸点比
的沸点比 的高,其主要原因是
的高,其主要原因是__________ ; 的键角大于
的键角大于 的键角,其原因是
的键角,其原因是________ 。
(1)基态Mg原子的电子排布式为
(2)C、N、O第一电离能由大到小的顺序为
(3)
 三种分子的空间结构和相应的键角如图1所示。
三种分子的空间结构和相应的键角如图1所示。
 中O的未成对电子所在原子轨道的形状为
中O的未成对电子所在原子轨道的形状为 的沸点比
的沸点比 的高,其主要原因是
的高,其主要原因是 的键角大于
的键角大于 的键角,其原因是
的键角,其原因是
您最近一年使用:0次
名校
解题方法
3 . 某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下实验,实验结果记录如下:
根据表中的实验现象回答下列问题.
(1)实验1和实验2中 所作的电极
所作的电极______________ (填“相同”或“不相同”);
(2)对实验3完成下列填空.
①铝为_________ 极,电极反应式为__________________ ;
②石墨为__________ 极,电极反应式为_______________________ ;
③电池总反应的化学方程式为__________ ;
(3)实验4中铝作_________ 极,理由是__________ ;铝电极的电极反应式为__________ ;
(4)解释实验5中电流表指针偏向铝的原因:__________ ;
(5)根据实验结果总结影响铝在原电池中作正极或负极的因素:__________ 。
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
1 |
| 稀盐酸 | 偏向 |
2 |
| 稀盐酸 | 偏向 |
3 |
| 稀盐酸 | 偏向石墨 |
4 |
|
| 偏向 |
5 |
| 浓硝酸 | 偏向 |
(1)实验1和实验2中
 所作的电极
所作的电极(2)对实验3完成下列填空.
①铝为
②石墨为
③电池总反应的化学方程式为
(3)实验4中铝作
(4)解释实验5中电流表指针偏向铝的原因:
(5)根据实验结果总结影响铝在原电池中作正极或负极的因素:
您最近一年使用:0次
名校
4 . 非金属单质A经下图所示的过程可转化为含氧酸D,已知D为强酸。请回答下列问题.

(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体;
①D的化学式为______________ ;
②在工业生产中,B气体大量排放,被雨水吸收后形成的______________ 会污染环境;
③98.3%的D溶液是常见的气体干燥剂,但它不能干燥 和
和 ,原因是
,原因是______________ ;
(2)若A在常温下为气体,C是红棕色的气体;
①A、C的化学式分别为_________ 、___________ ;
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为________ ,该反应_______ (填“属于”或“不属于”)氧化还原反应;
③工业上利用氨制备D,写出氨被催化氧化生成B气体的化学方程式:____________ 。

(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体;
①D的化学式为
②在工业生产中,B气体大量排放,被雨水吸收后形成的
③98.3%的D溶液是常见的气体干燥剂,但它不能干燥
 和
和 ,原因是
,原因是(2)若A在常温下为气体,C是红棕色的气体;
①A、C的化学式分别为
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为
③工业上利用氨制备D,写出氨被催化氧化生成B气体的化学方程式:
您最近一年使用:0次
5 . 回答下问题:
(1)Sm的价层电子排布式为 4f66s2 ,Sm3+价层电子排布式为___________ 。
(2)依据第二周期元素第一电离能的变化规律,参照如图元素 B 、F 的位置,用小黑点标 出 C 、N 、O 三种元素的相对位置___________ 。___________ 。
(4)H2S 和 H2Se 的参数对比见下表,其中 H2S 的键角大于 H2Se 的键角的原因可能为___________
(1)Sm的价层电子排布式为 4f66s2 ,Sm3+价层电子排布式为
(2)依据第二周期元素第一电离能的变化规律,参照如图元素 B 、F 的位置,用小黑点标 出 C 、N 、O 三种元素的相对位置

(4)H2S 和 H2Se 的参数对比见下表,其中 H2S 的键角大于 H2Se 的键角的原因可能为
| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
您最近一年使用:0次
6 . 氮及其化合物与生产生活及环境息息相关。请回答下列问题:
(1)N2在常温下性质很稳定,任意写出一种与此性质有关的用途:_____ 。
(2)硝酸与金属反应会产生氮氧化物。
①下列环境问题与氮的氧化物排放无关的是_____ 。
A.酸雨 B.光化学烟雾 C. 白色污染 D.温室效应
②在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有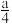 g HNO3被还原,则a∶b可能为
g HNO3被还原,则a∶b可能为_____ 。
A.2∶1 B.3∶1 C.4∶1 D.9∶2
(3)汽车尾气中存在NO和CO,通过在排气管处加装催化剂,可以使其转化为对环境友好的物质,请写出发生反应的化学方程式_____ ,氧化产物与还原产物的物质的量之比为_____ 。
(1)N2在常温下性质很稳定,任意写出一种与此性质有关的用途:
(2)硝酸与金属反应会产生氮氧化物。
①下列环境问题与氮的氧化物排放无关的是
A.酸雨 B.光化学烟雾 C. 白色污染 D.温室效应
②在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有
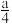 g HNO3被还原,则a∶b可能为
g HNO3被还原,则a∶b可能为A.2∶1 B.3∶1 C.4∶1 D.9∶2
(3)汽车尾气中存在NO和CO,通过在排气管处加装催化剂,可以使其转化为对环境友好的物质,请写出发生反应的化学方程式
您最近一年使用:0次
7 . 在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是___________ (用字母表示,下同)。
(2)同体积、同物质的量浓度的三种酸,中和NaOH 的能力由大到小的顺序是___________ 。
(3)若三者pH相同时,物质的量浓度由大到小的顺序是___________ 。
(4)将pH相同且体积也相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH溶液的体积大小关系为___________ 。
(5)将pH相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是___________ 。
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是
(2)同体积、同物质的量浓度的三种酸,中和NaOH 的能力由大到小的顺序是
(3)若三者pH相同时,物质的量浓度由大到小的顺序是
(4)将pH相同且体积也相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH溶液的体积大小关系为
(5)将pH相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是
您最近一年使用:0次
8 . 化学学习小组欲探究铁及其化合物的氧化性和还原性。请你协助他们完成实验报告。
实验目的:探究铁及其化合物的氧化性和还原性。
实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、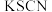 溶液、铁粉、锌片、铜片、稀硫酸。
溶液、铁粉、锌片、铜片、稀硫酸。
仪器:胶头滴管、试管、烧杯等。
(1)实验记录(仿照①实验作答,填写空白部分)。
(2)在实验②中,有部分同学在氯化亚铁溶液中滴入 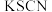 溶液后,出现了红色,你认为是什么原因:
溶液后,出现了红色,你认为是什么原因:___________ ;你对实验员在配制氯化亚铁溶液时,提出的建议是___________ 。
实验目的:探究铁及其化合物的氧化性和还原性。
实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、
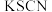 溶液、铁粉、锌片、铜片、稀硫酸。
溶液、铁粉、锌片、铜片、稀硫酸。仪器:胶头滴管、试管、烧杯等。
(1)实验记录(仿照①实验作答,填写空白部分)。
| 序号 | 实验设计 | 实验现象 | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴入稀硫酸 | 铁粉溶解,溶液由无色变成浅绿色,生成无色无味气体 | 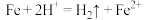 |  具有还原性 具有还原性 |
| ② |  溶液中滴入 溶液中滴入 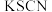 溶液,再加氯水 溶液,再加氯水 | 滴入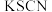 溶液无明显变化,加入氯水立即变成红色 溶液无明显变化,加入氯水立即变成红色 | ||
| ③ |  溶液中加入锌片 溶液中加入锌片 |  | ||
| ④ | 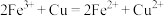 |  具有氧化性 具有氧化性 |
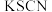 溶液后,出现了红色,你认为是什么原因:
溶液后,出现了红色,你认为是什么原因:
您最近一年使用:0次
9 . 实验室欲用质量分数为 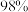 、密度为
、密度为 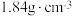 的浓硫酸配制
的浓硫酸配制  的稀硫酸。配制步骤包括:①计算所用浓硫酸的体积;②转移;③定容、摇匀;④量取一定体积的浓硫酸;⑤洗涤;⑥稀释并冷却至室温;⑦轻摇。完成下列问题:
的稀硫酸。配制步骤包括:①计算所用浓硫酸的体积;②转移;③定容、摇匀;④量取一定体积的浓硫酸;⑤洗涤;⑥稀释并冷却至室温;⑦轻摇。完成下列问题:
(1)正确的操作步骤为(填入序号)___________ 。选用的主要仪器有:量筒、烧杯、玻璃棒、___________ 、___________ 。
(2)应量取浓硫酸的体积约为___________ ;量取浓硫酸所用的量筒的规格是___________ (从下列选项中选用)。
A. B.
B.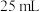 C.
C.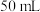 D.
D.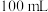
(3)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是___________ 。
(4)下列情况中,所配制的稀硫酸浓度偏大的是___________ (填序号)。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
E.洗涤量取浓硫酸使用的量筒,并将洗涤液转移入容量瓶
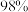 、密度为
、密度为 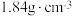 的浓硫酸配制
的浓硫酸配制  的稀硫酸。配制步骤包括:①计算所用浓硫酸的体积;②转移;③定容、摇匀;④量取一定体积的浓硫酸;⑤洗涤;⑥稀释并冷却至室温;⑦轻摇。完成下列问题:
的稀硫酸。配制步骤包括:①计算所用浓硫酸的体积;②转移;③定容、摇匀;④量取一定体积的浓硫酸;⑤洗涤;⑥稀释并冷却至室温;⑦轻摇。完成下列问题:(1)正确的操作步骤为(填入序号)
(2)应量取浓硫酸的体积约为
A.
 B.
B.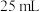 C.
C.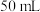 D.
D.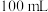
(3)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是
(4)下列情况中,所配制的稀硫酸浓度偏大的是
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
E.洗涤量取浓硫酸使用的量筒,并将洗涤液转移入容量瓶
您最近一年使用:0次
10 . 回答下列问题。
(1)溶液酸化时,K2MnO4转变为MnO2固体和KMnO4的离子方程式是___________ 。
(2)常温下,某种饮品pH=4,其中c(OH-)=___________ 。
(3)将0.025 mol·L-1的H2SO4溶液和0.075 mol·L-1的H2SO4溶液等体积混合,混合溶液的pH=___________ 。
(4)常温下,pH=13的氢氧化钡溶液,c[Ba(OH)2]=___________ 。
(5)当H2S浓度较低时常用纯碱溶液进行吸收。表为H2S、H2CO3 的电离平衡常数。
纯碱溶液吸收少量H2S的离子方程式为___________ 。
(1)溶液酸化时,K2MnO4转变为MnO2固体和KMnO4的离子方程式是
(2)常温下,某种饮品pH=4,其中c(OH-)=
(3)将0.025 mol·L-1的H2SO4溶液和0.075 mol·L-1的H2SO4溶液等体积混合,混合溶液的pH=
(4)常温下,pH=13的氢氧化钡溶液,c[Ba(OH)2]=
(5)当H2S浓度较低时常用纯碱溶液进行吸收。表为H2S、H2CO3 的电离平衡常数。
| 电离平衡常数 | Kal | Ka2 |
| H2S | 9.1×10-8 | 1.1×10-12 |
| H2CO3 | 4.3×10-7 | 5.61×10-11 |
您最近一年使用:0次

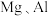
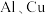

 溶液
溶液