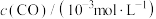1 . 科学家开发了“氧化裂解技术”,将废弃物中的聚苯乙烯(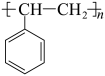 )转变为有用的苯甲酸(
)转变为有用的苯甲酸(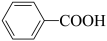 ),变废为宝。转变反应如下:
),变废为宝。转变反应如下: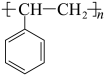
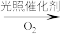
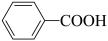 。结合上述材料,回答下列问题:
。结合上述材料,回答下列问题:
| A.属于氧化反应 | B.属于加聚反应 |
| C.发生了碳碳键的断裂 | D.反应物和产物都含有苯分子 |
(2)关于聚苯乙烯的说法正确的是___________。
| A.其单体是乙烯 | B.难溶于水 |
| C.可以制成泡沫包装材料 | D.难以自然降解,应回收处理 |
(3)苯乙烯的一些性质类似于乙烯。苯乙烯___________。
| A.属于烷烃 | B.属于不饱和烃 |
C.不能使溴的 溶液褪色 溶液褪色 | D.能使酸性 溶液褪色 溶液褪色 |
(4)苯甲酸的一些性质类似于乙酸。苯甲酸___________。
| A.可与Na反应 | B.可与NaOH反应 |
| C.一定条件下可与乙醇反应 | D.是一种常见的食品防腐剂 |
(5)一些苯环上有取代基的聚苯乙烯类高分子,也能利用上述的“氧化裂解技术”发生类似的反应。已知一种高分子R的结构如图。下列有关R的说法正确的是___________。
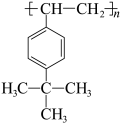
| A.能发生取代反应 | B.能在空气中燃烧 |
C.分子式为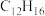 | D.能氧化裂解生成含羧基的物质 |
您最近一年使用:0次
2 . 回答下列问题:
(1)符号“3px”没有给出的信息是_______。
(2)某元素基态原子4s轨道上有1个电子,则该元素基态原子价电子排布不可能是_______。
(3)X元素的原子最外层电子排布式为(n+1)sn(n+1)pn+1,则X的氢化物的化学式是_______。
(4)下列比较正确的是_______。
(5)下列实验事实不能用氢键来解释的是_______。
(6)由磷原子核形成的三种微粒:a.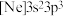 、b.
、b. 、c.
、c. ,半径由大到小的顺序为
,半径由大到小的顺序为_______ (填标号,下同);再失去一个电子所需最低能量由大到小的顺序为_______ 。
(7)比较H-O-H键角大小;H3O+_______ H2O(填“>”、“<”或“=”)。
(8)胍(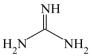 )分子中碳原子和氮原子共平面,胍中N杂化方式为
)分子中碳原子和氮原子共平面,胍中N杂化方式为_______ 。
(1)符号“3px”没有给出的信息是_______。
| A.能层 | B.能级 | C.电子云在空间的伸展方向 | D.电子的自旋方向 |
(2)某元素基态原子4s轨道上有1个电子,则该元素基态原子价电子排布不可能是_______。
| A.4s1 | B.3p64s1 | C.3d54s1 | D.3d104s1 |
(3)X元素的原子最外层电子排布式为(n+1)sn(n+1)pn+1,则X的氢化物的化学式是_______。
| A.HX | B.H2X | C.XH3 | D.XH4 |
(4)下列比较正确的是_______。
| A.酸性:H3PO4<H3AsO4 | B.熔点:MgO>CaO |
| C.离子半径:r(Al3+)>r(O2-) | D.键角:H2O>NH3 |
(5)下列实验事实不能用氢键来解释的是_______。
| A.CH4比SiH4稳定 |
| B.乙醇能与水以任意比互溶 |
| C.邻羟基苯甲醛的沸点低于对羟基苯甲醛 |
| D.接近沸点的水蒸气的相对分子质量测量值大于18 |
(6)由磷原子核形成的三种微粒:a.
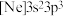 、b.
、b. 、c.
、c. ,半径由大到小的顺序为
,半径由大到小的顺序为(7)比较H-O-H键角大小;H3O+
(8)胍(
 )分子中碳原子和氮原子共平面,胍中N杂化方式为
)分子中碳原子和氮原子共平面,胍中N杂化方式为
您最近一年使用:0次
名校
3 . 回答下列问题
(1)写出 的价电子排布式
的价电子排布式______ 。
(2)实验室用软锰矿和浓盐酸制氯气,写出该反应的化学方程式______ 。
(3)在常温下, 溶液的pH=9,则溶液中由水电离出来的
溶液的pH=9,则溶液中由水电离出来的
______ 。
(4)火箭发射可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,两者反应生成
作氧化剂,两者反应生成 和水蒸气。
和水蒸气。
已知:
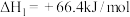
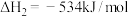
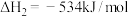
请写出 与
与 反应的热化学方程式
反应的热化学方程式______ 。
(5)下表列出了某短周期元素R的各级电离能数据(用 、
、 ……表示)。
……表示)。
关于元素R的下列推断中,正确的是______ (用相应的编号填写)
①R元素位于元素周期表中第ⅡA族
②R元素基态原子的电子排布式为
③R元素的最高价氧化物可表示为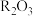
④R元素的第一电离能高于同周期相邻元素的第一电离能
(1)写出
 的价电子排布式
的价电子排布式(2)实验室用软锰矿和浓盐酸制氯气,写出该反应的化学方程式
(3)在常温下,
 溶液的pH=9,则溶液中由水电离出来的
溶液的pH=9,则溶液中由水电离出来的
(4)火箭发射可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,两者反应生成
作氧化剂,两者反应生成 和水蒸气。
和水蒸气。已知:

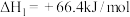
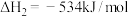
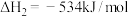
请写出
 与
与 反应的热化学方程式
反应的热化学方程式(5)下表列出了某短周期元素R的各级电离能数据(用
 、
、 ……表示)。
……表示)。元素 | 电离能 | |||||
|
|
|
|
| … | |
| 740 | 1500 | 7700 | 10500 | 13630 | … |
①R元素位于元素周期表中第ⅡA族
②R元素基态原子的电子排布式为

③R元素的最高价氧化物可表示为
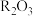
④R元素的第一电离能高于同周期相邻元素的第一电离能
您最近一年使用:0次
名校
解题方法
4 . 氮的氧化物 是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。
是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。
(1) 能形成酸雨,写出
能形成酸雨,写出 溶于水生成
溶于水生成 的化学方程式:
的化学方程式:__________ 。
(2)NO和 可用NaOH溶液吸收,主要反应:
可用NaOH溶液吸收,主要反应: ,
,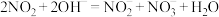 。将NO、
。将NO、 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料 。该工艺需控制NO和
。该工艺需控制NO和 物质的量之比接近1∶1.若
物质的量之比接近1∶1.若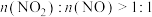 ,则会导致
,则会导致__________ ,若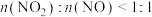 ,则会导致
,则会导致__________ 。
(3)在汽车尾气系统中,安装催化转化器可有效降低 的排放。实验室为了模拟反应
的排放。实验室为了模拟反应 在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:
在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:
①前2s的平均反应速率
____________ ,4s时NO的转化率为__________ 。
②若已知该反应的瞬时速率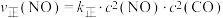 ,其中
,其中 为速率常数,
为速率常数,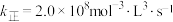 ,当NO的浓度变为原来的
,当NO的浓度变为原来的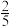 时,
时,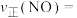
__________ 。
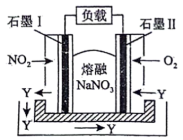
(4)由 、
、 、熔融盐
、熔融盐 组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成氮的最高价氧化物Y。
组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成氮的最高价氧化物Y。
①石墨Ⅱ电极为_____________ (填“正极”或“负极”)。
②写出石墨Ⅰ电极反应式_____________ 。
 是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。
是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。(1)
 能形成酸雨,写出
能形成酸雨,写出 溶于水生成
溶于水生成 的化学方程式:
的化学方程式:(2)NO和
 可用NaOH溶液吸收,主要反应:
可用NaOH溶液吸收,主要反应: ,
,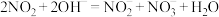 。将NO、
。将NO、 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料 。该工艺需控制NO和
。该工艺需控制NO和 物质的量之比接近1∶1.若
物质的量之比接近1∶1.若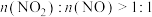 ,则会导致
,则会导致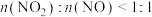 ,则会导致
,则会导致(3)在汽车尾气系统中,安装催化转化器可有效降低
 的排放。实验室为了模拟反应
的排放。实验室为了模拟反应 在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:
在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| 10.00 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

②若已知该反应的瞬时速率
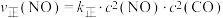 ,其中
,其中 为速率常数,
为速率常数,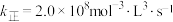 ,当NO的浓度变为原来的
,当NO的浓度变为原来的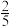 时,
时,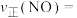
(4)由
 、
、 、熔融盐
、熔融盐 组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成氮的最高价氧化物Y。
组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成氮的最高价氧化物Y。①石墨Ⅱ电极为
②写出石墨Ⅰ电极反应式
您最近一年使用:0次
5 . 从海带浸泡液(碘元素主要以 存在)中获取
存在)中获取 ,含碘物质的转化过程如下。
,含碘物质的转化过程如下。 的作用为
的作用为_______ (填“氧化剂”或“还原剂”)。
(2)为提高①的化学反应速率,可采取的措施是_______ (写出一条即可)。
(3)补全②的离子方程式:_______ 。
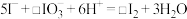
(4)②中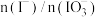 和pH对碘离子的氧化率的影响如下图所示。
和pH对碘离子的氧化率的影响如下图所示。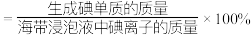
分析图中信息,选择最佳条件:_______ 。
 存在)中获取
存在)中获取 ,含碘物质的转化过程如下。
,含碘物质的转化过程如下。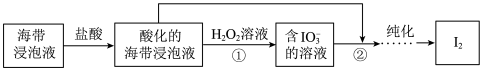
 的作用为
的作用为(2)为提高①的化学反应速率,可采取的措施是
(3)补全②的离子方程式:
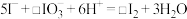
(4)②中
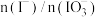 和pH对碘离子的氧化率的影响如下图所示。
和pH对碘离子的氧化率的影响如下图所示。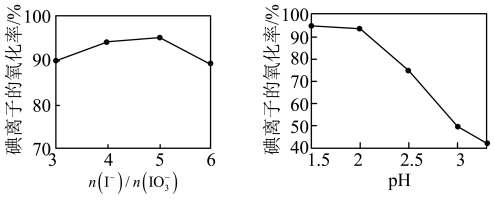
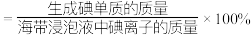
分析图中信息,选择最佳条件:
您最近一年使用:0次
6 . 氮、碳、硼元素形成的化合物具有独特的结构。请回答:
(1)固态的N2O5为离子晶体(阴阳离子中所含原子个数均不超过4个),其阳离子的空间结构名称为___________ ,阴离子中氮原子的杂化方式为___________ 。
(2)比较酸性强弱:
___________  (填“>”、“<”),请说明理由
(填“>”、“<”),请说明理由___________ 。
(3)当石墨被过量的K处理后(未反应的金属被汞洗出),K+离子在石墨层间嵌入,K+层在石墨层的投影如图所示。该钾石墨晶体的化学式是___________ ,晶体类型是___________ 。不正确 的是___________。
(5)硼砂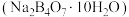 与NaOH的混合溶液中加入H2O2可以制备
与NaOH的混合溶液中加入H2O2可以制备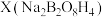 ,已知X的阴离子
,已知X的阴离子 只有一种化学环境的B原子,且B和O原子最外层都达到8电子稳定结构,写出X阴离子的结构式
只有一种化学环境的B原子,且B和O原子最外层都达到8电子稳定结构,写出X阴离子的结构式___________ 。
(1)固态的N2O5为离子晶体(阴阳离子中所含原子个数均不超过4个),其阳离子的空间结构名称为
(2)比较酸性强弱:

 (填“>”、“<”),请说明理由
(填“>”、“<”),请说明理由(3)当石墨被过量的K处理后(未反应的金属被汞洗出),K+离子在石墨层间嵌入,K+层在石墨层的投影如图所示。该钾石墨晶体的化学式是
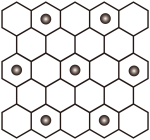
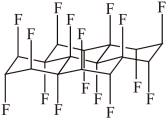
| A.与石墨相比,(CF)x导电性增强 | B.与石墨相比,(CF)x抗氧化性增强 |
| C.(CF)x中C—F的键长比C—C短 | D.1mol(CF)x中含有2x mol共价单键 |
(5)硼砂
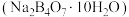 与NaOH的混合溶液中加入H2O2可以制备
与NaOH的混合溶液中加入H2O2可以制备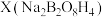 ,已知X的阴离子
,已知X的阴离子 只有一种化学环境的B原子,且B和O原子最外层都达到8电子稳定结构,写出X阴离子的结构式
只有一种化学环境的B原子,且B和O原子最外层都达到8电子稳定结构,写出X阴离子的结构式
您最近一年使用:0次
解题方法
7 . 非金属元素及其化合物广泛应用于生产、生活、国防等多个领域。请回答下列问题:
(1) 的VSEPR模型名称为
的VSEPR模型名称为___________ ,分子的空间结构名称为___________ ,中心原子有___________ 个杂化轨道;
(2)氮可形成多种氧化物, 和
和 (直线形分子)的中心原子均为N原子,但二者中心原子的杂化方式不同,二者均存在大
(直线形分子)的中心原子均为N原子,但二者中心原子的杂化方式不同,二者均存在大 键(
键( 中,3为形成大
中,3为形成大 键的原子数,4为大
键的原子数,4为大 键中的共用电子个数),
键中的共用电子个数), 中中心氮原子的轨道杂化方式为:
中中心氮原子的轨道杂化方式为:___________ ; 中的
中的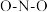 键角
键角___________ (填“ ”“
”“ ”或“
”或“ ”)
”) 中的
中的 键角。
键角。
(3) 的简单平面结构如图。
的简单平面结构如图。___________ 。
②在该晶体中存在的化学键类型有___________ (填标号)。
a.离子键 b.极性共价键 c.非极性共价键 d.氢键 e.配位键
③水分子①中的键角___________ (填“ ”“
”“ ”或“
”或“ ”)
”) ,原因是
,原因是___________ 。
(1)
 的VSEPR模型名称为
的VSEPR模型名称为(2)氮可形成多种氧化物,
 和
和 (直线形分子)的中心原子均为N原子,但二者中心原子的杂化方式不同,二者均存在大
(直线形分子)的中心原子均为N原子,但二者中心原子的杂化方式不同,二者均存在大 键(
键( 中,3为形成大
中,3为形成大 键的原子数,4为大
键的原子数,4为大 键中的共用电子个数),
键中的共用电子个数), 中中心氮原子的轨道杂化方式为:
中中心氮原子的轨道杂化方式为: 中的
中的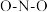 键角
键角 ”“
”“ ”或“
”或“ ”)
”) 中的
中的 键角。
键角。(3)
 的简单平面结构如图。
的简单平面结构如图。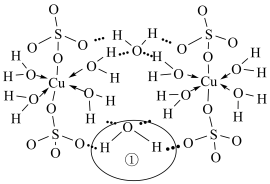
②在该晶体中存在的化学键类型有
a.离子键 b.极性共价键 c.非极性共价键 d.氢键 e.配位键
③水分子①中的键角
 ”“
”“ ”或“
”或“ ”)
”) ,原因是
,原因是
您最近一年使用:0次
名校
解题方法
8 . I.化学反应中伴随着能量变化,根据相关知识回答下列问题:
(1)下列过程吸热的是___________ (填序号)。
a.生石灰溶于水 b.浓硫酸稀释 c.硝酸铵溶于水 d.铜溶于浓硝酸
e.氯化铵固体与氢氧化钡晶体混合搅拌
(2)已知H2和O2反应放热, 且断开1molH-H键、1molO=O键、1molO-H键需吸收的能量分别为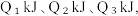 由此可以推知下列关系正确的是
由此可以推知下列关系正确的是___________ (填序号)。
①.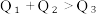 ②.
②. 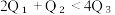 ③.
③. 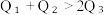 ④.
④. 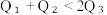
Ⅱ.某同学用导线将电流表与Zn片、Cu片相连接,插入盛有稀硫酸的烧杯中进行实验,如图所示。___________ 。
(4)从构成原电池的基本要素来看,稀硫酸的作用是(选填以下序号)___________ 。
a.反应物 b.电极材料 c.离子导体 d.电子导体
(5)该原电池的负极反应式为___________ ,___________ (填“电子”或“电流”)是由锌片经导线流向铜片。标准状况下,若反应过程中溶解了6.5g锌,则生成的氢气的体积为___________ L。
(6)某同学想利用反应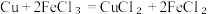 设计一个原电池请在下图
设计一个原电池请在下图___________ (共2处)标出使用的用品。
(1)下列过程吸热的是
a.生石灰溶于水 b.浓硫酸稀释 c.硝酸铵溶于水 d.铜溶于浓硝酸
e.氯化铵固体与氢氧化钡晶体混合搅拌
(2)已知H2和O2反应放热, 且断开1molH-H键、1molO=O键、1molO-H键需吸收的能量分别为
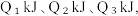 由此可以推知下列关系正确的是
由此可以推知下列关系正确的是①.
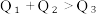 ②.
②. 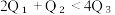 ③.
③. 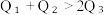 ④.
④. 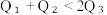
Ⅱ.某同学用导线将电流表与Zn片、Cu片相连接,插入盛有稀硫酸的烧杯中进行实验,如图所示。
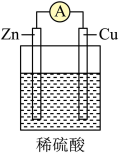
(4)从构成原电池的基本要素来看,稀硫酸的作用是(选填以下序号)
a.反应物 b.电极材料 c.离子导体 d.电子导体
(5)该原电池的负极反应式为
(6)某同学想利用反应
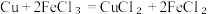 设计一个原电池请在下图
设计一个原电池请在下图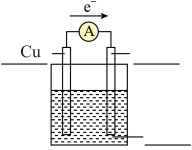
您最近一年使用:0次
解题方法
9 . 分子的结构与物质性质之间存在紧密的联系。
(1)如图是部分主族元素氢化物的沸点变化趋势_______ ,其汽化过程中克服的作用力是 _______ 。
②氢化物b、c、d的沸点均高于同族其它元素氢化物的沸点,原因是_______ 。
③H2O的沸点高于HF,预测可能的原因是_______ 。
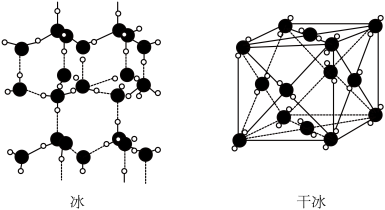
(2)如图是冰(H2O)和干冰(CO2)的结构模型。_______ (填字母序号)。
a.冰中氢键存在方向性,晶体有较大空隙,空间利用率低
b.水分子极性强,分子间作用力大
c.二氧化碳分子的质量大于水分子
d.干冰晶胞中二氧化碳分子堆积得更密集
(3)苯胺(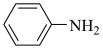 )与甲苯(
)与甲苯(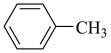 )的相对分子质量接近,但苯胺的熔点(﹣6.2℃)和沸点(184.4℃)高于甲苯的熔点(﹣95.0℃)和沸点(110.6℃),原因是
)的相对分子质量接近,但苯胺的熔点(﹣6.2℃)和沸点(184.4℃)高于甲苯的熔点(﹣95.0℃)和沸点(110.6℃),原因是 _______ 。
(1)如图是部分主族元素氢化物的沸点变化趋势
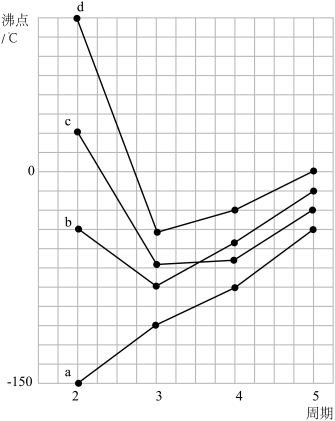
②氢化物b、c、d的沸点均高于同族其它元素氢化物的沸点,原因是
③H2O的沸点高于HF,预测可能的原因是
(2)如图是冰(H2O)和干冰(CO2)的结构模型。
a.冰中氢键存在方向性,晶体有较大空隙,空间利用率低
b.水分子极性强,分子间作用力大
c.二氧化碳分子的质量大于水分子
d.干冰晶胞中二氧化碳分子堆积得更密集
(3)苯胺(
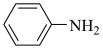 )与甲苯(
)与甲苯( )的相对分子质量接近,但苯胺的熔点(﹣6.2℃)和沸点(184.4℃)高于甲苯的熔点(﹣95.0℃)和沸点(110.6℃),原因是
)的相对分子质量接近,但苯胺的熔点(﹣6.2℃)和沸点(184.4℃)高于甲苯的熔点(﹣95.0℃)和沸点(110.6℃),原因是
您最近一年使用:0次
解题方法
10 . 有三种分子式均为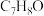 的芳香族化合A、B、C,A能与
的芳香族化合A、B、C,A能与 溶液发生显色反应;B不能与
溶液发生显色反应;B不能与 溶液发生显色反应但可与金属钠反应放出气体;C不能与金属钠反应。请回答下列问题:
溶液发生显色反应但可与金属钠反应放出气体;C不能与金属钠反应。请回答下列问题:
(1)A可能的结构有___________ 种,A与苯酚互为___________ (填“同种物质”“同分异构体”或“同系物”)。
(2)若A的核磁共振氢谱有4组峰,则A与浓溴水反应的化学方程式为___________ 。向A的钠盐溶液中通入少量 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
(3)B的结构简式为___________ ;在加热、Cu催化条件下,B被 氧化的化学方程式为
氧化的化学方程式为___________ 。
(4)C中含有的官能团名称为___________ ,C分子中 杂化的原子数与
杂化的原子数与 杂化的原子数之比为
杂化的原子数之比为___________ 。
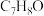 的芳香族化合A、B、C,A能与
的芳香族化合A、B、C,A能与 溶液发生显色反应;B不能与
溶液发生显色反应;B不能与 溶液发生显色反应但可与金属钠反应放出气体;C不能与金属钠反应。请回答下列问题:
溶液发生显色反应但可与金属钠反应放出气体;C不能与金属钠反应。请回答下列问题:(1)A可能的结构有
(2)若A的核磁共振氢谱有4组峰,则A与浓溴水反应的化学方程式为
 ,发生反应的离子方程式为
,发生反应的离子方程式为(3)B的结构简式为
 氧化的化学方程式为
氧化的化学方程式为(4)C中含有的官能团名称为
 杂化的原子数与
杂化的原子数与 杂化的原子数之比为
杂化的原子数之比为
您最近一年使用:0次