1 . 国际化学年的中国宣传口号是“化学——我们的生活,我们的未来”。
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:_______ 。
(2)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:_______ 。
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_______ 。
(4)化学实验中,若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。
①在如下图所示步骤中,发生氧化反应的是_______ (填序号,下同),发生还原反应的是_______ ,既没发生氧化反应又没发生还原反应的是_______ 。(提示:铬元素的化合价有+6、+3)_______ 。
_______K2Cr2O7+_______HCl=_______Cl2↑+_______KCl+_______CrCl3+_______
(5)已知方程式F:KClO3+6HCl(浓)=KCl+3H2O+3Cl2↑。
①请用双线桥法标出电子转移的方向和数目_______ 。
②上述反应中氧化产物和还原产物的质量比为_______ 。
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:
(2)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:
(4)化学实验中,若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。
①在如下图所示步骤中,发生氧化反应的是
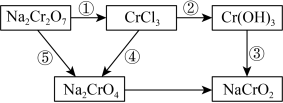
_______K2Cr2O7+_______HCl=_______Cl2↑+_______KCl+_______CrCl3+_______
(5)已知方程式F:KClO3+6HCl(浓)=KCl+3H2O+3Cl2↑。
①请用双线桥法标出电子转移的方向和数目
②上述反应中氧化产物和还原产物的质量比为
您最近一年使用:0次
2 . 回答下列问题。
(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气,已知:
N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ/mol;
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol;
试写出N2H4与 NO2反应的热化学方程式___________ 。
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3(g)的热化学方程式为___________ 。
(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气,已知:
N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ/mol;
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol;
试写出N2H4与 NO2反应的热化学方程式
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3(g)的热化学方程式为
您最近一年使用:0次
名校
3 . 高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
(1)高铁电池的负极材料是___________ 。
(2)放电时,正极发生___________ (填“氧化”或“还原”)反应。
(3)已知负极反应为Zn-2e-+2OH-=Zn(OH)2,则正极反应为___________ 。
(4)放电时,___________ (填“正”或“负”)极附近溶液的碱性增强。
 3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:(1)高铁电池的负极材料是
(2)放电时,正极发生
(3)已知负极反应为Zn-2e-+2OH-=Zn(OH)2,则正极反应为
(4)放电时,
您最近一年使用:0次
2024-02-24更新
|
226次组卷
|
4卷引用:辽宁省六校协作体2017-2018学年高一下学期期中考试化学试卷
名校
4 . 实验室可用 和浓盐酸常温下反应制取氯气,同时生成KCl和水。写出发生反应的化学方程式并用双线桥表示出电子转移方向和数目
和浓盐酸常温下反应制取氯气,同时生成KCl和水。写出发生反应的化学方程式并用双线桥表示出电子转移方向和数目___________ 。氧化剂为___________ ,浓盐酸的作用___________ 。
 和浓盐酸常温下反应制取氯气,同时生成KCl和水。写出发生反应的化学方程式并用双线桥表示出电子转移方向和数目
和浓盐酸常温下反应制取氯气,同时生成KCl和水。写出发生反应的化学方程式并用双线桥表示出电子转移方向和数目
您最近一年使用:0次
名校
解题方法
5 . 某学习小组欲制取氨气并探究其性质。请回答:
(1)实验室利用固体与固体反应制取氨气的化学方程式是___________ 。
(2)①如图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是___________ 。
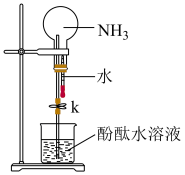
②氨气使烧杯中溶液由无色变为红色,其原因是(用方程式表示)___________ 。
(3)在上图的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是___________。
(1)实验室利用固体与固体反应制取氨气的化学方程式是
(2)①如图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是

②氨气使烧杯中溶液由无色变为红色,其原因是(用方程式表示)
(3)在上图的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是___________。
A.HCl和 | B. 和 和 | C. 和苯 和苯 | D. 和烧碱溶液。 和烧碱溶液。 |
您最近一年使用:0次
名校
6 . t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)计算t℃时该反应平衡常数的值为K=___________ 。
(2)计算该反应在0~3min时间内产物Z的平均反应速率:___________ 。
(3)容器内混合气体的平均相对分子质量比起始投料时___________ 。(填“增大”、“减小”或“不变”)
(4)16min后,改变的条件为___________ 。(注明物质的量)
(5)在温度为T1、T2时,平衡体系中Z的体积分数随压强的变化如图所示。
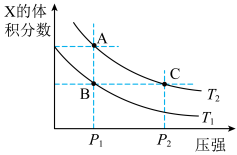
①下列措施一定能增大该反应正反应速率的是___________ ,一定能使平衡向正反应方向移动的是___________ 。
a.升高温度 b.保持容器体积不变,充入惰性气体
c.分离出Z物质 d.缩小容器体积增大压强
②A和C点的正反应速率大小关系为v(A)___________ v(C),T1温度时,B点的正反应速率和逆反应速率大小关系为v正___________ v逆。
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 2.00 | 4.00 | 0 |
| 1 | 1.80 | 3.60 | 0.40 |
| 3 | 1.65 | 3.30 | 0.70 |
| 5 | 1.55 | 3.10 | 0.90 |
| 14 | 1.00 | 2.00 | 2.00 |
| 16 | 1.00 | 2.00 | 2.00 |
| 20 | 0.50 | 4.24 | 3.00 |
| 22 | 0.50 | 4.24 | 3.00 |
(1)计算t℃时该反应平衡常数的值为K=
(2)计算该反应在0~3min时间内产物Z的平均反应速率:
(3)容器内混合气体的平均相对分子质量比起始投料时
(4)16min后,改变的条件为
(5)在温度为T1、T2时,平衡体系中Z的体积分数随压强的变化如图所示。

①下列措施一定能增大该反应正反应速率的是
a.升高温度 b.保持容器体积不变,充入惰性气体
c.分离出Z物质 d.缩小容器体积增大压强
②A和C点的正反应速率大小关系为v(A)
您最近一年使用:0次
名校
解题方法
7 . Cu2O是一种半导体材料,实验室用铅酸蓄电池电解一定浓度的NaOH溶液制备Cu2O,方程式为2Cu+H2O Cu2O+H2↑装置如图所示,回答下列问题。
Cu2O+H2↑装置如图所示,回答下列问题。
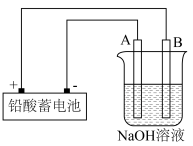
已知铅酸蓄电池的电池反应为PbO2+Pb+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
(1)制备过程中铅酸蓄电池正极电极反应式___________ 。
(2)A、B电极反应式为A:___________ 、B:___________ 。
(3)制备过程中,每生成1molCu2O,电路中转移___________ mol电子,消耗___________ molH2SO4。
 Cu2O+H2↑装置如图所示,回答下列问题。
Cu2O+H2↑装置如图所示,回答下列问题。
已知铅酸蓄电池的电池反应为PbO2+Pb+2H2SO4
 2PbSO4+2H2O
2PbSO4+2H2O(1)制备过程中铅酸蓄电池正极电极反应式
(2)A、B电极反应式为A:
(3)制备过程中,每生成1molCu2O,电路中转移
您最近一年使用:0次
名校
解题方法
8 . 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL1.0mol/L。

(1)判断装置的名称:A为___________ 。
(2)A装置中,Ag电极的电极反应式为:___________ 。
(3)B装置中的电极b极为电极反应式为___________ ,B装置中总反应的离子方程式为___________ 。
(4)一段时间后,当Zn片质量减少6.5g时,b极生成的气体在标准状况下的体积___________ L,CuSO4溶液的质量___________ (填“增加”或“减少”)了___________ g。
(5)一段时间后,当Zn片质量减少29.25g时,a极生成的气体的物质的量为___________ 。

(1)判断装置的名称:A为
(2)A装置中,Ag电极的电极反应式为:
(3)B装置中的电极b极为电极反应式为
(4)一段时间后,当Zn片质量减少6.5g时,b极生成的气体在标准状况下的体积
(5)一段时间后,当Zn片质量减少29.25g时,a极生成的气体的物质的量为
您最近一年使用:0次
名校
9 . 有机物具有广泛的用途。现有下列有机物:①乙烯 ②1,3-丁二烯 ③甲醛 ④油脂请将相应的序号 填入空格内。
(1)能用于制备肥皂的是_______ ;
(2)能用于制备聚乙烯塑料的是_______ ;
(3)能用于制备顺丁橡胶的是_______ ;
(4)能用于制备酚醛树脂的是_______ ;
(5)为室内主要污染物的有毒的是_______ 。
(1)能用于制备肥皂的是
(2)能用于制备聚乙烯塑料的是
(3)能用于制备顺丁橡胶的是
(4)能用于制备酚醛树脂的是
(5)为室内主要污染物的有毒的是
您最近一年使用:0次
2024-01-11更新
|
75次组卷
|
2卷引用:2018-2019学年度耀华实验学校第二学期高二实验化学期末试卷
名校
解题方法
10 . 把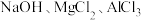 三种固体组成的混合物溶于足量水后有
三种固体组成的混合物溶于足量水后有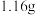 白色沉淀,在所得的悬浊液中逐滴加入
白色沉淀,在所得的悬浊液中逐滴加入 溶液,加入
溶液,加入 溶液的体积
溶液的体积 与生成沉淀的质量
与生成沉淀的质量 的关系如图所示。
的关系如图所示。

(1)A点沉淀物的化学式为_____ ;B点沉淀物的化学式为_____ 。
(2)原混合物中的 的物质的量为
的物质的量为_____ , 的物质的量为
的物质的量为_____ ,NaOH的物质的量为_____ 。
(3)HCl溶液在C点的加入量是_____ 。
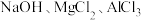 三种固体组成的混合物溶于足量水后有
三种固体组成的混合物溶于足量水后有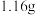 白色沉淀,在所得的悬浊液中逐滴加入
白色沉淀,在所得的悬浊液中逐滴加入 溶液,加入
溶液,加入 溶液的体积
溶液的体积 与生成沉淀的质量
与生成沉淀的质量 的关系如图所示。
的关系如图所示。
(1)A点沉淀物的化学式为
(2)原混合物中的
 的物质的量为
的物质的量为 的物质的量为
的物质的量为(3)HCl溶液在C点的加入量是
您最近一年使用:0次



