1 . 实验室有一瓶密封不严的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol·L-1HCl、品红溶液、新制澄清石灰水。
(1)[提出假设]假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含___ ;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3。
(2)[进行实验]在答题卡上完成下表(不必检验Ca2+、Cl-):
(1)[提出假设]假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3。
(2)[进行实验]在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 | 预期现象和结论 | |
| ① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管 | 若无气体放出且澄清石灰水未见浑浊,则假设一成立, |
| ② | ||
| ③ | ||
您最近一年使用:0次
2 . 铁及其化合物与生活密切相关,古代炼丹家以绿矾(FeSO4·7H2O为原料,放在炼丹炉中煅烧可制得绿矾油。绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈。右图是2. 78 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g。


(1)绿矾油主要成份的化学式为 。t1~t2.发生反应的化学方程式为 。
(2)若将28.8 g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到14.4 g黑色细粉,则可推知该黑色细粉为 。
(3)以下是FeSO4·7H2O的实验室制备流理图

根据题意完成下列填空:
①反应II需要100 mL1. 5 mol·L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1. 84 g·cm -3的浓H2SO4配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 。
②操作A的名称为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取6.0 g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.2000 mol·L -1KMnO4溶液滴定,消耗KMnO4溶液的体积为20. 00 mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。


(1)绿矾油主要成份的化学式为 。t1~t2.发生反应的化学方程式为 。
(2)若将28.8 g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到14.4 g黑色细粉,则可推知该黑色细粉为 。
(3)以下是FeSO4·7H2O的实验室制备流理图

根据题意完成下列填空:
①反应II需要100 mL1. 5 mol·L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1. 84 g·cm -3的浓H2SO4配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 。
②操作A的名称为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取6.0 g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.2000 mol·L -1KMnO4溶液滴定,消耗KMnO4溶液的体积为20. 00 mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。
您最近一年使用:0次
3 . 高铁酸钾(K2FeO4)是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法。(已知:Fe3++3H2O⇌Fe(OH)3+3H+)
(1)高铁酸钾可用于杀菌消毒,是因为它具有强___________ 性。
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为________ 。这种分散系区分于其他分散系的最本质区别是_________ 。
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______ +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。
①完成上述离子方程式:___________ 。
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为___________ 。(计算结果保留到0.1%)
湿法制备高铁酸钾的流程如下图。
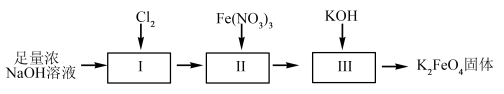
(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。___________ ,反应每生成1molCl-转移的电子数目为___________ 。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

(1)高铁酸钾可用于杀菌消毒,是因为它具有强
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______
 +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。①完成上述离子方程式:
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为
湿法制备高铁酸钾的流程如下图。

(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

| A.24℃,75g∙L-1 | B.26℃,75g∙L-1 | C.28℃,75g∙L-1 | D.22℃,80g∙L-1 |
您最近一年使用:0次
4 . 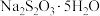 俗称“大苏打”,它是一种常用的试剂.
俗称“大苏打”,它是一种常用的试剂.
(1)工业上,常用 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为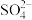 .写出离子方程式:
.写出离子方程式:__________________ .理论上,能发生的氧化还原反应都可以设计成原电池.如果将上述反应设计成原电池,则正极反应式为____________ .
(2)已知: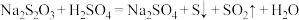
某小组设计实验探究影响化学反应速率的外界因素:
①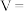
_________ ,设计实验I,Ⅱ的目的是_________ .
②实验测得: .由实验I、Ⅲ得出结论是
.由实验I、Ⅲ得出结论是________________ .
③根据表格信息,__________ (填“能”或“不能”)比较a和d的大小,原因是________ .
(3)已知: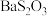 是白色难溶物.大苏打易变质生成
是白色难溶物.大苏打易变质生成 .设计实验证明某大苏打样品是否变质:
.设计实验证明某大苏打样品是否变质:__________________ .
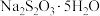 俗称“大苏打”,它是一种常用的试剂.
俗称“大苏打”,它是一种常用的试剂.(1)工业上,常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为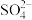 .写出离子方程式:
.写出离子方程式:(2)已知:
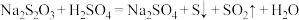
某小组设计实验探究影响化学反应速率的外界因素:
| 序号 | 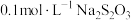 溶液 溶液 | 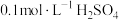 溶液 溶液 | 蒸馏水 | 温度 | 变浑浊时间 |
| I |  |  | 0 | 35℃ | a s |
| II |  | 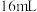 | V mL | 35℃ | b s |
| III |  |  | 0 | 45℃ | c s |
| IV |  | 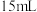 | 5 mL | 40℃ | d s |
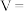
②实验测得:
 .由实验I、Ⅲ得出结论是
.由实验I、Ⅲ得出结论是③根据表格信息,
(3)已知:
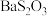 是白色难溶物.大苏打易变质生成
是白色难溶物.大苏打易变质生成 .设计实验证明某大苏打样品是否变质:
.设计实验证明某大苏打样品是否变质:
您最近一年使用:0次
5 . 草酸亚铁晶体(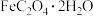 ,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。
,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。

(1)按照气流从左到右的方向,上述装置的接口顺序为A→_______ →尾气处理装置(仪器可重复使用)。
(2)实验证明了气体产物中含有 ,依据的实验现象为
,依据的实验现象为_______ 。
(3)实验证明了气体产物中含有CO,依据的实验现象为_______ 。
(4)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为_______ 。
(5)工业制得的草酸亚铁晶体中常含有 杂质,测定其纯度的步骤如下:
杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品溶于稀 中,配成250 mL溶液;
中,配成250 mL溶液;
步骤2:取上述溶液25.00 mL,用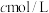
 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 ;
;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀 ,再用
,再用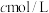
 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 。
。
①步骤2中滴定终点的现象为_______ 。
②该样品中草酸亚铁晶体的质量分数的表达式为_______ 。
③若步骤1配制溶液时部分 被氧化变质,则测定结果将
被氧化变质,则测定结果将_______ (填“偏高”“偏低”或“不变”)。
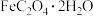 ,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。
,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。
(1)按照气流从左到右的方向,上述装置的接口顺序为A→
(2)实验证明了气体产物中含有
 ,依据的实验现象为
,依据的实验现象为(3)实验证明了气体产物中含有CO,依据的实验现象为
(4)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(5)工业制得的草酸亚铁晶体中常含有
 杂质,测定其纯度的步骤如下:
杂质,测定其纯度的步骤如下:步骤1:称取m g草酸亚铁晶体样品溶于稀
 中,配成250 mL溶液;
中,配成250 mL溶液;步骤2:取上述溶液25.00 mL,用
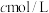
 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 ;
;步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀
 ,再用
,再用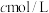
 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 。
。①步骤2中滴定终点的现象为
②该样品中草酸亚铁晶体的质量分数的表达式为
③若步骤1配制溶液时部分
 被氧化变质,则测定结果将
被氧化变质,则测定结果将
您最近一年使用:0次
2022-12-16更新
|
191次组卷
|
2卷引用:辽宁省大连市滨城联盟2022-2023学年高三上学期期中(‖)考试化学试题
解题方法
6 . 漂白粉的主要成分是次氯酸钙和氯化钙。请回答下列问题:
(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式(若涉及氧化还原反应,请标注电子转移情况):____________________________ 。
(2)某化学小组将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,共收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为_____________ (假设漂白粉中的其它成份不与硝酸反应)。
(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式(若涉及氧化还原反应,请标注电子转移情况):
(2)某化学小组将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,共收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为
您最近一年使用:0次
解题方法
7 . 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O,相对分子质量392]晶体又称莫尔盐,易溶易电离但却比一般的亚铁盐稳定,因此广泛应用于制药、电镀以及定量分析。回答下列与之有关的问题:
(1)在莫尔盐所涉及的五种元素中:
①S元素在门捷列夫元素周期表中的位置是______________ ;
②其中处于同主族的两种元素非金属性更强的是:_____________ 。
(2)为检验莫尔盐是否变质,可用的试剂为_______________ 。
碘是合成人体甲状腺激素的重要原料,食盐中加KIO3是我国为解决普遍性碘缺乏问题的国家规定,下图是自动电位滴定法测定食盐中碘含量的实验过程:
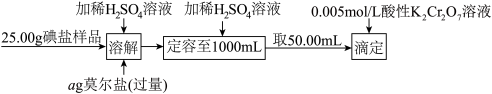
(3)已知“溶解”过程中IO3-的还原产物为碘单质,写出该反应的离子反应方程式:______________________________ 。
(4)取50. 00 mL样品,用0.005 mol/L酸性K2Cr2O7溶液滴定剩余Fe2+,滴定操作时使用的锥形瓶未干燥,导致结果_____________ (填“偏大”“偏小”或“无影响”)
(1)在莫尔盐所涉及的五种元素中:
①S元素在门捷列夫元素周期表中的位置是
②其中处于同主族的两种元素非金属性更强的是:
(2)为检验莫尔盐是否变质,可用的试剂为
碘是合成人体甲状腺激素的重要原料,食盐中加KIO3是我国为解决普遍性碘缺乏问题的国家规定,下图是自动电位滴定法测定食盐中碘含量的实验过程:

(3)已知“溶解”过程中IO3-的还原产物为碘单质,写出该反应的离子反应方程式:
(4)取50. 00 mL样品,用0.005 mol/L酸性K2Cr2O7溶液滴定剩余Fe2+,滴定操作时使用的锥形瓶未干燥,导致结果
您最近一年使用:0次
8 . 某化工厂用氯气与石灰乳生产漂白粉.该厂出厂产品说明书如下:

(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的2个化学反应方程式:
①___________________ ;
②_________________ .
(2)某实验室研究员将完全变质后的漂白粉溶于水,往其中加入足量稀硝酸,收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为____________ .(假设漂白粉中的其它成份不与稀硝酸反应)

(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的2个化学反应方程式:
①
②
(2)某实验室研究员将完全变质后的漂白粉溶于水,往其中加入足量稀硝酸,收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为
您最近一年使用:0次
解题方法
9 . 一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s),完成下列填空:
KCl(l)+NaAlSi3O8(s),完成下列填空:
(1)上述反应涉及的第三周期元素中,离子半径最小的是___ ;Cl原子与Si原子可构成有5个原子核的分子,其分子的空间构型为____ 。
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态_____ 。
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为__ ;NaAlSi3O8改写成氧化物形式是___ 。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
分析数据可以得出,氯化钠熔浸钾长石是__________ 反应(填“放热”或“吸热”);在950℃时,欲提高熔出钾的速率可以采取的一种措施是_______ 。
(5)Na(l)+KCl(l) NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是___ 。
(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为_____ 。
 KCl(l)+NaAlSi3O8(s),完成下列填空:
KCl(l)+NaAlSi3O8(s),完成下列填空:(1)上述反应涉及的第三周期元素中,离子半径最小的是
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
| 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
| 950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
(5)Na(l)+KCl(l)
 NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
10 . 某科研小组对乙醛与新制Cu(OH)2反应的实验进行探究。文献资料:
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O Cu+Cu2+。
Cu+Cu2+。
Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
(1)实验ⅰ中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4的化学方程式___________ 。
(2)实验ⅰ、ⅱ、ⅲ中,实验___________ 的新制Cu(OH)2浊液与乙醛反应生成了Cu2O。
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
① 由实验ⅳ的现象推测:实验ⅱ的黑色沉淀是___________ 。
② 实验ⅴ能够产生砖红色沉淀的原因是___________ (结合微粒符号解释),写出实验ⅴ中该微粒与乙醛发生反应的方程式___________ 。
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:___________ ,加热,无色溶液先变为亮黄色,逐渐加深为橙黄色。
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式___________ 。
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是___________ 。
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O
 Cu+Cu2+。
Cu+Cu2+。Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
| 序号 | 5% CuSO4 溶液体积 | 10% NaOH 溶液的体积 | 振荡后现象 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅰ | 2 mL | 5滴 | 浅蓝绿色沉淀 | 仍然为浅蓝绿色沉淀 |
| ⅱ | 2 mL | 0.5 mL | 浅蓝色沉淀 | 浅蓝色沉淀→黑色沉淀 |
| ⅲ | 5滴 | 2 mL | 蓝色浊液 | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
(2)实验ⅰ、ⅱ、ⅲ中,实验
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
| 序号 | 实验 | 加入试剂 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅳ |
| 3 mL H2O | 蓝色沉淀→黑色沉淀 |
| ⅴ | 3 mL 10% NaOH | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
② 实验ⅴ能够产生砖红色沉淀的原因是
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是
您最近一年使用:0次
2023-07-10更新
|
204次组卷
|
4卷引用:北京市石景山区2022-2023学年高二下学期期末考试化学试题
北京市石景山区2022-2023学年高二下学期期末考试化学试题北京市顺义区杨镇第一中学2023-2024学年高三上学期第一次月考化学试题名校期末好题汇编-烃的衍生物(非选择题)(已下线)题型突破02 有机实验(综合题)-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)