解题方法
1 . 甘氨酸亚铁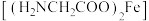 是一种补血剂,工业上用赤铁矿
是一种补血剂,工业上用赤铁矿 (含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:

已知:甘氨酸(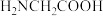 ),易溶于水,微溶于乙醇,具有两性。滤渣1成份为
),易溶于水,微溶于乙醇,具有两性。滤渣1成份为 。
。
回答下列问题:
(1)“碱浸”去除的元素是___________ 。(填化学式)
(2)“还原”时的还原产物是___________ 。(填化学式)
(3)“沉淀”的离子方程式___________ ,“副产品”是___________ (写名称)
(4)柠檬酸的作用防止 氧化,“反应”的化学方程式为
氧化,“反应”的化学方程式为___________ 。
(5) 是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是
是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是______ 。
(6)某同学通过如下实验测定该补血剂中 的含量:
的含量:
①配制:用分析天平称取
 样品,再用煮沸并冷却的蒸馏水配制
样品,再用煮沸并冷却的蒸馏水配制 溶液。配制时还需要的定量仪器是
溶液。配制时还需要的定量仪器是___________ 。
②滴定:用酸化的 溶液滴定用
溶液滴定用
移液管移取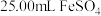 溶液于锥形瓶中,用
溶液于锥形瓶中,用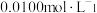 的
的 ,溶液滴定,平行滴定3次,
,溶液滴定,平行滴定3次, 溶液的平均用量为
溶液的平均用量为 ,则样品
,则样品 的质量分数为
的质量分数为___________ 。
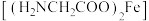 是一种补血剂,工业上用赤铁矿
是一种补血剂,工业上用赤铁矿 (含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
已知:甘氨酸(
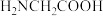 ),易溶于水,微溶于乙醇,具有两性。滤渣1成份为
),易溶于水,微溶于乙醇,具有两性。滤渣1成份为 。
。回答下列问题:
(1)“碱浸”去除的元素是
(2)“还原”时的还原产物是
(3)“沉淀”的离子方程式
(4)柠檬酸的作用防止
 氧化,“反应”的化学方程式为
氧化,“反应”的化学方程式为(5)
 是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是
是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是(6)某同学通过如下实验测定该补血剂中
 的含量:
的含量:①配制:用分析天平称取

 样品,再用煮沸并冷却的蒸馏水配制
样品,再用煮沸并冷却的蒸馏水配制 溶液。配制时还需要的定量仪器是
溶液。配制时还需要的定量仪器是②滴定:用酸化的
 溶液滴定用
溶液滴定用移液管移取
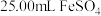 溶液于锥形瓶中,用
溶液于锥形瓶中,用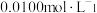 的
的 ,溶液滴定,平行滴定3次,
,溶液滴定,平行滴定3次, 溶液的平均用量为
溶液的平均用量为 ,则样品
,则样品 的质量分数为
的质量分数为
您最近一年使用:0次
2 . 实验室有一瓶密封不严的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol·L-1HCl、品红溶液、新制澄清石灰水。
(1)[提出假设]假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含___ ;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3。
(2)[进行实验]在答题卡上完成下表(不必检验Ca2+、Cl-):
(1)[提出假设]假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3。
(2)[进行实验]在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 | 预期现象和结论 | |
| ① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管 | 若无气体放出且澄清石灰水未见浑浊,则假设一成立, |
| ② | ||
| ③ | ||
您最近一年使用:0次
2013·山东滨州·一模
解题方法
3 . (1)某学习小组利用下图装置制取氯气并探究其性质。
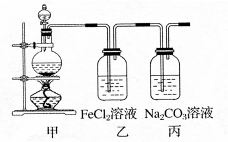
①甲装置中反应的化学方程式是_____________________________________ ;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)__________________________________________________________ ;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是____________________________________ 。
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含________________ ;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):

①甲装置中反应的化学方程式是
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 | 预期现象和结论 | |
| ① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管 | 若无气体放出且澄清石灰水未见浑浊,则假设一成立; |
| ② | ||
您最近一年使用:0次
4 . 铁及其化合物与生活密切相关,古代炼丹家以绿矾(FeSO4·7H2O为原料,放在炼丹炉中煅烧可制得绿矾油。绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈。右图是2. 78 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g。


(1)绿矾油主要成份的化学式为 。t1~t2.发生反应的化学方程式为 。
(2)若将28.8 g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到14.4 g黑色细粉,则可推知该黑色细粉为 。
(3)以下是FeSO4·7H2O的实验室制备流理图

根据题意完成下列填空:
①反应II需要100 mL1. 5 mol·L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1. 84 g·cm -3的浓H2SO4配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 。
②操作A的名称为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取6.0 g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.2000 mol·L -1KMnO4溶液滴定,消耗KMnO4溶液的体积为20. 00 mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。


(1)绿矾油主要成份的化学式为 。t1~t2.发生反应的化学方程式为 。
(2)若将28.8 g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到14.4 g黑色细粉,则可推知该黑色细粉为 。
(3)以下是FeSO4·7H2O的实验室制备流理图

根据题意完成下列填空:
①反应II需要100 mL1. 5 mol·L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1. 84 g·cm -3的浓H2SO4配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 。
②操作A的名称为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取6.0 g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.2000 mol·L -1KMnO4溶液滴定,消耗KMnO4溶液的体积为20. 00 mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。
您最近一年使用:0次
名校
5 . A、B、C、D、E五种物质的焰色试验都呈黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有可燃性,B与水反应放出的气体具有助燃性,同时都生成C的溶液,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D。
(1)写出A+H2O→C的化学方程式:___________ 。
(2)写出B+H2O→C的化学方程式:___________ 。
(3)写出E→D的化学方程式:___________ 。
(4)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式___________ ,___________ 。
(5)某实验室研究员将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为___________ (假设漂白粉中的其它成份不与硝酸反应)。
(6)将14gNa2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12L,所得溶液的体积为400mL。试计算:原混合物中Na2O的质量为___________ g,所得溶液的物质的量浓度为___________ mol·L-1。
(1)写出A+H2O→C的化学方程式:
(2)写出B+H2O→C的化学方程式:
(3)写出E→D的化学方程式:
(4)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式
(5)某实验室研究员将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为
(6)将14gNa2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12L,所得溶液的体积为400mL。试计算:原混合物中Na2O的质量为
您最近一年使用:0次
6 . 下列有关物质的检验方法和结论都正确的是
| A.检验还原铁粉是否变质,取样品溶于盐酸,滴加KSCN,溶液未变红,则铁粉也可能已变质 |
B.某溶液中加入 溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解,则该溶液中存在 溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解,则该溶液中存在 |
C.某溶液中加入稀NaOH溶液,没有产生使湿润红色试纸变蓝色的气体,则该溶液中不存在 |
D.铜与足量浓硫酸反应后冷却,在试管中加入少量水,若溶液变为蓝色,则产物中存在 |
您最近一年使用:0次
名校
解题方法
7 . 碳酸亚铁( )是一种重要的工业盐,是制备医用补铁剂的原料。常温下它是一种白色、难溶于水的晶体。在干燥的环境中性质稳定,在潮湿的空气中,易被
)是一种重要的工业盐,是制备医用补铁剂的原料。常温下它是一种白色、难溶于水的晶体。在干燥的环境中性质稳定,在潮湿的空气中,易被 氧化,长期放置后最终转化为
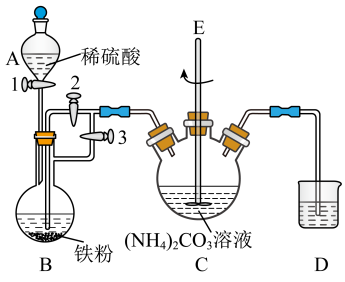
氧化,长期放置后最终转化为 。实验小组通过查阅文献资料设计用下图装置制备少量
。实验小组通过查阅文献资料设计用下图装置制备少量 。
。
①连接装置检查气密性后,先将开关2关闭,然后依次打开开关3和1,将A中稀硫酸滴入B中。
②反应一段时间后,当D中气泡均匀冒出,关闭开关3,打开开关2.使装置B中的溶液进入装置C。
③当装置B中溶液不再进入C后,关闭开关1。
④充分反应后将装置C中生成的固体经过滤、洗涤、干燥。
回答下列问题:
(1)装置B中产生的气体是___________ (化学式),反应开始时持续通入该气体的目的是___________ 。
(2)装置D的作用___________ 。(选择:A.吸收尾气 B.防止空气进入装置影响产物)
(3)步骤④中证明固体洗涤干净的实验方案是___________ 。
II.因存放时间较长,装置密封性缺失导致 发生了变质,某同学设计如下方案对样品的质量百分含量进行测定:
发生了变质,某同学设计如下方案对样品的质量百分含量进行测定:
准确称取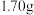 样品,用适量的稀硫酸使其完全溶解配成
样品,用适量的稀硫酸使其完全溶解配成 溶液。量取
溶液。量取 溶液于锥形瓶中,滴加适量磷酸,用
溶液于锥形瓶中,滴加适量磷酸,用 的
的 标准溶液滴定至终点,(离子方程式为:
标准溶液滴定至终点,(离子方程式为: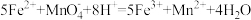 )消耗
)消耗 标准溶液
标准溶液 (重复实验2~3次)。
(重复实验2~3次)。
(4)计算样品中 的质量百分含量为
的质量百分含量为___________ %。(写出必要的计算过程,结果保留到小点数后一位)
 )是一种重要的工业盐,是制备医用补铁剂的原料。常温下它是一种白色、难溶于水的晶体。在干燥的环境中性质稳定,在潮湿的空气中,易被
)是一种重要的工业盐,是制备医用补铁剂的原料。常温下它是一种白色、难溶于水的晶体。在干燥的环境中性质稳定,在潮湿的空气中,易被 氧化,长期放置后最终转化为
氧化,长期放置后最终转化为 。实验小组通过查阅文献资料设计用下图装置制备少量
。实验小组通过查阅文献资料设计用下图装置制备少量 。
。
①连接装置检查气密性后,先将开关2关闭,然后依次打开开关3和1,将A中稀硫酸滴入B中。
②反应一段时间后,当D中气泡均匀冒出,关闭开关3,打开开关2.使装置B中的溶液进入装置C。
③当装置B中溶液不再进入C后,关闭开关1。
④充分反应后将装置C中生成的固体经过滤、洗涤、干燥。
回答下列问题:
(1)装置B中产生的气体是
(2)装置D的作用
(3)步骤④中证明固体洗涤干净的实验方案是
II.因存放时间较长,装置密封性缺失导致
 发生了变质,某同学设计如下方案对样品的质量百分含量进行测定:
发生了变质,某同学设计如下方案对样品的质量百分含量进行测定:准确称取
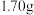 样品,用适量的稀硫酸使其完全溶解配成
样品,用适量的稀硫酸使其完全溶解配成 溶液。量取
溶液。量取 溶液于锥形瓶中,滴加适量磷酸,用
溶液于锥形瓶中,滴加适量磷酸,用 的
的 标准溶液滴定至终点,(离子方程式为:
标准溶液滴定至终点,(离子方程式为: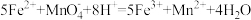 )消耗
)消耗 标准溶液
标准溶液 (重复实验2~3次)。
(重复实验2~3次)。(4)计算样品中
 的质量百分含量为
的质量百分含量为
您最近一年使用:0次
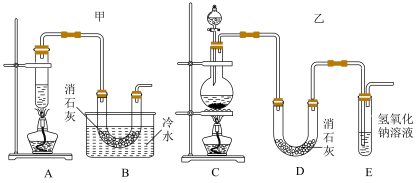
8 . 实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉,制备漂白粉的反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
(1)请写出化学实验室制备氯气的离子反应方程式___________ 。
(2)现有两个同学分别设计的两套实验制备漂白粉,实验装置如图:___________ ,同学们发现制备出的产品中氯化钙含量比预期高,推断该组合中还缺少的装置是___________ 。
(3)此实验所得Ca(ClO)2产率太低。如图为反应后溶液中ClO-、 离子的物质的量n与反应时间t的关系曲线(不考虑氯气和水的反应)。
离子的物质的量n与反应时间t的关系曲线(不考虑氯气和水的反应)。___________ 离子的物质的量随反应时间变化的关系,该石灰乳中Ca(OH)2物质的量为___________ mol
②另取一份含有等物质的量Ca(OH)2的石灰乳,以较大的速率通入足量氯气,充分反应后测得产物中Cl-的物质的量为0.39mol,则产物中n(ClO-):n( )=
)=___________ 。
(4)漂白粉长时间暴露在空气中容易发生变质,为了判断一份久置的漂白粉是否变质及变质程度,甲、乙两位同学分别设计实验进行验证:甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊:他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。
已知:Ca(ClO)2溶液呈碱性:
①漂白粉中的Ca(ClO)2能与空气中的CO2和水蒸气反应,写出该反应的化学方程式___________ 。
②乙同学认为甲同学的实验无法证明漂白粉是否变质,原因是___________ 。
(1)请写出化学实验室制备氯气的离子反应方程式
(2)现有两个同学分别设计的两套实验制备漂白粉,实验装置如图:
(3)此实验所得Ca(ClO)2产率太低。如图为反应后溶液中ClO-、
 离子的物质的量n与反应时间t的关系曲线(不考虑氯气和水的反应)。
离子的物质的量n与反应时间t的关系曲线(不考虑氯气和水的反应)。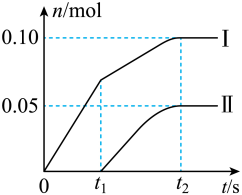
②另取一份含有等物质的量Ca(OH)2的石灰乳,以较大的速率通入足量氯气,充分反应后测得产物中Cl-的物质的量为0.39mol,则产物中n(ClO-):n(
 )=
)=(4)漂白粉长时间暴露在空气中容易发生变质,为了判断一份久置的漂白粉是否变质及变质程度,甲、乙两位同学分别设计实验进行验证:甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊:他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。
已知:Ca(ClO)2溶液呈碱性:
①漂白粉中的Ca(ClO)2能与空气中的CO2和水蒸气反应,写出该反应的化学方程式
②乙同学认为甲同学的实验无法证明漂白粉是否变质,原因是
您最近一年使用:0次
名校
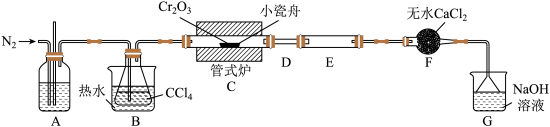
9 . 三氯化铬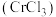 是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为,其实验装置如图所示:
的反应为,其实验装置如图所示:
已知:① (俗称光气)有毒,遇水发生水解;
(俗称光气)有毒,遇水发生水解;
②碱性条件下, 可将
可将 氧化为
氧化为 ;酸性条件下,
;酸性条件下, 将
将 还原为
还原为 。
。
回答下列问题:
(1)基态 原子的简化核外电子排布式为
原子的简化核外电子排布式为___________ 。
(2)无水 的作用是
的作用是___________ 。
(3)装置E用来收集产物。实验过程中若D处出现堵塞,可通过___________ (填操作方法)使实验继续进行。
(4)装置G中发生生成两种盐的反应的化学方程式为___________ 。
(5)测定产品中 质量分数的实验步骤如下:
质量分数的实验步骤如下:
I.取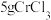 产品,在强碱性条件下,加入过量的
产品,在强碱性条件下,加入过量的 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,继续加热一段时间;
,继续加热一段时间;
II.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使 转化为
转化为 ,再加适量的蒸馏水将溶液稀释至
,再加适量的蒸馏水将溶液稀释至 ;
;
III.取 溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的
溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的 的
的 标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗
标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗 标准溶液
标准溶液 (已知
(已知 被
被 还原为
还原为 )。
)。
①该样品中 的质量分数为
的质量分数为___________  (保留小数点后两位,
(保留小数点后两位,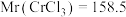 )
)
②下列操作将导致产品中 质量分数测定值偏低的是
质量分数测定值偏低的是___________ (填标号)。
A.步骤I中未继续加热一段时间
B.步骤III中所用 溶液已变质
溶液已变质
C.步骤II中未加浓磷酸
D.步骤III中读数时,滴定前俯视,滴定后平视
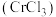 是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为,其实验装置如图所示:
的反应为,其实验装置如图所示:
已知:①
 (俗称光气)有毒,遇水发生水解;
(俗称光气)有毒,遇水发生水解;②碱性条件下,
 可将
可将 氧化为
氧化为 ;酸性条件下,
;酸性条件下, 将
将 还原为
还原为 。
。回答下列问题:
(1)基态
 原子的简化核外电子排布式为
原子的简化核外电子排布式为(2)无水
 的作用是
的作用是(3)装置E用来收集产物。实验过程中若D处出现堵塞,可通过
(4)装置G中发生生成两种盐的反应的化学方程式为
(5)测定产品中
 质量分数的实验步骤如下:
质量分数的实验步骤如下:I.取
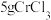 产品,在强碱性条件下,加入过量的
产品,在强碱性条件下,加入过量的 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,继续加热一段时间;
,继续加热一段时间;II.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使
 转化为
转化为 ,再加适量的蒸馏水将溶液稀释至
,再加适量的蒸馏水将溶液稀释至 ;
;III.取
 溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的
溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的 的
的 标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗
标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗 标准溶液
标准溶液 (已知
(已知 被
被 还原为
还原为 )。
)。①该样品中
 的质量分数为
的质量分数为 (保留小数点后两位,
(保留小数点后两位,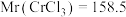 )
)②下列操作将导致产品中
 质量分数测定值偏低的是
质量分数测定值偏低的是A.步骤I中未继续加热一段时间
B.步骤III中所用
 溶液已变质
溶液已变质C.步骤II中未加浓磷酸
D.步骤III中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
10 . 高铁酸钾(K2FeO4)是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法。(已知:Fe3++3H2O⇌Fe(OH)3+3H+)
(1)高铁酸钾可用于杀菌消毒,是因为它具有强___________ 性。
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为________ 。这种分散系区分于其他分散系的最本质区别是_________ 。
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______ +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。
①完成上述离子方程式:___________ 。
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为___________ 。(计算结果保留到0.1%)
湿法制备高铁酸钾的流程如下图。
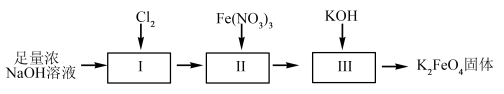
(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。___________ ,反应每生成1molCl-转移的电子数目为___________ 。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

(1)高铁酸钾可用于杀菌消毒,是因为它具有强
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______
 +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。①完成上述离子方程式:
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为
湿法制备高铁酸钾的流程如下图。

(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

| A.24℃,75g∙L-1 | B.26℃,75g∙L-1 | C.28℃,75g∙L-1 | D.22℃,80g∙L-1 |
您最近一年使用:0次



