名校
解题方法
1 . 草酸亚铁晶体(FeC2O4•2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。南宁三中实验小组对其进行了一系列探究。采用如图装置进行实验。
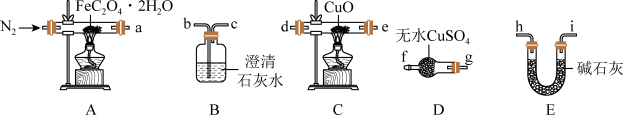
(1)为验证FeC2O4•2H2O的分解的气态产物,按照气流从左到右的方向,上述装置的连接顺序为A→_______ →尾气处理装置(仪器可重复使用)。
(2)实验证明了气体产物中含有CO,依据的实验现象为_______ 。
(3)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为_______ 。
(4)工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol/LKMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol/LKMnO4标准溶液滴定至终点,消耗标准液V2mL。
①步骤2中滴定终点的现象为_______ ;步骤3加入锌粉的目的_______ 。
②该样品中草酸亚铁晶体的质量分数的计算式为_______ 。
③若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将_______ (填“偏高”“偏低”或“不变”)。

(1)为验证FeC2O4•2H2O的分解的气态产物,按照气流从左到右的方向,上述装置的连接顺序为A→
(2)实验证明了气体产物中含有CO,依据的实验现象为
(3)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(4)工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol/LKMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol/LKMnO4标准溶液滴定至终点,消耗标准液V2mL。
①步骤2中滴定终点的现象为
②该样品中草酸亚铁晶体的质量分数的计算式为
③若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将
您最近一年使用:0次
名校
2 . 下列方案设计、现象和结论都正确的是
目的 | 方案设计 | 现象和结论 | |
A | 探究食品脱氧剂中还原铁粉是否变质 | 取少量样品溶于盐酸,滴加 溶液 溶液 | 溶液未变红,说明铁粉未变质 |
B | 证明乙烯的氧化反应 | 将乙烯通入盛有溴水的试管中 | 溴水褪色,说明乙烯被溴水氧化 |
C | 检验某气体是否为 | 将该气体通入到品红溶液中 | 品红溶液褪色,说明该气体是 |
D | 比较 、 、 的 的 大小 大小 | 向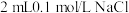 溶液中滴加2滴同浓度 溶液中滴加2滴同浓度 溶液,振荡后再加入4滴同浓度 溶液,振荡后再加入4滴同浓度 溶液 溶液 | 先产生白色沉淀,后产生黄色沉淀,说明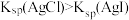 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 对于下列实验操作和现象,其结论正确的是
选项 | 操作 | 现象 | 结论 |
A | 向盛有 水的锥形瓶中小心滴加8~10滴 水的锥形瓶中小心滴加8~10滴 | 剧烈反应,液面上有白雾形成,并产生有刺激性气味的气体 |  水解生成氯化氢 水解生成氯化氢和硫酸 |
B | 将 样品溶于稀硫酸后,滴加 样品溶于稀硫酸后,滴加 溶液 溶液 | 溶液变红 | 溶液中含 但不确定 但不确定 样品在实验之前已变质 样品在实验之前已变质 |
C | 向盛有 的 的 溶液中先后滴加2滴 溶液中先后滴加2滴 的 的 溶液和 溶液和 溶液 溶液 | 先生成白色沉淀,后变为黄色沉淀 | 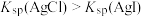 |
D | 将红热的木炭放置于盛有浓硝酸的试管中 | 试管内生成红棕色气体 | 木炭与浓硝酸反应生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 下列方案设计、现象和结论有不正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 相同温度下,等质量的大理石与等体积等浓度的盐酸反应 | 粉状大理石产生气泡更快 | 反应速率:粉状大理石>块状大理石 |
| B | Na2SO3固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 | 若有白色沉淀产生,则样品已经变质 |
| C | 比较CH3COOH和HClO的Ka大小 | 用pH试纸分别0.1mol•L-1CH3COONa溶液和NaClO溶液的pH | 若pH(NaClO)>pH(CH3COONa)则说明Ka(CH3COOH)>Ka(HClO) |
| D | 检验蛋白质性质 | 向鸡蛋清溶液中滴加醋酸铅溶液 | 溶液变浑浊,再加水浑浊不消失说明鸡蛋清溶液发生了变性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 适量的 和焦亚硫酸钠
和焦亚硫酸钠 可用作食品添加剂。回答下列问题:
可用作食品添加剂。回答下列问题:
(1)实验室一般使用 的浓硫酸与
的浓硫酸与 固体反应制备
固体反应制备 气体。
气体。
①该制备原理的化学反应方程式为___________ 。
②实验室里制备适量 气体最合适的发生装置是下图中的
气体最合适的发生装置是下图中的___________ (填写字母)。 在潮湿的空气中易被氧化。
在潮湿的空气中易被氧化。
已知: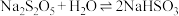
备选试剂:稀盐酸、稀 、
、 溶液、
溶液、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液
①请用上述备选试剂,设计一个简单实验来确认样品已经氧化变质:___________ 。
②写出焦亚硫酸钠在潮湿空气中氧化变质的反应方程式___________ 。
(3)可利用如下简易装置测定空气中 的含量,反应原理为:
的含量,反应原理为: 。
。 ,当观察到
,当观察到___________ 时结束计时,测得耗时 min。假定样品中的
min。假定样品中的 可被溶液充分吸收,则该空气样品中
可被溶液充分吸收,则该空气样品中 的含量是
的含量是___________ 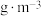 。
。
 和焦亚硫酸钠
和焦亚硫酸钠 可用作食品添加剂。回答下列问题:
可用作食品添加剂。回答下列问题:(1)实验室一般使用
 的浓硫酸与
的浓硫酸与 固体反应制备
固体反应制备 气体。
气体。①该制备原理的化学反应方程式为
②实验室里制备适量
 气体最合适的发生装置是下图中的
气体最合适的发生装置是下图中的A.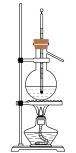 B.
B.  C.
C.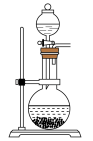 D.
D.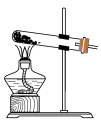
 在潮湿的空气中易被氧化。
在潮湿的空气中易被氧化。已知:
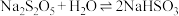
备选试剂:稀盐酸、稀
 、
、 溶液、
溶液、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液①请用上述备选试剂,设计一个简单实验来确认样品已经氧化变质:
②写出焦亚硫酸钠在潮湿空气中氧化变质的反应方程式
(3)可利用如下简易装置测定空气中
 的含量,反应原理为:
的含量,反应原理为: 。
。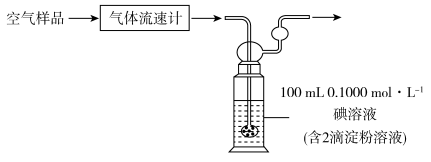
 ,当观察到
,当观察到 min。假定样品中的
min。假定样品中的 可被溶液充分吸收,则该空气样品中
可被溶液充分吸收,则该空气样品中 的含量是
的含量是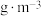 。
。
您最近一年使用:0次
2024-04-30更新
|
124次组卷
|
2卷引用:广西壮族自治区南宁市第二中学2023-2024学年高一下学期4月期中考试化学试题
解题方法
6 . 根据表中的实验操作及现象,所得的实验结论有错误的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向0.01mol•L-1高锰酸钾溶液中滴加0.2mol•L-1H2O2溶液,溶液褪色 | H2O2有还原性 |
| B | 将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液,溶液变红 | 该样品已氧化变质 |
| C | 向2mL0.1mol•L-1ZnSO4溶液中滴入几滴0.1mol•L-1Na2S溶液,有白色沉淀生成,再加入0.1mol•L-1CuSO4溶液,白色沉淀逐渐转化为黑色 | Ksp(CuS)<Ksp(ZnS) |
| D | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 | 尚有未水解淀粉 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 金属钛在航天、医疗等领域有着广泛的应用。工业上用钛铁矿(主要成分为FeTiO3,含有Fe2O3、CaO、SiO2等杂质)为原料制备金属钛的工艺流程如下:
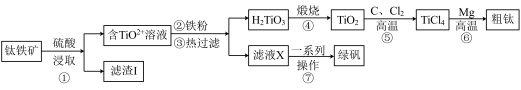
已知:FeTiO3中Fe为+2价;高温下钛易与N2、H2反应。
(1)提高①中浸取反应速率可采取的措施有___________ (答两条)。
(2)“滤渣I”的主要成分为___________ 。
(3)钛铁矿与硫酸发生非氧化还原反应,生成TiOSO4,试写出该反应的化学方程式________ 。
(4)⑥中镁与TiCl4高温下反应制备粗钛时需加保护气,下列可作为保护气的是________ (填标号)。
a.H2 b.Ar c.Cl2 d.N2
(5)⑦中经过“一系列操作”可获得副产品绿矾( ),其过程包括
),其过程包括_____ 、洗涤、干燥。
(6)绿矾易被氧化而变质。现取在空气中放置一段时间的某绿矾样品,请选择合适的试剂,设计实验方案,证明该样品被部分氧化:___________ 。

已知:FeTiO3中Fe为+2价;高温下钛易与N2、H2反应。
(1)提高①中浸取反应速率可采取的措施有
(2)“滤渣I”的主要成分为
(3)钛铁矿与硫酸发生非氧化还原反应,生成TiOSO4,试写出该反应的化学方程式
(4)⑥中镁与TiCl4高温下反应制备粗钛时需加保护气,下列可作为保护气的是
a.H2 b.Ar c.Cl2 d.N2
(5)⑦中经过“一系列操作”可获得副产品绿矾(
 ),其过程包括
),其过程包括(6)绿矾易被氧化而变质。现取在空气中放置一段时间的某绿矾样品,请选择合适的试剂,设计实验方案,证明该样品被部分氧化:
您最近一年使用:0次
名校
8 . SO2和焦亚硫酸钠(Na2S2O5)可用作食品添加剂。回答下列问题:
(1)实验室可用稀H2SO4和NaHSO3固体制取SO2,该反应的化学方程式为_______ ,欲净化与收集SO2,选择必要装置,按气流方向连接顺序为_______ (填仪器接口的字母编号)。
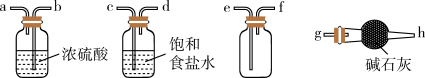
(2)焦亚硫酸钠Na2S2O5)易被氧化而变质,选用下列试剂检验Na2S2O5样品氧化变质的程度,设计并完成实验。请填写下面表格中①~④,完成实验报告:
已知:焦亚硫酸钠溶于水存在平衡:Na2S2O5+H2O⇌2NaHSO3
可选试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
(3)利用下列装置测定空气样本中SO2的含量。
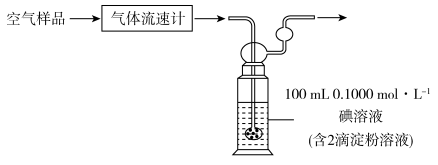
使用上述碘(I2)溶液吸收SO2发生反应的化学方程式为_______ 。若空气流速为am3·min-1,当观察到_______ 时,结束计时,测定耗时tmin。假定样品中的SO2可被溶液完全吸收,该空气样品中SO2的含量是_______ mg·m-3(用含a、t的代数式表示)
(1)实验室可用稀H2SO4和NaHSO3固体制取SO2,该反应的化学方程式为

(2)焦亚硫酸钠Na2S2O5)易被氧化而变质,选用下列试剂检验Na2S2O5样品氧化变质的程度,设计并完成实验。请填写下面表格中①~④,完成实验报告:
已知:焦亚硫酸钠溶于水存在平衡:Na2S2O5+H2O⇌2NaHSO3
可选试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
| 实验编号 | 实验步骤 | 实验现象 | 结论 |
| I | 取少量样品,加入除氧蒸馏水 | 固体完全溶解得到无色溶液 | / |
| II | 取实验I的溶液,① | ② | 样品已氧化变质 |
| III | 另取实验I的溶液,③ | ④ | 样品未完全氧化变质 |

使用上述碘(I2)溶液吸收SO2发生反应的化学方程式为
您最近一年使用:0次
解题方法
9 . 绿矾(FeSO4·xH2O)是自然界存在的一种矿石,翠绿如宝石,很早就引起人们的重视;绿矾焙烧是一种生产硫酸的古老方法。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,若产生___________ 现象,说明该样品已变质。
(2)为测定绿矾中结晶水含量,将石英玻璃管A(带两端开关K1和K2)称重,质量为150.0g,将样品装入石英玻璃管中,再次将装置A称重,质量为177.7g。按如图所示连接好装置进行实验,A中发生的反应为:FeSO4·xH2O FeSO4+xH2O↑。
FeSO4+xH2O↑。
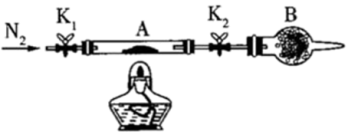
①仪器B的名称是___________ 。
②下列实验操作步骤,正确的顺序为da___________ e;重复上述操作步骤,直至装置A恒重,质量为165.2g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量装置A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=___________ (结果保留到小数点后一位)。
(3)为探究硫酸亚铁高温分解的产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
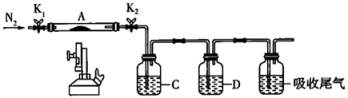
①加热前通入N2的作用是___________ 。
②C中盛有BaCl2溶液,观察到C中有白色沉淀生成,则该沉淀是___________ (填化学式)。
③D中所盛的试剂为品红溶液,观察到溶液褪色。根据上述实验现象,写出硫酸亚铁高温分解的化学反应方程式:___________ 。
(4)绿矾的纯度可通过KMnO4滴定法测定。现称取2.780g绿矾样品,配制成250mL溶液,用硫酸酸化的0.0100mol·L-1的KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
①此滴定实验达到终点的现象是___________ 。
②上表中第一次实验记录数据明显大于后两次,其原因可能是___________ (填字母)。
A.第一次滴定前酸式滴定管尖嘴有气泡,滴定结束无气泡
B.第一次滴定用的锥形瓶用待测液润洗过
C.第一次滴定结束时,俯视读取酸性高锰酸钾溶液的体积
D.后两次滴定所用酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,若产生
(2)为测定绿矾中结晶水含量,将石英玻璃管A(带两端开关K1和K2)称重,质量为150.0g,将样品装入石英玻璃管中,再次将装置A称重,质量为177.7g。按如图所示连接好装置进行实验,A中发生的反应为:FeSO4·xH2O
 FeSO4+xH2O↑。
FeSO4+xH2O↑。
①仪器B的名称是
②下列实验操作步骤,正确的顺序为da
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量装置A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁高温分解的产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①加热前通入N2的作用是
②C中盛有BaCl2溶液,观察到C中有白色沉淀生成,则该沉淀是
③D中所盛的试剂为品红溶液,观察到溶液褪色。根据上述实验现象,写出硫酸亚铁高温分解的化学反应方程式:
(4)绿矾的纯度可通过KMnO4滴定法测定。现称取2.780g绿矾样品,配制成250mL溶液,用硫酸酸化的0.0100mol·L-1的KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 24.52 | 24.02 | 23.98 |
②上表中第一次实验记录数据明显大于后两次,其原因可能是
A.第一次滴定前酸式滴定管尖嘴有气泡,滴定结束无气泡
B.第一次滴定用的锥形瓶用待测液润洗过
C.第一次滴定结束时,俯视读取酸性高锰酸钾溶液的体积
D.后两次滴定所用酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
您最近一年使用:0次
10 . 氨基甲酸铵( )是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
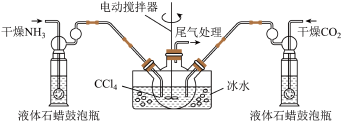
(1)制备氨基甲酸铵的化学方程式为____________
(2)三颈烧瓶用冰水冷却的原因是______________
(3)液体石蜡鼓泡瓶的作用是_______________
(4)水是很好的溶剂,且可以大量吸收反应混合气体,该反应中是否可用水作溶剂:________ (填“是”或“否”),理由:___________
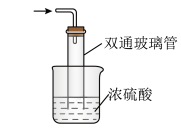
(5)尾气处理装置如图所示,双通玻璃管的作用是_________ ,浓硫酸的作用是________
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为1.00 g。则样品中氨基甲酸铵的质量分数为________
 )是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
(1)制备氨基甲酸铵的化学方程式为
(2)三颈烧瓶用冰水冷却的原因是
(3)液体石蜡鼓泡瓶的作用是
(4)水是很好的溶剂,且可以大量吸收反应混合气体,该反应中是否可用水作溶剂:
(5)尾气处理装置如图所示,双通玻璃管的作用是

(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为1.00 g。则样品中氨基甲酸铵的质量分数为
您最近一年使用:0次



