广西南宁市第二中学2021-2022学年高三下学期5月诊断理科综合化学试题
广西
高三
模拟预测
2022-06-12
873次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、认识化学科学、常见无机物及其应用、物质结构与性质、化学实验基础
广西南宁市第二中学2021-2022学年高三下学期5月诊断理科综合化学试题
广西
高三
模拟预测
2022-06-12
873次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、认识化学科学、常见无机物及其应用、物质结构与性质、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 化学为创造美好生活贡献力量。下列对我国科技成就的有关解读不正确的是
| 选项 | 科技动态 | 化学解读 |
| A | 成功制备高性能新型纤维聚合物锂离子电池 | 该电池可将化学能全部转化成电能 |
| B | 诞生迄今最轻镁同位素(l8Mg) | 该核素含6个中子和12个质子 |
| C | “冰墩墩“的外套材料PC聚碳酸酯的研发 | PC聚碳酸酯属于高分子化合物 |
| D | 发现PM2.5污染治理中NH3减排比NOx更有效 | 回收NH3可以制造氮肥、硝酸等 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
2. 下列实验装置及操作正确的是
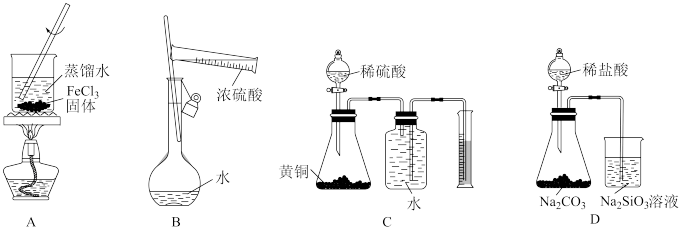

| A.图A:实验室里制取少量的Fe(OH)3胶体 |
| B.图B:配制一定物质的量浓度的H2SO4溶液 |
| C.图C:粗略测黄铜(Cu−Zn)中锌的含量 |
| D.图D:比较氯、碳、硅三种元素的非金属强弱 |
您最近一年使用:0次
2022-03-20更新
|
507次组卷
|
3卷引用:重庆市第十一中学校2021-2022学年高三下学期3月月考化学试题
单选题
|
适中(0.65)
名校
3. 2021年,我国科学家首次在实验室实现 到淀粉的全合成,其合成路线如下:设
到淀粉的全合成,其合成路线如下:设 为阿伏加德罗常数,下列有关说法不正确的是
为阿伏加德罗常数,下列有关说法不正确的是
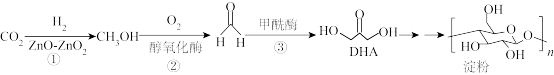
 到淀粉的全合成,其合成路线如下:设
到淀粉的全合成,其合成路线如下:设 为阿伏加德罗常数,下列有关说法不正确的是
为阿伏加德罗常数,下列有关说法不正确的是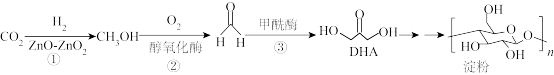
A.标况下,11.2L  中含有共用电子对数目为2 中含有共用电子对数目为2 |
| B.反应②、③无法在高温下进行 |
C.反应②中,3.2g  生成HCHO时转移电子数目为0.2 生成HCHO时转移电子数目为0.2 |
D.1mol DHA与乙酸发生取代反应,可消耗乙酸分子数目为 |
您最近一年使用:0次
2022-03-01更新
|
1432次组卷
|
9卷引用:广东省汕头市2022届高三下学期第一次模拟考试化学试题
广东省汕头市2022届高三下学期第一次模拟考试化学试题(已下线)押广东卷化学第11题 阿伏加德罗常数-备战2022年高考化学临考题号押题(广东卷)北京市通州区2022届高三查缺补漏化学试题北京市顺义牛栏山第一中学2022届高三下学期保温练习化学试题广西南宁市第二中学2021-2022学年高三下学期5月诊断理科综合化学试题北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题北京市顺义区第一中学2022届高三下学期三模化学试题(已下线)第一章 化学计量在实验中的应用(测)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题09 物质的量-备战2023年高考化学母题题源解密(广东卷)
单选题
|
适中(0.65)
名校
4. 下列解释事实的方程式正确的是
| A.向硫酸铜溶液中加入少量铁粉,溶液蓝色变浅:3Cu2++2Fe=2Fe3++3Cu |
| B.向硫化锌灰白色悬浊液中滴加硫酸铜溶液,生成黑色沉淀:ZnS(s)+Cu2+(aq)⇌CuS(s)+Zn2+(aq) |
| C.装有NO2的密闭烧瓶浸泡在冷水中,气体颜色变浅:2NO2⇌N2O4 △H>0 |
D.利用铁电极电解饱和食盐水,电极处有气泡产生:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
5. X、Y、Z和W是四种短周期主族元素,原子序数依次增大,Y的单质与冷水不反应,可以在二氧化碳中燃烧,X、Z同主族,X、Z、W可以构成一种易水解的物质M(如图所示),说法正确的是
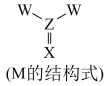

| A.简单离子半径:W>Z |
| B.气态氢化物沸点:X<Z |
| C.W和第三周期离子半径最小的元素形成共价化合物,属于弱电解质 |
| D.将上述物质M和AlCl3·6H2O混合加热,可得无水氯化铝 |
【知识点】 浓度对盐类水解的影响解读 制备与水解有关的物质解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
6. 已知:Ka1(H2SO3)=1.0×10-2、Ka2(H2SO3)=5.0×10-8。室温下,通过下列实验探究Na2SO3、NaHSO3溶液的性质。
实验1:用pH计测得某Na2SO3和NaHSO3混合溶液的pH为7。
实验2:将等体积、等物质的量浓度的Na2SO3和NaHSO3溶液混合,无明显现象。
实验3:向Na2SO3溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
实验4:向NaHSO3溶液中滴加少量Ba(OH)2溶液,产生白色沉淀。
下列说法正确的是
实验1:用pH计测得某Na2SO3和NaHSO3混合溶液的pH为7。
实验2:将等体积、等物质的量浓度的Na2SO3和NaHSO3溶液混合,无明显现象。
实验3:向Na2SO3溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
实验4:向NaHSO3溶液中滴加少量Ba(OH)2溶液,产生白色沉淀。
下列说法正确的是
A.实验1混合溶液中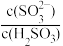 =5.0×104 =5.0×104 |
B.实验2混合后的溶液中存在:3c(Na+)=2[c( )+c( )+c(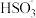 )+c(H2SO3)] )+c(H2SO3)] |
C.实验3中随水的不断加入,溶液中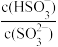 的值逐渐变小 的值逐渐变小 |
D.实验4中反应的离子方程式为Ba2++ =BaSO3↓ =BaSO3↓ |
您最近一年使用:0次
2022-02-15更新
|
537次组卷
|
5卷引用:江苏省南通市通州区2021-2022学年高三上学期期末质量监测化学试题
单选题
|
较难(0.4)
名校
解题方法
7. 双极膜(BM)是一种新型的离子交换复合膜,它是由阴离子交换层和阳离子交换层复合而成。在直流电场作用下,双极膜可将水离解,在膜两侧分别得到 和
和 。工业上用“双极膜双成对电解法”生产乙醛酸
。工业上用“双极膜双成对电解法”生产乙醛酸 ,原理如图所示,装置中阴、阳两极均为情性电极.
,原理如图所示,装置中阴、阳两极均为情性电极.
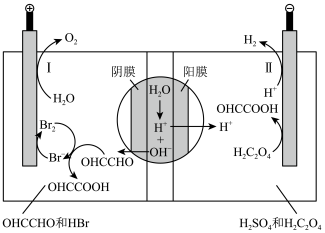
下列说法不正确的是
 和
和 。工业上用“双极膜双成对电解法”生产乙醛酸
。工业上用“双极膜双成对电解法”生产乙醛酸 ,原理如图所示,装置中阴、阳两极均为情性电极.
,原理如图所示,装置中阴、阳两极均为情性电极.
下列说法不正确的是
A.阳极电极反应式之一为: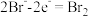 |
B.阴极上草酸发生还原反应: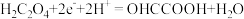 |
C. 的作用是作为支持电解质,增强阳极液的导电能力和充当间接电氧化的媒介 的作用是作为支持电解质,增强阳极液的导电能力和充当间接电氧化的媒介 |
D.若阴阳两极均产生 (标准状况)气体时,理论上可得到乙醛酸 (标准状况)气体时,理论上可得到乙醛酸 |
您最近一年使用:0次
2022-01-13更新
|
1320次组卷
|
3卷引用:重庆市2021-2022学年高三上学期第五次质量检测化学试题
二、解答题 添加题型下试题
解答题-工业流程题
|
较难(0.4)
名校
8. 镉(Cd)可用于制作某些发光电子组件。一种用铜镉废渣(含Cd、Zn、Cu、Fe等单质)为原料制备镉的工艺流程如图。
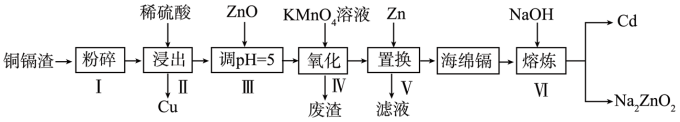
已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算):
回答下列问题:
(1)“步骤II”需隔绝氧气进行的原因是_______ 。“步骤III”使用ZnO调节pH至5,还可以使用_______ (填化学式)代替ZnO达到目的。
(2)“氧化”时,KMnO4的还原产物是MnO2,“步骤IV”中除铁发生的离子方程式为_______ ,该步骤得到的滤渣成分为_______ (填化学式)。
(3)“置换”时,镉置换率与 的关系如下图,其中Zn的理论用量以溶液中Cd2+的量为依据。
的关系如下图,其中Zn的理论用量以溶液中Cd2+的量为依据。
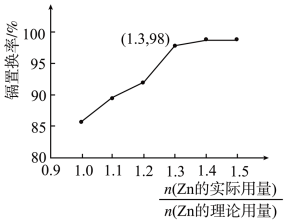
①实际生产中 最佳比值为1.3,不宜超过该比值的原因是
最佳比值为1.3,不宜超过该比值的原因是_______ 。
②若需置换出112kgCd,且使镉置换率达到98%,实际加入的Zn应为_______ kg(计算结果保留一位小数)。
(4)“置换”后,滤液溶质主要成分有_______ (填化学式)。
(5)“熔炼”时,海绵镉(含Cd和Zn)与NaOH固体在反应釜中混合反应,该反应的化学方程式为_______ 。当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的_______ 不同,将Cd从反应釜下口放出,以达到分离的目的。

已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算):
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)“步骤II”需隔绝氧气进行的原因是
(2)“氧化”时,KMnO4的还原产物是MnO2,“步骤IV”中除铁发生的离子方程式为
(3)“置换”时,镉置换率与
 的关系如下图,其中Zn的理论用量以溶液中Cd2+的量为依据。
的关系如下图,其中Zn的理论用量以溶液中Cd2+的量为依据。
①实际生产中
 最佳比值为1.3,不宜超过该比值的原因是
最佳比值为1.3,不宜超过该比值的原因是②若需置换出112kgCd,且使镉置换率达到98%,实际加入的Zn应为
(4)“置换”后,滤液溶质主要成分有
(5)“熔炼”时,海绵镉(含Cd和Zn)与NaOH固体在反应釜中混合反应,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
名校
9. SO2和焦亚硫酸钠(Na2S2O5)可用作食品添加剂。回答下列问题:
(1)实验室可用稀H2SO4和NaHSO3固体制取SO2,该反应的化学方程式为_______ ,欲净化与收集SO2,选择必要装置,按气流方向连接顺序为_______ (填仪器接口的字母编号)。
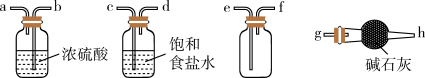
(2)焦亚硫酸钠Na2S2O5)易被氧化而变质,选用下列试剂检验Na2S2O5样品氧化变质的程度,设计并完成实验。请填写下面表格中①~④,完成实验报告:
已知:焦亚硫酸钠溶于水存在平衡:Na2S2O5+H2O⇌2NaHSO3
可选试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
(3)利用下列装置测定空气样本中SO2的含量。
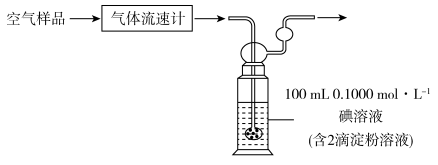
使用上述碘(I2)溶液吸收SO2发生反应的化学方程式为_______ 。若空气流速为am3·min-1,当观察到_______ 时,结束计时,测定耗时tmin。假定样品中的SO2可被溶液完全吸收,该空气样品中SO2的含量是_______ mg·m-3(用含a、t的代数式表示)
(1)实验室可用稀H2SO4和NaHSO3固体制取SO2,该反应的化学方程式为

(2)焦亚硫酸钠Na2S2O5)易被氧化而变质,选用下列试剂检验Na2S2O5样品氧化变质的程度,设计并完成实验。请填写下面表格中①~④,完成实验报告:
已知:焦亚硫酸钠溶于水存在平衡:Na2S2O5+H2O⇌2NaHSO3
可选试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
| 实验编号 | 实验步骤 | 实验现象 | 结论 |
| I | 取少量样品,加入除氧蒸馏水 | 固体完全溶解得到无色溶液 | / |
| II | 取实验I的溶液,① | ② | 样品已氧化变质 |
| III | 另取实验I的溶液,③ | ④ | 样品未完全氧化变质 |

使用上述碘(I2)溶液吸收SO2发生反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
名校
解题方法
10. CO、CO2加氢有利于缓解化石能源消耗,实现“碳中和”.该体系主要涉及以下反应:
反应I:CO(g)+2H2(g) CH3OH(g) ΔH1<0
CH3OH(g) ΔH1<0
反应II:2CO(g)+4H2(g) C2H5OH(g)+H2O(g) ΔH2<0
C2H5OH(g)+H2O(g) ΔH2<0
反应III:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ΔH3<0
C2H5OH(g)+3H2O(g) ΔH3<0
反应IV:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH4<0
CH3OH(g)+H2O(g) ΔH4<0
反应V:2CH3OH(g) C2H5OH(g)+H2O(g) ΔH5
C2H5OH(g)+H2O(g) ΔH5
回答下列问题:
(1)上述反应中,ΔH5=____ (写出一个代数式即可)。
(2)密闭容器中,上述反应体系在一定条件下建立平衡后,下列描述正确的有____ (填标号)。
(3)恒容下,n(CO)=n(CO2)=1mol,并按照不同氢碳比[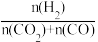 ]投料,发生上述反应。图甲表示不同氢碳比时,[CO+CO2]的总平衡转化率随温度变化的关系;图乙表示氢碳比=3时,平衡后体系中C2H5OH、CH3OH的选择性随温度变化的关系。
]投料,发生上述反应。图甲表示不同氢碳比时,[CO+CO2]的总平衡转化率随温度变化的关系;图乙表示氢碳比=3时,平衡后体系中C2H5OH、CH3OH的选择性随温度变化的关系。
已知:CH3OH的选择性=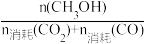 ×100%;C2H5OH的选择性=
×100%;C2H5OH的选择性=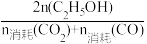 ×100%
×100%
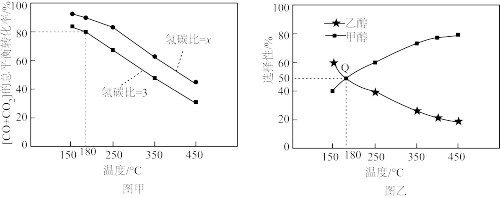
①图甲中x____ 3(填“大于”“小于”或“等于”),其原因是____ 。
②Q点对应的体系中n(CH3OH)=___ mol;此时,H2转化了4mol,则反应2CH3OH(g) C2H5OH(g)+H2O(g)的平衡常数Kp=
C2H5OH(g)+H2O(g)的平衡常数Kp=____ (Kp为以分压表示的平衡常数,分压=总压×物质的量分数,结果保留两位有效数字)。
(4)常温常压下,以Ag为催化剂,在酸性水溶液中将CO2电催化还原为CO的反应历程如图所示:
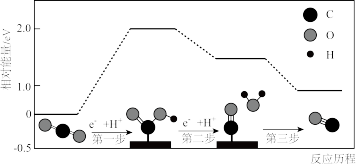
①据图,CO和CO2相比,____ (填化学式)更稳定。
②吸附在催化剂表面上的物种用*标注,图中第一步反应为CO2+e-+H+=*COOH,则第二步反应为____ 。
反应I:CO(g)+2H2(g)
 CH3OH(g) ΔH1<0
CH3OH(g) ΔH1<0反应II:2CO(g)+4H2(g)
 C2H5OH(g)+H2O(g) ΔH2<0
C2H5OH(g)+H2O(g) ΔH2<0反应III:2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g) ΔH3<0
C2H5OH(g)+3H2O(g) ΔH3<0反应IV:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH4<0
CH3OH(g)+H2O(g) ΔH4<0反应V:2CH3OH(g)
 C2H5OH(g)+H2O(g) ΔH5
C2H5OH(g)+H2O(g) ΔH5回答下列问题:
(1)上述反应中,ΔH5=
(2)密闭容器中,上述反应体系在一定条件下建立平衡后,下列描述正确的有
| A.加入催化剂,可提高CO2的平衡转化率 |
| B.降低温度,反应Ⅱ的正反应速率增大,逆反应速率减小 |
| C.增大CO的浓度,反应Ⅲ、IV的平衡均向左移动 |
| D.恒温恒容充入氩气,反应Ⅰ、Ⅱ的平衡不移动 |
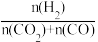 ]投料,发生上述反应。图甲表示不同氢碳比时,[CO+CO2]的总平衡转化率随温度变化的关系;图乙表示氢碳比=3时,平衡后体系中C2H5OH、CH3OH的选择性随温度变化的关系。
]投料,发生上述反应。图甲表示不同氢碳比时,[CO+CO2]的总平衡转化率随温度变化的关系;图乙表示氢碳比=3时,平衡后体系中C2H5OH、CH3OH的选择性随温度变化的关系。已知:CH3OH的选择性=
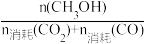 ×100%;C2H5OH的选择性=
×100%;C2H5OH的选择性=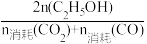 ×100%
×100%
①图甲中x
②Q点对应的体系中n(CH3OH)=
 C2H5OH(g)+H2O(g)的平衡常数Kp=
C2H5OH(g)+H2O(g)的平衡常数Kp=(4)常温常压下,以Ag为催化剂,在酸性水溶液中将CO2电催化还原为CO的反应历程如图所示:

①据图,CO和CO2相比,
②吸附在催化剂表面上的物种用*标注,图中第一步反应为CO2+e-+H+=*COOH,则第二步反应为
您最近一年使用:0次
2022-04-23更新
|
1587次组卷
|
6卷引用:广东省深圳市2022届高三下学期第二次调研考化学试题
广东省深圳市2022届高三下学期第二次调研考化学试题(已下线)押广东卷化学第19题 化学反应原理综合题-备战2022年高考化学临考题号押题(广东卷)广西南宁市第二中学2021-2022学年高三下学期5月诊断理科综合化学试题(已下线)专题18 化学反应原理综合题-备战2023年高考化学母题题源解密(广东卷)山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题广东广雅中学2023届高三下学期2月阶段测试化学试题
解答题-结构与性质
|
较难(0.4)
名校
11. 金属铜在电力工业和科研领域中的应用广泛,科学家对于铜元素的研究不断深入。请回答下列问题:
(1)基态Cu原子的价电子排布式为_______ 。
(2)已知:高温下Cu2O比CuO稳定。从核外电子排布角度解释高温下Cu2O更稳定的原因为_______ 。
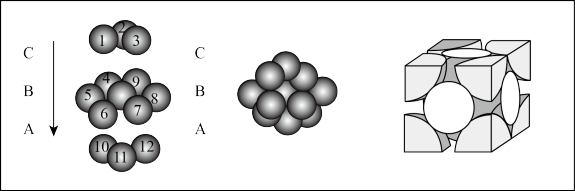
(3)铜晶体中铜原子的堆积方式如图所示,则晶体铜原子的堆积方式为_______ 。
(4)当黄铜受到氨腐蚀时,会生成四氨合铜络合物,出现“龟裂”现象。
①[Cu(NH3)4]2+中各元素电负性由大到小的顺序为_____ ,其中N原子的杂化轨道类型为_____ 。
②[Cu(NH3)4]2+中NH3的键角比独立存在的NH3分子结构中的键角_______ (填“大”或“小”)。
③1mol[Cu(NH3)4]2+中存在_______ 个σ键(用阿伏加德罗常数的数值用NA表示)。
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(白球代表铜原子)。
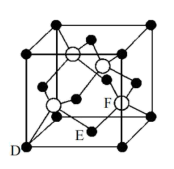
①该晶体的化学式为_______ 。
②已知该晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_______ pm(写出计算式)。
(1)基态Cu原子的价电子排布式为
(2)已知:高温下Cu2O比CuO稳定。从核外电子排布角度解释高温下Cu2O更稳定的原因为
(3)铜晶体中铜原子的堆积方式如图所示,则晶体铜原子的堆积方式为

(4)当黄铜受到氨腐蚀时,会生成四氨合铜络合物,出现“龟裂”现象。
①[Cu(NH3)4]2+中各元素电负性由大到小的顺序为
②[Cu(NH3)4]2+中NH3的键角比独立存在的NH3分子结构中的键角
③1mol[Cu(NH3)4]2+中存在
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(白球代表铜原子)。

①该晶体的化学式为
②已知该晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为
您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
名校
12. 间氨基苯乙炔(K)是新型抗肿瘤药物盐酸厄洛替尼的关键中间体。用苯为原料的合成路线之一如图所示:
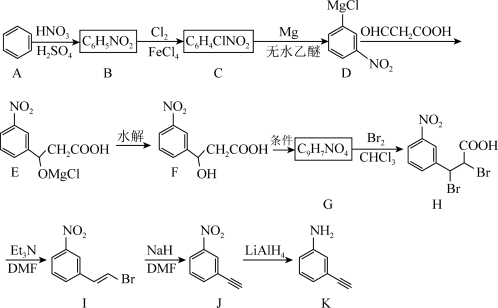
回答下列问题:。
(1)化合物B的化学名称为_______ ;化合物C的结构简式为_______ 。
(2)D→E的反应类型为_______ ,化合物K中所含官能团名称为_______ 。
(3)指出化合物H分子中所含的手性碳原子(用*号在手性碳原子旁边标出)_______
(4)F→G反应的化学方程式为_______ (注明反应的具体条件)。
(5)G的同分异构体中,满足下列条件的同分异构体有_______ 种(不考虑立体异构)。
①与G含有相同的官能团
②属于二取代芳香族化合物
写出其中核磁共振氢谱有4种峰,其峰值面积比为1:2:2:2的所有结构简式:_______ 。
(6)设计由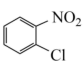 乙醛、无水乙醚和本题合成路线中的无机试剂制备
乙醛、无水乙醚和本题合成路线中的无机试剂制备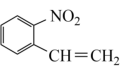 的合成路线:(合成需要四步)
的合成路线:(合成需要四步)_______ 。

回答下列问题:。
(1)化合物B的化学名称为
(2)D→E的反应类型为
(3)指出化合物H分子中所含的手性碳原子(用*号在手性碳原子旁边标出)
(4)F→G反应的化学方程式为
(5)G的同分异构体中,满足下列条件的同分异构体有
①与G含有相同的官能团
②属于二取代芳香族化合物
写出其中核磁共振氢谱有4种峰,其峰值面积比为1:2:2:2的所有结构简式:
(6)设计由
 乙醛、无水乙醚和本题合成路线中的无机试剂制备
乙醛、无水乙醚和本题合成路线中的无机试剂制备 的合成路线:(合成需要四步)
的合成路线:(合成需要四步)
您最近一年使用:0次
2022-05-25更新
|
433次组卷
|
4卷引用:广西南宁市第二中学2021-2022学年高三下学期5月诊断理科综合化学试题
广西南宁市第二中学2021-2022学年高三下学期5月诊断理科综合化学试题(已下线)考点34 芳香烃-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点33 烃(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)广西玉林市博白县中学2023-2024学年高三上学期10月月考化学试题
试卷分析
整体难度:适中
考查范围:化学反应原理、有机化学基础、认识化学科学、常见无机物及其应用、物质结构与性质、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 锂电池 新型有机高分子材料 | |
| 2 | 0.65 | 胶体的性质和应用 浓硫酸的吸水性 元素金属性、非金属性强弱探究实验 配制一定物质的量浓度的溶液实验的仪器 | |
| 3 | 0.65 | 22.4L/mol适用条件 结合气体物质与NA相关推算 羧酸酯化反应 电子转移计算 | |
| 4 | 0.65 | 温度对化学平衡移动的影响 沉淀转化 电解池电极反应式及化学方程式的书写与判断 | |
| 5 | 0.65 | 浓度对盐类水解的影响 制备与水解有关的物质 | |
| 6 | 0.65 | 离子方程式的正误判断 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 盐的水解常数 | |
| 7 | 0.4 | 电解原理的应用 电解池有关计算 | |
| 二、解答题 | |||
| 8 | 0.4 | 氧化还原反应方程式的配平 有关铁及其化合物转化的流程题型 铁及铁的氧化物混合物反应的相关计算 物质制备的探究 | 工业流程题 |
| 9 | 0.65 | 酸碱中和滴定原理的应用 探究物质组成或测量物质的含量 综合实验设计与评价 | 实验探究题 |
| 10 | 0.65 | 化学能与物质稳定性之间的关系 盖斯定律与热化学方程式 化学平衡的移动及其影响因素 化学平衡的有关计算 | 原理综合题 |
| 11 | 0.4 | 电子排布式 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 金属晶体原子堆积模型 | 结构与性质 |
| 12 | 0.4 | 同分异构体的数目的确定 苯的同系物的硝化反应 醇的消去反应 根据题给物质选择合适合成路线 | 有机推断题 |



