解题方法
1 . 高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,易分解,遇水和酸易变质。某学习小组在实验室对高铁酸钾的制备和一些性质进行探究。回答下列问题:
(1)高铁酸钾的制备,装置如图1所示。
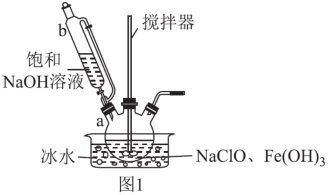
步骤一:将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称是_______ ,其侧管的作用为_______ 。
②a中制备Na2FeO4反应的离子方程式为_______ 。
③K2FeO4悬浊液经过滤、洗涤,可得粗产品。粗产品中的可溶性杂质可通过_______ 方法进一步提纯。
(2)K2FeO4遇水转化为Fe(OH)3,则其能用于净水的原理为:_______ 。
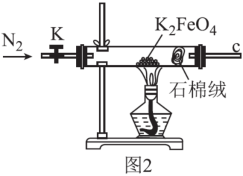
(3)用图2所示装置探究K2FeO4受热分解的产物。设计实验方案证明完全分解后的固体产物中不含Fe(II):取完全分解后的少量固体,溶于稀硫酸,_______ 。
(4)实验室可用间接碘量法测定含少量KCl杂质的K2FeO4样品的纯度:称取0.9000gK2FeO4样品溶于碱性KI溶液中,调节pH使混合液充分反应。用1.000mol·L-1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液15.00mL。请计算K2FeO4样品的纯度:_______ 。
已知: +4I-+8H+=Fe2++2I2+4H2O;I2+2
+4I-+8H+=Fe2++2I2+4H2O;I2+2 =
= +2I-。
+2I-。
(1)高铁酸钾的制备,装置如图1所示。

步骤一:将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称是
②a中制备Na2FeO4反应的离子方程式为
③K2FeO4悬浊液经过滤、洗涤,可得粗产品。粗产品中的可溶性杂质可通过
(2)K2FeO4遇水转化为Fe(OH)3,则其能用于净水的原理为:
(3)用图2所示装置探究K2FeO4受热分解的产物。设计实验方案证明完全分解后的固体产物中不含Fe(II):取完全分解后的少量固体,溶于稀硫酸,

(4)实验室可用间接碘量法测定含少量KCl杂质的K2FeO4样品的纯度:称取0.9000gK2FeO4样品溶于碱性KI溶液中,调节pH使混合液充分反应。用1.000mol·L-1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液15.00mL。请计算K2FeO4样品的纯度:
已知:
 +4I-+8H+=Fe2++2I2+4H2O;I2+2
+4I-+8H+=Fe2++2I2+4H2O;I2+2 =
= +2I-。
+2I-。
您最近一年使用:0次
2 . 成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成份的存在,请你参与并协助他们完成相关实验.
(1)用小试管取少量的苹果汁,加入新制Cu(OH)2悬浊液,并加热,产生砖红色的沉淀,则苹果中含有_______________ (写结构简式)。
(2)葡萄糖在一定条件下可以得到化学式为C2H6O的化合物A。A+CH3COOH→有香味的产物,含A的体积分数为75%的水溶液可以用做_______________ 。
(3)苹果中含有苹果酸,测得其相对分子质量为134,取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过足量的无水CaCl2和碱石灰,两者分别增重1.08g 和 3.52g。则分子中C、H原子的个数比_______________ ,苹果酸的分子式是_______________ 。
(4)若苹果酸具有如下性质:①1mol苹果酸与足量金属钠反应产生1.5mol气体;②在有浓硫酸和加热条件下,苹果酸与醇或羧酸均反应生成有香味的产物;③苹果酸在一定条件下的分子内脱水产物可和溴水发生加成反应。④1mol苹果酸能与2mol碳酸氢钠反应。根据上述信息,推测苹果酸可能的一种结构简式是_____________ 。
(1)用小试管取少量的苹果汁,加入新制Cu(OH)2悬浊液,并加热,产生砖红色的沉淀,则苹果中含有
(2)葡萄糖在一定条件下可以得到化学式为C2H6O的化合物A。A+CH3COOH→有香味的产物,含A的体积分数为75%的水溶液可以用做
(3)苹果中含有苹果酸,测得其相对分子质量为134,取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过足量的无水CaCl2和碱石灰,两者分别增重1.08g 和 3.52g。则分子中C、H原子的个数比
(4)若苹果酸具有如下性质:①1mol苹果酸与足量金属钠反应产生1.5mol气体;②在有浓硫酸和加热条件下,苹果酸与醇或羧酸均反应生成有香味的产物;③苹果酸在一定条件下的分子内脱水产物可和溴水发生加成反应。④1mol苹果酸能与2mol碳酸氢钠反应。根据上述信息,推测苹果酸可能的一种结构简式是
您最近一年使用:0次
名校
解题方法
3 . 由下列实验现象,推知所得结论正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 用洁净的铂丝蘸取某溶液进行焰色试验 | 火焰呈黄色 | 该溶液为钠盐溶液 |
| B | 将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已变质 |
| C | 分别用惰性电极电解CuCl2溶液和MgCl2溶液 | 对应阴极产物为Cu和H2 | 得电子能力:Cu2+>Mg2+ |
| D | 用pH试纸分别测NaNO2和CH3COONa两溶液的pH | 对应的pH分别约为8和9 | HNO2电离出H+的能力比CH3COOH强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 由下列操作与现象推出的相应结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 光束通过蛋白质溶液 | 产生光亮通路 | 蛋白质溶液属于胶体 |
| B | 将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已变质 |
| C | 向某溶液中加入盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中不一定含有SO42﹣ |
| D | 测定0.1mol•L﹣1和0.01mol•L﹣1的醋酸溶液导电性 | 前者导电性更强 | 浓度越大,醋酸电离程度越大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-09-06更新
|
287次组卷
|
3卷引用:海南省海口市2020届高三6月等级模拟试卷化学试题
解题方法
5 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2,某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度,回答下列问题:
第一步:制备K2FeO4,装置如图所示,夹持,加热等装置略。___ ,装置B中除杂质所用试剂是___ 。
(2)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为___ ,反应中KOH必须过量的原因是___ 。
(3)写出C中总反应的离子方程式___ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
第二步:K2FeO4产品纯度的测定:准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
(4)根据以上数据,样品中K2FeO4的质量分数为___ 。(K2FeO4摩尔质量为198g∙mol−1)若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果___ 。(填“偏高”、“偏低”或“无影响”)。
第一步:制备K2FeO4,装置如图所示,夹持,加热等装置略。
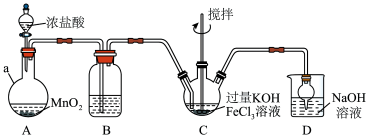
(2)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(3)写出C中总反应的离子方程式
第二步:K2FeO4产品纯度的测定:准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O
 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。(4)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
6 . 小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:
Ⅰ.加热分解法
利用图1装置,充分加热小苏打样品。
(1)仪器a的名称为______________ 。
(2)在实验过程中,需要测量的实验数据有:
①仪器a的质量;
②__________________________________ ;
③__________________________________ 。

Ⅱ.测量气体体积法
利用图2装置,测定反应生成气体的体积。
(3)组装好仪器后,首先进行的操作为________________ 。
(4)导管g的作用为____________________ 。
(5)因为CO2溶于水,为了减小实验误差,B、C中最好用________ 溶液代替水。
(6)待反应结束,气体冷却至室温后,利用图示装置读取气体体积时,应注意的事项有:
①______________________________ ;
②_______________________________ 。
Ⅰ.加热分解法
利用图1装置,充分加热小苏打样品。
(1)仪器a的名称为
(2)在实验过程中,需要测量的实验数据有:
①仪器a的质量;
②
③

Ⅱ.测量气体体积法
利用图2装置,测定反应生成气体的体积。
(3)组装好仪器后,首先进行的操作为
(4)导管g的作用为
(5)因为CO2溶于水,为了减小实验误差,B、C中最好用
(6)待反应结束,气体冷却至室温后,利用图示装置读取气体体积时,应注意的事项有:
①
②
您最近一年使用:0次
7 . 莫尔盐[(NH4)2SO4•FeSO4•6H2O]是一种常用原料。在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2Fe(SO4)2•6H2O],为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如表:(已知莫尔盐的分子量为392)
(1)配制莫尔盐溶液,所使用的玻璃仪器除了烧杯和玻璃棒外还有____ 。
(2)滴定终点的现象是____ 。
(3)表中第一次实验中记录数据明显大于后两次,其原因可能是____ 。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.读取酸式滴定管中液体读数时,滴定前仰视,滴定后俯视
(4)Fe2+易被氧化,欲检验氧化后的产物,常用的试剂及实验现象是:____ 、____ 。
(5)通过实验数据,计算该产品的纯度为____ (用含字母a、c的式子表示)。
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
(2)滴定终点的现象是
(3)表中第一次实验中记录数据明显大于后两次,其原因可能是
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.读取酸式滴定管中液体读数时,滴定前仰视,滴定后俯视
(4)Fe2+易被氧化,欲检验氧化后的产物,常用的试剂及实验现象是:
(5)通过实验数据,计算该产品的纯度为
您最近一年使用:0次



