高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2,某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度,回答下列问题:
第一步:制备K2FeO4,装置如图所示,夹持,加热等装置略。___ ,装置B中除杂质所用试剂是___ 。
(2)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为___ ,反应中KOH必须过量的原因是___ 。
(3)写出C中总反应的离子方程式___ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
第二步:K2FeO4产品纯度的测定:准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
(4)根据以上数据,样品中K2FeO4的质量分数为___ 。(K2FeO4摩尔质量为198g∙mol−1)若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果___ 。(填“偏高”、“偏低”或“无影响”)。
第一步:制备K2FeO4,装置如图所示,夹持,加热等装置略。
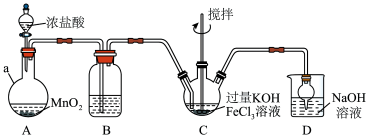
(2)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(3)写出C中总反应的离子方程式
第二步:K2FeO4产品纯度的测定:准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O
 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。(4)根据以上数据,样品中K2FeO4的质量分数为
2020·天津·二模 查看更多[2]
更新时间:2020-08-21 14:42:38
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】次氯酸钠是家用消毒剂的有效成分。实验室制备次氯酸钠的装置如图甲所示。
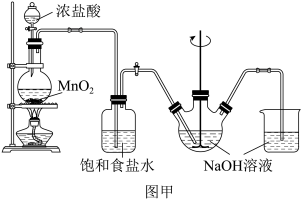
(1)图甲中在烧瓶里加二氧化锰后,通过_______ (填写仪器名称)向烧瓶中加入适量的浓盐酸。
(2)实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下: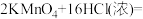
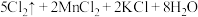
①用双线桥标出该反应的电子转移方向和数目_______ 。
②标准状况下若产生4.48 LCl2,则反应过程中被氧化的HCl的物质的量是_______ mol,则电子转移_______ mol。
(3)制得的Cl2通过盛有饱和食盐水的装置,目的是_______ 。
(4)三颈烧瓶中生成各物质的物质的量和溶液的温度随时间的变化如图乙所示。t1分钟后所发生主要反应的化学方程式为_______ 。

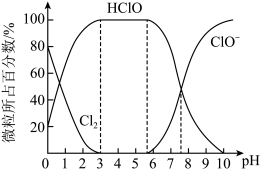
(5)Cl2常用于饮用水消毒。Cl2溶于水得到氯水,氯水中HClO的浓度越大杀菌能力越强。已知25℃时,氯水中Cl2 (溶于水的氯气分子)、HClO、ClO-三种微粒所占百分数与pH的关系如图。则用Cl2处理饮用水时,溶液的pH最佳控制范围是_______ 。

(1)图甲中在烧瓶里加二氧化锰后,通过
(2)实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下:
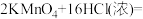
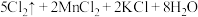
①用双线桥标出该反应的电子转移方向和数目
②标准状况下若产生4.48 LCl2,则反应过程中被氧化的HCl的物质的量是
(3)制得的Cl2通过盛有饱和食盐水的装置,目的是
(4)三颈烧瓶中生成各物质的物质的量和溶液的温度随时间的变化如图乙所示。t1分钟后所发生主要反应的化学方程式为

(5)Cl2常用于饮用水消毒。Cl2溶于水得到氯水,氯水中HClO的浓度越大杀菌能力越强。已知25℃时,氯水中Cl2 (溶于水的氯气分子)、HClO、ClO-三种微粒所占百分数与pH的关系如图。则用Cl2处理饮用水时,溶液的pH最佳控制范围是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
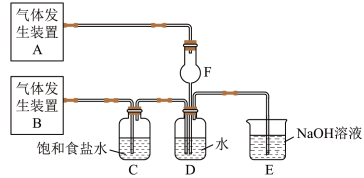
(1)气体发生装置B产生的气体是________ 。
(2)为验证通入装置D中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
①氯化亚铁溶液 ②硫氰化钾溶液 ③品红溶液 ④酸性高锰酸钾溶液
a.若Cl2过量:取适量D中溶液滴加至盛有__________ (选填一个序号)的试管内,再加入________ (选填一个序号)试剂,实验现象是_______________________________ 。
b.若SO2过量:取适量D中溶液滴加至盛有__________ (选填一个序号)的试管内,实验现象是________________________________________ 。
(3)另一小组设计如图所示的装置图(夹持和加热装置略去),分别研究SO2和Cl2的性质。
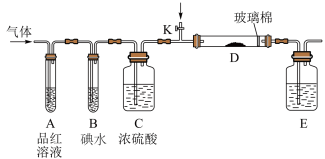
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?_________ (填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了0.05mol电子,该反应的化学方程式为________________________________ 。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀生成,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式:_____________________________ 。

(1)气体发生装置B产生的气体是
(2)为验证通入装置D中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
①氯化亚铁溶液 ②硫氰化钾溶液 ③品红溶液 ④酸性高锰酸钾溶液
a.若Cl2过量:取适量D中溶液滴加至盛有
b.若SO2过量:取适量D中溶液滴加至盛有
(3)另一小组设计如图所示的装置图(夹持和加热装置略去),分别研究SO2和Cl2的性质。

①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?
②若装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了0.05mol电子,该反应的化学方程式为
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀生成,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某学生设计如图实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
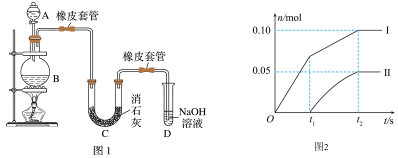
(1)A仪器的名称是______ ,D的作用是______ 。
(2)漂白粉将在U形管中产生,其反应的化学方程式是______ 。
(3)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是______ ,有同学测出了反应后溶液中ClO-、ClO 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图2(不考虑氯气和水的反应)。
两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图2(不考虑氯气和水的反应)。
a.图2中曲线Ⅰ表示______ 的物质的量随反应时间变化的关系。
b.取含有0.25molCa(OH)2的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中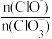 =
=______ 。
②试判断另一个副反应是______ (写出此反应的化学方程式)。
(4)该学生还将制得的氯气和二氧化硫同时通入品红溶液中,发现混合气体漂白能力下降。经分析发现主要原因是氯气和二氧化硫在水溶液中发生了氧化还原反应。为了定量测定该反应生成SO 的质量,该学生将过量氯气和二氧化硫同时通入水中,将反应后的溶液用容量瓶配制成250mL后,从中取出25mL进行如下实验:
的质量,该学生将过量氯气和二氧化硫同时通入水中,将反应后的溶液用容量瓶配制成250mL后,从中取出25mL进行如下实验:
已知:CrO +Ba2+=BaCrO4↓(黄色)、CrO
+Ba2+=BaCrO4↓(黄色)、CrO +3Fe2++8H+=Cr3++3Fe3++4H2O
+3Fe2++8H+=Cr3++3Fe3++4H2O

(1)A仪器的名称是
(2)漂白粉将在U形管中产生,其反应的化学方程式是
(3)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图2(不考虑氯气和水的反应)。
两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图2(不考虑氯气和水的反应)。a.图2中曲线Ⅰ表示
b.取含有0.25molCa(OH)2的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中
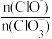 =
=②试判断另一个副反应是
(4)该学生还将制得的氯气和二氧化硫同时通入品红溶液中,发现混合气体漂白能力下降。经分析发现主要原因是氯气和二氧化硫在水溶液中发生了氧化还原反应。为了定量测定该反应生成SO
 的质量,该学生将过量氯气和二氧化硫同时通入水中,将反应后的溶液用容量瓶配制成250mL后,从中取出25mL进行如下实验:
的质量,该学生将过量氯气和二氧化硫同时通入水中,将反应后的溶液用容量瓶配制成250mL后,从中取出25mL进行如下实验:| 操作 | 现象 | 目的/结论 | |
| ① | 往25mL溶液中滴加过量amol·L-1BaCl2溶液V1mL | 稍显浑浊 | 目的:沉淀SO 。 。 |
| ② | 继续滴加过量bmol·L-1K2CrO4溶液V2mL | 产生黄色沉淀 | 目的:沉淀过量的Ba2+。 |
| ③ | 过滤洗涤,滴加少许指示剂于滤液中,用cmol·L-1FeSO4溶液滴定至终点,消耗FeSO4溶液V3mL | 结论:反应生成SO 的质量为 的质量为 |
 +Ba2+=BaCrO4↓(黄色)、CrO
+Ba2+=BaCrO4↓(黄色)、CrO +3Fe2++8H+=Cr3++3Fe3++4H2O
+3Fe2++8H+=Cr3++3Fe3++4H2O
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】(1)用a mol/L的盐酸滴定未知浓度的氢氧化钠溶液,用酚酞作指示剂,达到滴定终点的现象是___ 。
(2)硫代硫酸钠晶体(Na2S2O3.5H2O,M=248g/mol)可用作定影剂、还原剂。回答下列问题:
利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,配成100ml溶液 ②滴定:取0.0090mol/LK2Cr2O7的标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应K2Cr2O₇+6KI+7H2SO₄=Cr2(SO₄)₃+7H2O+3I₂+4K2SO₄,然后用硫代硫酸钠样品溶液滴定,发生反应:2Na2S2O3+I2=Na2S4O6+2NaI。加入淀粉溶液作为指示剂,继续滴定,到终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为___ (保留1位小数)。
(3)已知:常温下,醋酸的电离平衡常数为1×10-6,则0.01mol/L的醋酸钠溶液的pH=___ ,水电离出的c(H+)=___ 。
(2)硫代硫酸钠晶体(Na2S2O3.5H2O,M=248g/mol)可用作定影剂、还原剂。回答下列问题:
利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,配成100ml溶液 ②滴定:取0.0090mol/LK2Cr2O7的标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应K2Cr2O₇+6KI+7H2SO₄=Cr2(SO₄)₃+7H2O+3I₂+4K2SO₄,然后用硫代硫酸钠样品溶液滴定,发生反应:2Na2S2O3+I2=Na2S4O6+2NaI。加入淀粉溶液作为指示剂,继续滴定,到终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为
(3)已知:常温下,醋酸的电离平衡常数为1×10-6,则0.01mol/L的醋酸钠溶液的pH=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】下图表示从废旧普通锌锰电池内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
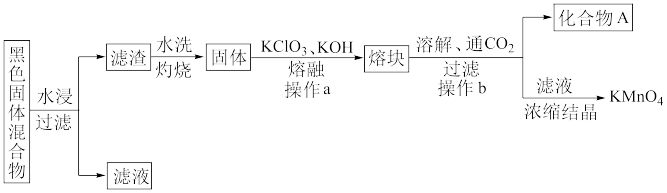
(1)KMnO4稀溶液是一种常用消毒剂,其消毒机理与下列物质相似的是__________ (填序号)。
A.双氧水 B.75%酒精 C.84消毒液(NaClO溶液) D.苯酚
(2)①黑色固体混合物水浸时为提高浸出速率,常采用的措施为___________________________ (答出一条即可)。
②滤渣水洗灼烧后固体是一种黑色的化合物,操作a中得到熔块的主要成分是K2MnO4和KCl,该过程中发生反应的化学方程式为_____________________________________ 。
③图中产物A是一种难溶于水的黑色固体,其化学式为_________________________ 。
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250 mL0.100 0 mol·L-1标准Na2S2O3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒和_________________________ 、_________________________ ;
②取KMnO4配成溶液(酸化)后,用0.100 0 mol·L-1标准Na2S2O3溶液进行滴定,判断滴定至终点的现象为___________________ 。

(1)KMnO4稀溶液是一种常用消毒剂,其消毒机理与下列物质相似的是
A.双氧水 B.75%酒精 C.84消毒液(NaClO溶液) D.苯酚
(2)①黑色固体混合物水浸时为提高浸出速率,常采用的措施为
②滤渣水洗灼烧后固体是一种黑色的化合物,操作a中得到熔块的主要成分是K2MnO4和KCl,该过程中发生反应的化学方程式为
③图中产物A是一种难溶于水的黑色固体,其化学式为
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250 mL0.100 0 mol·L-1标准Na2S2O3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒和
②取KMnO4配成溶液(酸化)后,用0.100 0 mol·L-1标准Na2S2O3溶液进行滴定,判断滴定至终点的现象为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可用已知浓度的标准I2溶液进行滴定(弱酸性性环境)。该反应的化学方程式为:C6H8O6+I2 = C6H6O6+2HI具体测定步骤及测得数据如下:取10 mL 6 mol·L-1CH3COOH溶液,加入100 mL蒸馏水,将溶液加热煮沸后冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中,加入1mL指示剂,立即用浓度为0.0500 mol·L-1的标准I2溶液进行滴定到终点,消耗21.00 mL I2溶液。
(1)实验中的指示剂是____________ 确定达到滴定终点的现象是_____________ 。
(2)盛装标准I2溶液的是_________ (酸式或碱式)滴定管,若滴定结束时俯视滴定管读数(其它操作正确)则滴定结果_______ (偏高、偏低或无影响)。
(3)加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用,其目的是_____________ 。
(4)计算样品中维生素C的质量分数____________ (要求列式,且式中各物理量带单位)。
(1)实验中的指示剂是
(2)盛装标准I2溶液的是
(3)加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用,其目的是
(4)计算样品中维生素C的质量分数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
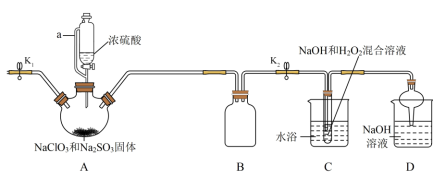
【推荐1】NaClO2在工业生产中常用作漂白剂、脱色剂、消毒剂、拔染剂等。实验室中可用H2O2和NaOH混合溶液吸收ClO2的方法制取NaClO2,利用如下装置及试剂制备NaClO2晶体:
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。___________ 。装置D中NaOH溶液的作用是___________ 。
(2)装置A中生成ClO2的化学方程式为___________ 。
(3)仪器A中NaClO3需稍微过量,原因是___________ 。实验过程中,常需要打开K1,鼓入一定量空气,该操作的目的是___________ 。
(4)NaClO2纯度的测定:“间接碘量法”测定样品(杂质与I−不发生反应)纯度,过程如下:
取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO +4I−+4H+=2H2O+2I2+Cl−),然后用cmol·L−1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I−+4H+=2H2O+2I2+Cl−),然后用cmol·L−1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
样品中NaClO2的纯度为___________ %(用含c、V的代数式表示)。
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。
(2)装置A中生成ClO2的化学方程式为
(3)仪器A中NaClO3需稍微过量,原因是
(4)NaClO2纯度的测定:“间接碘量法”测定样品(杂质与I−不发生反应)纯度,过程如下:
取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I−+4H+=2H2O+2I2+Cl−),然后用cmol·L−1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I−+4H+=2H2O+2I2+Cl−),然后用cmol·L−1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。样品中NaClO2的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】二氯砜(SO2Cl2)在制药行业中用途广泛。SO2Cl2的沸点为 ,遇水剧烈水解。实验室制备SO2Cl2的原理为:
,遇水剧烈水解。实验室制备SO2Cl2的原理为: ,部分装置如图所示。回答以下问题:
,部分装置如图所示。回答以下问题:___________ 。
(2)滴液漏斗中盛放的液态物质b为___________ ,上述装置各接口连接的顺序依次为①、___________ 、___________ 、___________ 。
(3)通过开关K控制水流速率,以保证仪器a的出水温度低于 ,该操作的目的是
,该操作的目的是___________ ;试剂碱石灰的两个作用分别是①___________ ;②___________ 。
(4)实验结束后,需从三颈烧瓶中分离出高纯度SO2Cl2,该分离操作的名称为___________ (填标号)。
A.蒸馏 B.蒸发 C.萃取 D.重结晶
若标准状况下,反应中消耗的Cl2的体积为896.0mL (SO2足量),最后得到纯净的 ,则
,则 的产率为
的产率为___________ 。
(5)用硫磺、液氯和 按照一定物质的量之比混合,在一定条件下也能合成
按照一定物质的量之比混合,在一定条件下也能合成 ,且原子利用率达100%,则三者的物质的量之比
,且原子利用率达100%,则三者的物质的量之比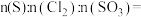
___________ 。
 ,遇水剧烈水解。实验室制备SO2Cl2的原理为:
,遇水剧烈水解。实验室制备SO2Cl2的原理为: ,部分装置如图所示。回答以下问题:
,部分装置如图所示。回答以下问题:
(2)滴液漏斗中盛放的液态物质b为
(3)通过开关K控制水流速率,以保证仪器a的出水温度低于
 ,该操作的目的是
,该操作的目的是(4)实验结束后,需从三颈烧瓶中分离出高纯度SO2Cl2,该分离操作的名称为
A.蒸馏 B.蒸发 C.萃取 D.重结晶
若标准状况下,反应中消耗的Cl2的体积为896.0mL (SO2足量),最后得到纯净的
 ,则
,则 的产率为
的产率为(5)用硫磺、液氯和
 按照一定物质的量之比混合,在一定条件下也能合成
按照一定物质的量之比混合,在一定条件下也能合成 ,且原子利用率达100%,则三者的物质的量之比
,且原子利用率达100%,则三者的物质的量之比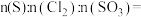
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】黄铜矿(主要成分二硫化亚铁铜,化学式为CuFeS2)为原料可制备金属铜及其化合物,还可以制得铁红、硫磺等,工艺流程如图:
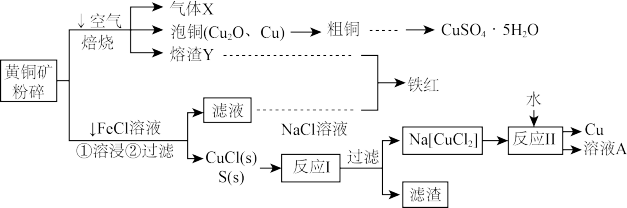
请回答下列问题:
(1)气体X的名称是________ 。
(2)“铁红”化学式为________ 。向粗铜中加入硫酸和稀硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中H2SO4与HNO3的最佳物质的量之比为________ 。
(3)FeCl3溶液浸取工艺中,溶浸时CuFeS2与FeCl3溶液反应的离子方程式为__________ 。
(4)反应Ⅰ化学方程式为_________ ,反应Ⅱ所得“溶液A”成分是(填化学式)________ 。

请回答下列问题:
(1)气体X的名称是
(2)“铁红”化学式为
(3)FeCl3溶液浸取工艺中,溶浸时CuFeS2与FeCl3溶液反应的离子方程式为
(4)反应Ⅰ化学方程式为
您最近一年使用:0次



