名校
1 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
(1)制备N2H4
制备N2H4的离子方程式为___________ 。
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
(2)滴定到达终点的现象是___________ 。
(3)实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合肼的质量分数为___________ 。
Ⅲ.探究肼的性质。
(4)写出肼的电子式___________ ,肼为___________ 分子。(填“极性”或“非极性”)。
(5)预设肼可能具有___________ (a.氧化性 b.还原性 c.酸性 d.碱性)。
将制得的肼分离提纯后,进行如图实验探究。
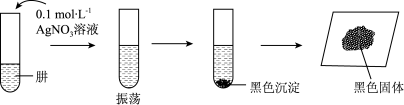
【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
(6)请完成表中的空白部分:①___________ ;②___________ 。
(7)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:___________ 。
(1)制备N2H4

制备N2H4的离子方程式为
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
(2)滴定到达终点的现象是
(3)实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合肼的质量分数为
Ⅲ.探究肼的性质。
(4)写出肼的电子式
(5)预设肼可能具有
将制得的肼分离提纯后,进行如图实验探究。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
| 操作 | 现象 | 实验结论 |
| i.取少量黑色固体于试管中,加入适量①___________ | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ②___________ | 黑色固体是Ag和Ag2O |
(7)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:
您最近一年使用:0次
名校
解题方法
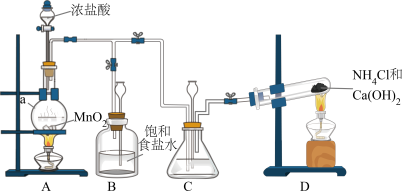
2 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示。
已知:① 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;
②三颈烧瓶内盛放: 、水和催化剂;
、水和催化剂;
③ ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃易分解,而
在高于170℃易分解,而 在105℃就会完全分解。
在105℃就会完全分解。
回答问题:
(1)装置B中的试剂是_______ 。
(2)三颈烧瓶的下层 液体必须浸没导气管口,目的是
液体必须浸没导气管口,目的是_______ 。
(3)制备KSCN溶液:打开 ,加热装置A、D,使A中产生的气体通入D中,发生反应,一段时间后熄灭A处的酒精灯,关闭
,加热装置A、D,使A中产生的气体通入D中,发生反应,一段时间后熄灭A处的酒精灯,关闭 ,保持三颈烧瓶内液温105℃一段时间,然后打开
,保持三颈烧瓶内液温105℃一段时间,然后打开 ,继续保持液温105℃,缓缓滴入适量的KOH溶液。写出装置D中生成KSCN的化学方程式
,继续保持液温105℃,缓缓滴入适量的KOH溶液。写出装置D中生成KSCN的化学方程式_______ 。
(4)装置E的作用为吸收尾气,防止污染环境,写出吸收 时的发生反应的离子方程式
时的发生反应的离子方程式_______ 。
(5)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、_______ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(6)测定晶体中KSCN晶体的含量:称取10.0 g样品,配成1000 mL溶液,量取20.00 mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用0.1000 mol·L
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液18.00 mL。
标准溶液18.00 mL。
已知:滴定时发生的反应: (白色)。
(白色)。
①滴定过程的指示剂a为_______ 。
②晶体中KSCN的质量分数为_______ 。

已知:①
 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;②三颈烧瓶内盛放:
 、水和催化剂;
、水和催化剂;③
 ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃易分解,而
在高于170℃易分解,而 在105℃就会完全分解。
在105℃就会完全分解。回答问题:
(1)装置B中的试剂是
(2)三颈烧瓶的下层
 液体必须浸没导气管口,目的是
液体必须浸没导气管口,目的是(3)制备KSCN溶液:打开
 ,加热装置A、D,使A中产生的气体通入D中,发生反应,一段时间后熄灭A处的酒精灯,关闭
,加热装置A、D,使A中产生的气体通入D中,发生反应,一段时间后熄灭A处的酒精灯,关闭 ,保持三颈烧瓶内液温105℃一段时间,然后打开
,保持三颈烧瓶内液温105℃一段时间,然后打开 ,继续保持液温105℃,缓缓滴入适量的KOH溶液。写出装置D中生成KSCN的化学方程式
,继续保持液温105℃,缓缓滴入适量的KOH溶液。写出装置D中生成KSCN的化学方程式(4)装置E的作用为吸收尾气,防止污染环境,写出吸收
 时的发生反应的离子方程式
时的发生反应的离子方程式(5)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、
(6)测定晶体中KSCN晶体的含量:称取10.0 g样品,配成1000 mL溶液,量取20.00 mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用0.1000 mol·L

 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液18.00 mL。
标准溶液18.00 mL。已知:滴定时发生的反应:
 (白色)。
(白色)。①滴定过程的指示剂a为
②晶体中KSCN的质量分数为
您最近一年使用:0次
名校
解题方法
3 . I.现有常温下的3份溶液:
①0.01mol•L-1CH3COOH溶液;②0.01mol•L-1HCl溶液;③pH=12的氨水
(1)3份溶液中,水的电离程度最大的是______ (填序号)。
(2)若②③混合后所得溶液的pH=7,则消耗溶液的体积:②______ ③(填“>”“<”或“=”)。
(3)等体积的①②溶液分别与足量锌粒反应,生成氢气的体积:①______ ②(填“>”“<”或“=”)。
II.NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(4)能说明Na2HPO4溶液显弱碱性的离子方程式为______ 。
(5)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:样品1.3000g H3PO4
H3PO4 NaH2PO4→配成100.00mL溶液取25.00mL溶液
NaH2PO4→配成100.00mL溶液取25.00mL溶液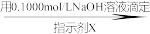 Na2HPO4
Na2HPO4
①滴定时所用的指示剂X可为______ 。
②滴定实验所得数据记录如表(样品中杂质不与酸或碱反应)。
试计算样品中Na5P3O10(Mr=368)的质量分数(结果保留到小数点后一位)______ %。
①0.01mol•L-1CH3COOH溶液;②0.01mol•L-1HCl溶液;③pH=12的氨水
(1)3份溶液中,水的电离程度最大的是
(2)若②③混合后所得溶液的pH=7,则消耗溶液的体积:②
(3)等体积的①②溶液分别与足量锌粒反应,生成氢气的体积:①
II.NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(4)能说明Na2HPO4溶液显弱碱性的离子方程式为
(5)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:样品1.3000g
 H3PO4
H3PO4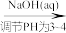 NaH2PO4→配成100.00mL溶液取25.00mL溶液
NaH2PO4→配成100.00mL溶液取25.00mL溶液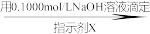 Na2HPO4
Na2HPO4①滴定时所用的指示剂X可为
②滴定实验所得数据记录如表(样品中杂质不与酸或碱反应)。
| 滴定次数 | 待测溶液的体积(mL) | 0.1mol•L-1NaOH溶液的体积 | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
您最近一年使用:0次
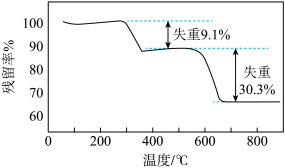
4 . 采用热重分析法测定FeS2/C复合材料中各组分的含量。FeS2/C样品在空气中的热重曲线如图所示。[注:残留率(%)=剩余固体质量 样品质量
样品质量 100%],下列说法中不正确的是
100%],下列说法中不正确的是
 样品质量
样品质量 100%],下列说法中不正确的是
100%],下列说法中不正确的是
A.300~400℃之间发生的主要反应为C+O2 CO2 CO2 |
| B.800℃时残留的固体是Fe3O4 |
| C.复合材料中FeS2的质量分数为90.9% |
| D.复合材料中FeS2与C的物质的量之比约为1∶1 |
您最近一年使用:0次
名校
5 . 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案。
方案一(滴定法):用酸性KMnO4溶液滴定,测定铁元素的含量
(1)写出该滴定反应的离子方程式:___________ 。
(2)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、药匙、烧杯、胶头滴管外,还需___________ (填仪器名称)。
在溶液配制过程中,下列操作会导致配制结果偏低的是___________ (填序号)。
A.定容时,俯视容量瓶刻度线
B.容量瓶在使用前内有少量蒸馏水
C.转移溶液后的烧杯、玻璃棒未洗涤
D.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(3)上述实验中KMnO4溶液需要酸化,用于酸化的酸是______(填序号)。
方案二(称量法):操作流程如下:
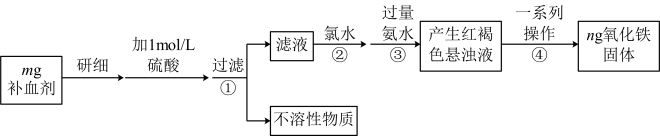
(4)步骤④一系列操作依次是:过滤、洗涤、______ 、冷却、称量。
(5)假设实验无损耗,则该补血剂含铁元素的质量分数为_____ 。(用含m、n的代数式表示)
方案一(滴定法):用酸性KMnO4溶液滴定,测定铁元素的含量
(1)写出该滴定反应的离子方程式:
(2)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、药匙、烧杯、胶头滴管外,还需
在溶液配制过程中,下列操作会导致配制结果偏低的是
A.定容时,俯视容量瓶刻度线
B.容量瓶在使用前内有少量蒸馏水
C.转移溶液后的烧杯、玻璃棒未洗涤
D.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(3)上述实验中KMnO4溶液需要酸化,用于酸化的酸是______(填序号)。
| A.浓盐酸 | B.稀硫酸 | C.稀硝酸 | D.浓硫酸 |
方案二(称量法):操作流程如下:

(4)步骤④一系列操作依次是:过滤、洗涤、
(5)假设实验无损耗,则该补血剂含铁元素的质量分数为
您最近一年使用:0次
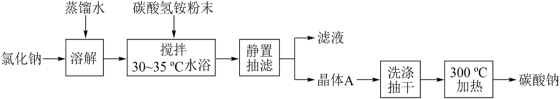
6 . 碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如图:
步骤I.Na2CO3的制备
步骤Ⅱ.产品中NaHCO3含量测定
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用0.1000mol/L盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸V1mL;
③在上述锥形瓶中再加入2滴指示剂N,继续用0.1000mol/L盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2mL;
④平行测定三次,V1平均值为22.45,V2平均值为23.51。
已知:(i)当温度超过35℃时,NH4HCO3开始分解。
(ii)相关盐在不同温度下的溶解度表(g/100gH2O)
回答下列问题:
(1)步骤I中晶体A的化学式为__ ,晶体A能够析出的原因是__ 。
(2)步骤I中“300℃加热”所选用的仪器是___ (填标号)。
(3)指示剂N为___ ,描述第二滴定终点前后颜色变化___ 。
(4)产品中NaHCO3的质量分数为___ (保留三位有效数字)。
(5)写出第一滴定终点和第二滴定终点前的化学方程式分别是___ ,___ 。
步骤I.Na2CO3的制备

步骤Ⅱ.产品中NaHCO3含量测定
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用0.1000mol/L盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸V1mL;
③在上述锥形瓶中再加入2滴指示剂N,继续用0.1000mol/L盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2mL;
④平行测定三次,V1平均值为22.45,V2平均值为23.51。
已知:(i)当温度超过35℃时,NH4HCO3开始分解。
(ii)相关盐在不同温度下的溶解度表(g/100gH2O)
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | |||
| NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
(1)步骤I中晶体A的化学式为
(2)步骤I中“300℃加热”所选用的仪器是
A. | B. | C. | D. |
(4)产品中NaHCO3的质量分数为
(5)写出第一滴定终点和第二滴定终点前的化学方程式分别是
您最近一年使用:0次
2021-11-11更新
|
105次组卷
|
3卷引用:海南省北京师范大学万宁附属中学2021-2022学年高三上学期11月月考化学试题
解题方法
7 . 氮是动植物生长过程中不可缺少的元素,其单质及其化合物有着广泛的用途。回答下列问题:
(1)肼(N2H4)、偏二甲肼(C2H8N2)、四氧化二氮(N2O4)都可用作火箭的燃料。
①N2H4、C2H8N2、N2O4中氮元素的质量分数由小到大的顺序为__ 。
②液态肼与液态四氧化二氨发生反应生成空气中含量最多的气体和水蒸气,写出该反应的化学方程式:___ 。
(2)将28gFe完全溶于一定量的HNO3溶液中,若只产生N2O、NO两种气体,该混合气体体积为5.6L(标准状况下),并且检测到溶液中金属阳离子只有Fe2+。
①与N2O互为等电子体的一种分子为__ ,其空间构型为___ 。
②写出上述Fe与HNO3反应生成N2O的离子方程式:___ 。
③生成的N2O、NO的物质的量之比为___ 。
(1)肼(N2H4)、偏二甲肼(C2H8N2)、四氧化二氮(N2O4)都可用作火箭的燃料。
①N2H4、C2H8N2、N2O4中氮元素的质量分数由小到大的顺序为
②液态肼与液态四氧化二氨发生反应生成空气中含量最多的气体和水蒸气,写出该反应的化学方程式:
(2)将28gFe完全溶于一定量的HNO3溶液中,若只产生N2O、NO两种气体,该混合气体体积为5.6L(标准状况下),并且检测到溶液中金属阳离子只有Fe2+。
①与N2O互为等电子体的一种分子为
②写出上述Fe与HNO3反应生成N2O的离子方程式:
③生成的N2O、NO的物质的量之比为
您最近一年使用:0次
名校
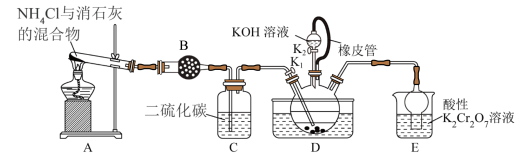
8 . 单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
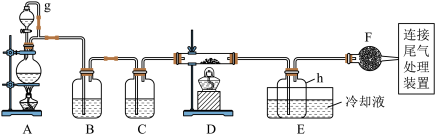
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:______________________________ 。
(2)装置F的名称是___________________ ;装置C中的试剂是_____________ ;装置E中的h瓶需要冷却的理由是_____________________________________ 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____ (填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO4-+8H+==5Fe3++Mn2++4H2O。
①滴定前是否要滴加指示剂?________ (填“是”或“否”)。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是_____________

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(1)写出装置A中发生反应的离子方程式:
(2)装置F的名称是
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO4-+8H+==5Fe3++Mn2++4H2O。
①滴定前是否要滴加指示剂?
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是
您最近一年使用:0次
9 . 某研究小组利用乳酸钙和FeCl2为原料生产乳酸亚铁([CH3CH(OH) COO]2Fe·3H2O) 和医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3% ~99.3%),制备流程如下:
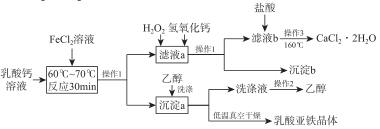
(1)实验室常用两种方案制备FeCl2,写出原子利用率为100%的反应的化学方程式______________ ;在FeCl2溶液中需要加______________
(2)制备乳酸亚铁晶体是向乳酸钙溶液中加入过量的FeCl2溶液,写出该反应的化学方程式______________ 。
(3)操作1、操作2、操作3依次为______________ 、______________ 、______________ 。
(4)向“滤液a”中先加H2O2溶,作用是______________ 。然后再调节溶液
的 pH 约为5,目的是______________ 。
(5)向“滤液b”加盐酸的目的是______________ 。
(6)为测定样品中CaCl2·2H2O的含量,称取0.7600g样品并配成250mL 溶液,各取该溶液 25.00mL,分别置于三个锥形瓶中,用0.05000mol·L-1AgNO3溶液进行三次滴定,消耗AgNO3溶液的平均体积为20.39mL。计算样品中CaCl2·2H2O的质量分数为______________ 。

(1)实验室常用两种方案制备FeCl2,写出原子利用率为100%的反应的化学方程式
(2)制备乳酸亚铁晶体是向乳酸钙溶液中加入过量的FeCl2溶液,写出该反应的化学方程式
(3)操作1、操作2、操作3依次为
(4)向“滤液a”中先加H2O2溶,作用是
的 pH 约为5,目的是
(5)向“滤液b”加盐酸的目的是
(6)为测定样品中CaCl2·2H2O的含量,称取0.7600g样品并配成250mL 溶液,各取该溶液 25.00mL,分别置于三个锥形瓶中,用0.05000mol·L-1AgNO3溶液进行三次滴定,消耗AgNO3溶液的平均体积为20.39mL。计算样品中CaCl2·2H2O的质量分数为
您最近一年使用:0次
解题方法
10 . Ⅰ.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是( )
II.铝是现今人类生产生活中使用广泛性仅次于铁的重要金属。工业上常以“钒土矿”为原料来冶炼金属铝。已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质)。为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不和盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.5 mol·L-1的NaOH溶液,得到如图所示的变化关系。请根据有关数据回答下列问题:
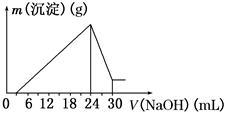
(1)写出滴加NaOH溶液0~3 mL时发生反应的离子方程式:________________ 。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为______ ,其物质的量为____________ 。
(3)该钒土矿样中Al2O3的质量分数为________ 。
(4)用10.0 t“钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上在_____ 极(填“阴”,“阳”)最多可制得金属铝________ t。
| A.该物质属于两性氢氧化物 |
| B.该物质是Al(OH)3和Na2CO3的混合物 |
| C.1 mol NaAl(OH)2CO3最多可消耗4 mol H+ |
| D.该药剂不适合于胃溃疡患者服用 |
II.铝是现今人类生产生活中使用广泛性仅次于铁的重要金属。工业上常以“钒土矿”为原料来冶炼金属铝。已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质)。为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不和盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.5 mol·L-1的NaOH溶液,得到如图所示的变化关系。请根据有关数据回答下列问题:

(1)写出滴加NaOH溶液0~3 mL时发生反应的离子方程式:
(2)最后所得不溶于NaOH溶液的沉淀的化学式为
(3)该钒土矿样中Al2O3的质量分数为
(4)用10.0 t“钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上在
您最近一年使用:0次



