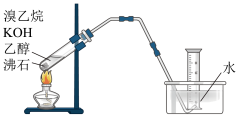
(1)制备N2H4
制备N2H4的离子方程式为
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
(2)滴定到达终点的现象是
(3)实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合肼的质量分数为
Ⅲ.探究肼的性质。
(4)写出肼的电子式
(5)预设肼可能具有
将制得的肼分离提纯后,进行如图实验探究。
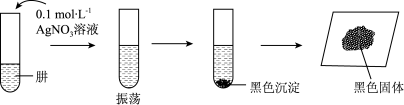
【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
| 操作 | 现象 | 实验结论 |
| i.取少量黑色固体于试管中,加入适量①___________ | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ②___________ | 黑色固体是Ag和Ag2O |
(7)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:
相似题推荐
(1)基态Al原子中,电子填充的最高能级是
(2)用“>”或“<”填空:
| 第一电离能 | 键能 | 沸点 | 离子半径 |
| Be | C—C | H2S | Al3+ |
(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式
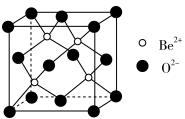
(5)Be的氧化物的立方晶胞结构如图所示,已知氧化铍晶体的密度为ρg·cm-3,则晶胞边长为
Ⅰ.硒在元素周期表中的位置如图所示:
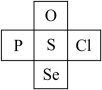
(1)从原子结构的角度解释硫的非金属性比硒强的原因是
Ⅱ.工业上从铜阳极泥(含有Se、Au、Ag、Cu、CuSe、Ag2Se等)中提取硒的过程如图:
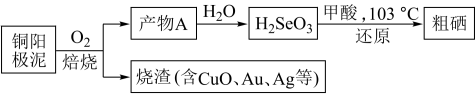
(2)焙烧时,产物A的化学式为
(3)将甲酸(HCOOH)还原H2SeO3反应的化学方程式补充完整:H2SeO3+2HCOOH
 Se+
Se+ +
+ 。
。(4)常温下,H2SeO3电离平衡体系中含Se(+4价)微粒的物质的量分数与pH的关系如图所示。
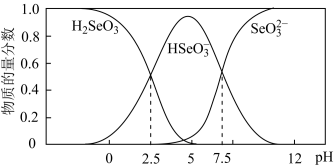
向亚硒酸溶液滴入氨水至pH=2.5,过程中主要反应的离子方程式
(5)还原时,进行了下述实验:向10mL2.5mol·L-1亚硒酸溶液中先加入10mL氨水,再加入10mL甲酸溶液(甲酸浓度分别为5、7.5及10mol·L-1),加热至沸腾(103℃),反应10小时,实验数据如图所示。
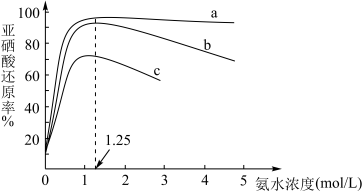
①曲线
②当氨水浓度在0~1.25mol·L-1之间,随着氨水浓度逐渐增大,亚硒酸还原率逐渐升高,其可能的原因是
(6)粗硒中硒含量测定:
在一定条件下,将0.1000g粗硒中的Se完全转化为H2SeO3溶液,用V1mL0.1000mol·L-1Na2S2O3溶液进行滴定。终点前加入KI淀粉溶液做指示剂,继续用V2mL0.1000mol·L-1Na2S2O3溶液滴定至溶液蓝色消失。发生的反应:
H2SeO3+4S2O
 +4H+=Se+2S4O
+4H+=Se+2S4O +3H2O
+3H2O ;
;H2SeO3+4I-+4H+=Se+2I2+3H2O;
I2+2S2O
 =2I-+S4O
=2I-+S4O 。则粗硒中Se的质量分数为
。则粗硒中Se的质量分数为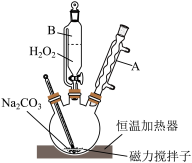
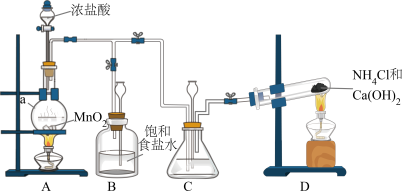
(1)装置中仪器A的名称为
(2)按图连接好装置后,先将饱和Na2CO3溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入30%H2O2溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是_______。
| A.FeCl3 | B.Na2SiO3 | C.MnO2 | D.Na2SO3 |
(4)反应后向混合物中加入NaCl固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入NaCl固体的作用是
(5)过碳酸钠样品中H2O2含量的测定。
取bg2Na2CO3•3H2O2(M=314g/mol)配成100mL溶液,取25.00mL溶液于锥形瓶,加入足量稀硫酸,用0.04000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液VmL。
①已知KMnO4只与H2O2发生反应,配平该反应
______H2O2+______
 +_______=_______Mn2++_______+_______H2O
+_______=_______Mn2++_______+_______H2O实验达到滴定终点的现象是
②该过氧碳酸钠的产品纯度为
③滴定时间过长,测得过碳酸钠产品纯度将
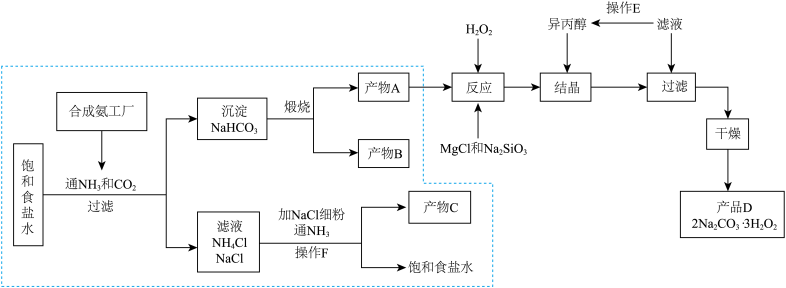
【推荐1】过碳酸钠 是过氧化物类的消毒剂,可以利用侯氏制碱法得到的
是过氧化物类的消毒剂,可以利用侯氏制碱法得到的 ,进行制备,流程图如下:
,进行制备,流程图如下:
已知:①产物 中可能含有少量的
中可能含有少量的 、
、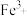 金属离子杂质。②硅酸钠可与
金属离子杂质。②硅酸钠可与 、
、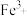 等高价金属离子形成沉淀。
等高价金属离子形成沉淀。
请回答下列问题:
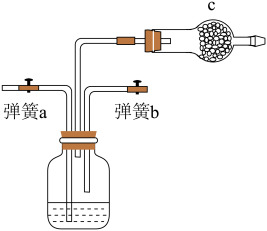
(1)虚线框中是侯氏制碱法的原理,某同学用右图装置在实验室模拟侯氏制碱法,实验中应先打开弹簧夹 或
或 ),通入
),通入
(2)索尔维制碱法是利用石灰石分解制备 ,并用生成的
,并用生成的 和
和 反应制备氨气,将
反应制备氨气,将 和
和 通入饱和食盐水制备
通入饱和食盐水制备 晶体,分离提纯后分解制备纯碱。与索尔维制碱法相比,侯氏制碱法的优点是(至少写两点)
晶体,分离提纯后分解制备纯碱。与索尔维制碱法相比,侯氏制碱法的优点是(至少写两点)
(3)“反应”需控制温度在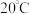 左右,写出“反应”中生成产品
左右,写出“反应”中生成产品 的化学方程式
的化学方程式 的作用是
的作用是
(4)流程图中可循环使用的物质有
(5)操作 的主要步骤有
的主要步骤有 和
和 的溶解度曲线如图所示)
的溶解度曲线如图所示)

(6)为了测定产品 的纯度,某小组的方法是:取
的纯度,某小组的方法是:取 产品配成
产品配成 的溶液,取出
的溶液,取出 用
用 用硫酸酸化的
用硫酸酸化的 溶液滴定至终点,该滴定过程中消耗高锰酸钾标准溶液的体积为
溶液滴定至终点,该滴定过程中消耗高锰酸钾标准溶液的体积为 。产品的纯度为
。产品的纯度为 和
和 的式子表示)。
的式子表示)。
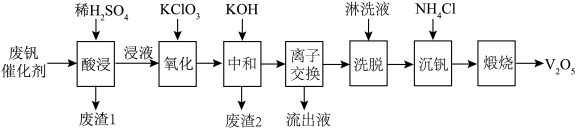
已知:①钒的氧化物在酸性条件下以
 、VO2+存在;
、VO2+存在;②“离子交换”和“洗脱”过程可简单表示为4ROH+V4O
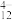
 R4V4O12+4OH−。
R4V4O12+4OH−。(1)废渣1的主要成分为
(2)“氧化”过程中发生的化学方程式为
(3)“中和”过程中,含钒离子发生反应的离子方程式为
(4)“离子交换”时,应选择
(5)“沉钒”过程中获得沉淀Y的摩尔质量为598 g·mol−1,且仅含有四种元素。取59.8g沉淀Y的样品充分焙烧,得到产品54.6g,将产生的气体通过足量碱石灰,碱石灰增重1.8g,剩余的气体再通入稀硫酸被完全吸收。通过计算确定沉淀Y的化学式为
(6)测定产品中V2O5的纯度:称取ag产品,先用硫酸溶解,得到(VO2)SO4溶液。 再加b1mL c1 mol·L−1 (NH4)2Fe(SO4)2溶液(
 +2H++Fe2+=VO2++Fe3++H2O)。最后用c2 mol·L−1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO4−被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g·mol−1)的质量分数是
+2H++Fe2+=VO2++Fe3++H2O)。最后用c2 mol·L−1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO4−被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g·mol−1)的质量分数是I.制取铋酸钠。制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
| 物质 | NaBiO3 | Bi(OH)3 |
| 性质 | 不溶于冷水;浅黄色 | 难溶于水;白色 |
(2)当观察到
(3)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭
(4)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有
II.铋酸钠的应用——检验Mn2+
(5)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为
III.产品纯度的测定
(6)取上述NaBiO3产品a g,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmol·L-l的H2C2O4标准溶液滴定生成的MnO
 (已知:H2C2O4+MnO
(已知:H2C2O4+MnO —CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗c mL标准溶液。该产品的纯度为
—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗c mL标准溶液。该产品的纯度为(1)Y元素的原子结构示意图是
(2)X、Z最高价氧化物对应的水化物之间发生反应的离子方程式为
(3)Z、碳和氟三种元素可组成氟利昂(CZ3F),它在紫外线作用下破坏臭氧层的反应过程部如下:
①CZ3F
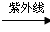 CZ2F·+Z·
CZ2F·+Z·②Z·+O3
 O2+ZO·
O2+ZO·③ ZO·+O·
 Z·+O2
Z·+O2反应①中破坏的化学键属于
(4)下列说法正确的是
a.X与氧元素可形成碱性氧化物
b.常温下与水反应的难易程度可证明金属性:X>Y
c.X、Y、Z形成的简单离子的核外电子排布均相同
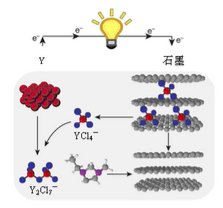
(5)Y、石墨与含YCl4-的离子液体可构成原电池,其工作原理如图所示。若电路中转移电子的物质的量为4. 5 mol,则消耗Y单质的质量是
(1)基态
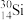 原子的核外电子排布式为
原子的核外电子排布式为(2)比较:①熔点高低:MgO
(3)SiCl4是无色透明液体,可以与N-甲基咪唑
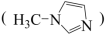 等物质反应。
等物质反应。①将用毛皮摩擦过的橡胶棒靠近SiCl4液流,液体流
②一个N-甲基咪唑分子中含有
(4)硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以表示成
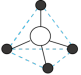 :其中
:其中 表示氧原子,中心
表示氧原子,中心 表示硅原子,其俯视图为
表示硅原子,其俯视图为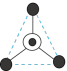 。
。①SiO2晶胞可理解成将金刚石晶胞(如图1所示)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。
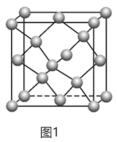
推测SiO2晶胞中含有
②蒙脱石散中的“(SixOy)”是一种大片层状的多硅酸根,其可能结构如图2所示,则x∶y=
(1)X元素的基态原子的核外电子排布式为
(2)若X、Y两元素电负性分别为1.8和3.0,则XY4中X与Y之间的化学键为
(3)该化合物的空间结构为
(4)该化合物的沸点与SiCl4比较:
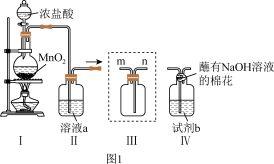
(1)制备Cl2。装置I中发生如下反应:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。从反应物中任选一种物质,说明其发生氧化反应
MnCl2+Cl2↑+2H2O。从反应物中任选一种物质,说明其发生氧化反应(2)除去Cl2中混有的HCl。装置II中溶液a为饱和
(3)收集Cl2。装置III中气体应该从集气瓶的
(4)氯水相关物质的性质探究。
①若装置IV中试剂b为H2O,制得氯水。氯水呈黄绿色是由于其中含有
②若装置IV中试剂b为CCl4,可制得Cl2的CCl4溶液(Cl2可溶于CCl4,且不与CCl4反应)。取稀盐酸、新制氯水、Cl2的CCl4溶液,分别滴在三张红色纸条上,可观察到
③验证氯水中HClO光照分解的产物。将装置IV广口瓶中的氯水转移至三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如图2),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。
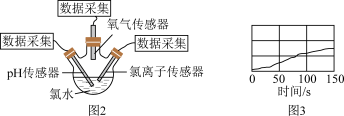
若能够证明氯水中HClO在光照下发生了分解反应,则图3中纵坐标可以表示的物理量是
a.氯水的pH b.氢离子的浓度 c.氯离子的浓度 d.氧气的体积分数
(1)某实验小组探究实验室制备无水氯化镁的方法,设计了如下图装置。
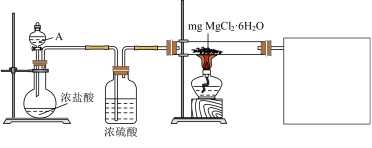
①分液漏斗中的A物质是
②利用中学常见的仪器,某同学在空白方框内补充完整实验装置,他选择的试剂有
A.稀NaOH溶液 B.无水氯化钙 C.稀硫酸 D.浓硫酸
(2)实验室制备并收集纯净乙烯。
①有的同学通过乙醇制备乙烯,写出相关化学方程式:
②有的同学探究其他制备乙烯的方法,他设计了下图装置制备乙烯。实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体。请分析气体产率很低的原因主要是
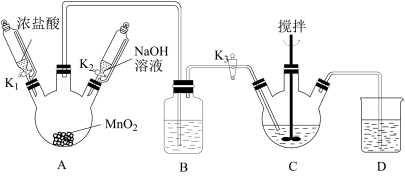
按如图组装好实验装置,Q为一可鼓胀收缩的塑料气袋,取适量样品于其中,打开分液漏斗活塞,将稀盐酸滴入气袋中至充分反应。
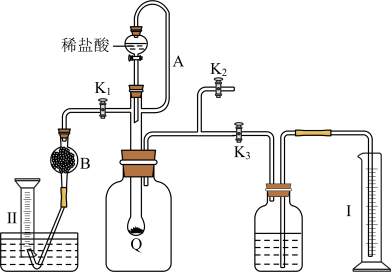
(1)为测定反应生成气体的总体积滴稀盐酸前必须关闭
(2)当上述反应停止后,使K1、K3处于关闭状态,K2处于打开状态,再缓缓打开K1。B中装的固体试剂是
(3)实验结束时,装置内的气体同温同压,测得量筒I中有x mL水,量筒Ⅱ中收集到了y mL气体,则样品中过碳酸钠的质量分数是



