金属钛在航天、医疗等领域有着广泛的应用。工业上用钛铁矿(主要成分为FeTiO3,含有Fe2O3、CaO、SiO2等杂质)为原料制备金属钛的工艺流程如下:
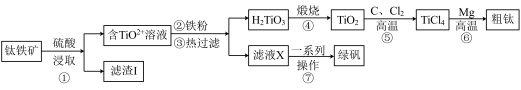
已知:FeTiO3中Fe为+2价;高温下钛易与N2、H2反应。
(1)提高①中浸取反应速率可采取的措施有___________ (答两条)。
(2)“滤渣I”的主要成分为___________ 。
(3)钛铁矿与硫酸发生非氧化还原反应,生成TiOSO4,试写出该反应的化学方程式________ 。
(4)⑥中镁与TiCl4高温下反应制备粗钛时需加保护气,下列可作为保护气的是________ (填标号)。
a.H2 b.Ar c.Cl2 d.N2
(5)⑦中经过“一系列操作”可获得副产品绿矾( ),其过程包括
),其过程包括_____ 、洗涤、干燥。
(6)绿矾易被氧化而变质。现取在空气中放置一段时间的某绿矾样品,请选择合适的试剂,设计实验方案,证明该样品被部分氧化:___________ 。

已知:FeTiO3中Fe为+2价;高温下钛易与N2、H2反应。
(1)提高①中浸取反应速率可采取的措施有
(2)“滤渣I”的主要成分为
(3)钛铁矿与硫酸发生非氧化还原反应,生成TiOSO4,试写出该反应的化学方程式
(4)⑥中镁与TiCl4高温下反应制备粗钛时需加保护气,下列可作为保护气的是
a.H2 b.Ar c.Cl2 d.N2
(5)⑦中经过“一系列操作”可获得副产品绿矾(
 ),其过程包括
),其过程包括(6)绿矾易被氧化而变质。现取在空气中放置一段时间的某绿矾样品,请选择合适的试剂,设计实验方案,证明该样品被部分氧化:
更新时间:2023-05-28 11:07:52
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某化学兴趣小组用下图装置(部分夹持装置已略去)制取氨气并探究其性质。_______ (填化学式)。
(2)气体通过C、D装置时,试纸颜色会发生变化的是________ (填字母),原因是________ 。
(3)当E装置中集满NH3时,挤压胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是_______ 。
(4)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。_______ ,证明氨气具有______ (填“氧化性”或“还原性”)。
②若向a中通入标准状况下3.36 L的氨气,理论上会得到铜的质量为_____ g。
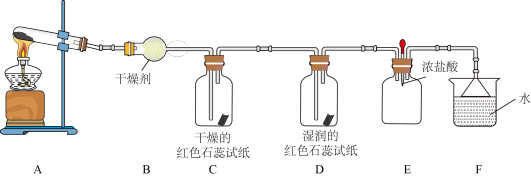
(2)气体通过C、D装置时,试纸颜色会发生变化的是
(3)当E装置中集满NH3时,挤压胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是
(4)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
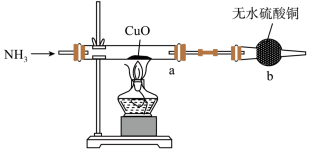
②若向a中通入标准状况下3.36 L的氨气,理论上会得到铜的质量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1mol•L-1]形成氢氧化物沉淀的pH范围如表:
(1)“滤渣1”含有S和_____ ;在稀硫酸“溶浸”中二氧化锰与硫化锰发生氧化还原反应,还原剂是_____ 。
(2)“氧化”中添加适量的MnO2的作用是_____ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_____ 6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_____ 。
(5)写出“沉锰”的离子方程式_____ 。
(6)工业上常用NH4HCO3做金属离子的沉淀剂,而不用Na2CO3或NaHCO3,其优点是NH4HCO3溶解度大,容易洗涤,过量时受热易分解,便于分离除去。写出分解的化学方程式_____ 。

相关金属离子[c0(Mn+)=0.1mol•L-1]形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(2)“氧化”中添加适量的MnO2的作用是
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)写出“沉锰”的离子方程式
(6)工业上常用NH4HCO3做金属离子的沉淀剂,而不用Na2CO3或NaHCO3,其优点是NH4HCO3溶解度大,容易洗涤,过量时受热易分解,便于分离除去。写出分解的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】Ⅰ.钠是典型的金属元素,钠的化合物具有广泛的用途。请回答以下问题:
(1)15.6g 溶于水中配制成2L的溶液,其中
溶于水中配制成2L的溶液,其中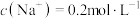 ,则X的摩尔质量为
,则X的摩尔质量为______ 。
(2) 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知 能发生如下反应:
能发生如下反应: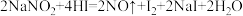 。上述反应中HI在反应中体现的性质为
。上述反应中HI在反应中体现的性质为______ 。标况下,每生成11.2L的NO气体,转移的电子数约为______ 个。
(3)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO______  (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1∶1时,该反应的还原产物为
的个数比为1∶1时,该反应的还原产物为______ (填字母序号)。
A. B.
B. C.
C. D.NaCl E.NaClO
D.NaCl E.NaClO
Ⅱ.化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。侯氏制碱法的工艺流程图如下:

(4)工艺流程中“碳酸化”时发生主要反应的化学方程式为______ 。
(5)流程中可循环利用的物质为______ (填化学式)。
(6)产品分析:把5.8g含有少量NaCl杂质的 样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量
样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重1.4g,则产品纯度为
增重1.4g,则产品纯度为______ (用百分数表示,保留到小数点后1位)。
(1)15.6g
 溶于水中配制成2L的溶液,其中
溶于水中配制成2L的溶液,其中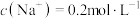 ,则X的摩尔质量为
,则X的摩尔质量为(2)
 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知 能发生如下反应:
能发生如下反应: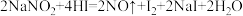 。上述反应中HI在反应中体现的性质为
。上述反应中HI在反应中体现的性质为(3)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与
 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1∶1时,该反应的还原产物为
的个数比为1∶1时,该反应的还原产物为A.
 B.
B. C.
C. D.NaCl E.NaClO
D.NaCl E.NaClOⅡ.化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。侯氏制碱法的工艺流程图如下:

(4)工艺流程中“碳酸化”时发生主要反应的化学方程式为
(5)流程中可循环利用的物质为
(6)产品分析:把5.8g含有少量NaCl杂质的
 样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量
样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重1.4g,则产品纯度为
增重1.4g,则产品纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造、化工生产等行业的重要材料。工业上用铝土矿(主要成分为Al2O3,Fe2O3、SiO2等(二氧化硅是酸性氧化物))提取纯Al2O3做冶炼铝的原料,某研究性学习小组设计了如下提取流程图

(1)固体Ⅰ、Ⅱ的化学式分别为____________ 、________________ ;
(2)操作Ⅰ所需玻璃仪器有____________________ ;
(3)写出流程③主要离子方程式______________________ ;
(4)验证滤液Ⅰ中是否含Fe3+,可取少量滤液A并加入_______ (填试剂名称),现象是_______ ;
(5)从铝土矿中提取铝的过程不涉及的化学反应类型是__________;
(6)生产过程中除CaO、CO2可以循环使用外,还可以循环使用的物质有________ ;(填化学式)
(7)若向滤液I中逐滴滴入NaOH溶液至过量,产生沉淀随NaOH滴入关系正确的是_______

(1)固体Ⅰ、Ⅱ的化学式分别为
(2)操作Ⅰ所需玻璃仪器有
(3)写出流程③主要离子方程式
(4)验证滤液Ⅰ中是否含Fe3+,可取少量滤液A并加入
(5)从铝土矿中提取铝的过程不涉及的化学反应类型是__________;
| A.复分解反应 | B.氧化还原反应 | C.置换反应 | D.分解反应 |
(7)若向滤液I中逐滴滴入NaOH溶液至过量,产生沉淀随NaOH滴入关系正确的是_______
A. | B.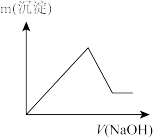 |
C. | D. |
您最近一年使用:0次
【推荐2】黄钠铁矾[NaFe3(SO4)2(OH)6]是一种高效净水剂,Ni(OH)2可作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备黄钠铁矾和Ni(OH)2,工艺流程如图所示。

已知:①次磷酸钠(NaH2PO2)具有还原性;②亚磷酸(H3PO3)是二元弱酸。
回答下列问题:
(1)“研磨”的目的是_______ ;
(2)为了提高“酸浸”的速率,最好使用“浓硫酸”代替“稀硫酸”,该做法_______ 正确(填“是”或“否”);
(3)“滤渣I”的主要成分为_______ ;
(4)“氧化”过程中发生反应的离子方程式为:_______ ;为了证明加入的NaClO3已足量,可取“氧化”后的溶液,向其中加入_______ 来检验(填标号)。
a.KSCN溶液 b.K3[Fe(CN)6]溶液 c.酸性KMnO4溶液
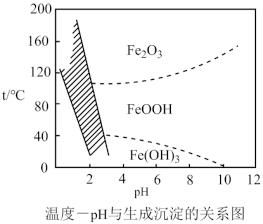
(5)“沉铁”过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域),若控制pH=2,沉铁的最佳温度范围为_______ ;若反应在低于40℃时进行,加碳酸钠偏多,则所得黄钠铁矾中混有的杂质是_______ 。
(6)化学镀镍是金属表面镀镍的常用方法。以NiSO4和NaH2PO2为原料,在90℃的酸性溶液中镀镍,同时生成H3PO3。写出化学镀镍反应的离子方程式_______ 。

已知:①次磷酸钠(NaH2PO2)具有还原性;②亚磷酸(H3PO3)是二元弱酸。
回答下列问题:
(1)“研磨”的目的是
(2)为了提高“酸浸”的速率,最好使用“浓硫酸”代替“稀硫酸”,该做法
(3)“滤渣I”的主要成分为
(4)“氧化”过程中发生反应的离子方程式为:
a.KSCN溶液 b.K3[Fe(CN)6]溶液 c.酸性KMnO4溶液
(5)“沉铁”过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域),若控制pH=2,沉铁的最佳温度范围为

(6)化学镀镍是金属表面镀镍的常用方法。以NiSO4和NaH2PO2为原料,在90℃的酸性溶液中镀镍,同时生成H3PO3。写出化学镀镍反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】工业由钛铁矿(主要成分FeTiO3,Fe2O3、Al2O3、FeO、SiO2等杂质)制备TiCl4的工艺流程如下:
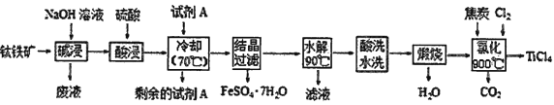
已知:
①酸浸 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
②水解 TiOSO4(aq)+2H2O(l) H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
③煅烧 H2TiO3(s) TiO2(s)+H2O(s)
TiO2(s)+H2O(s)
(1)FeTiO3中钛元素的化合价为_________ ,试剂A为____________________ 。
(2)碱浸过程发生反应的离子反应方程式为________________________________________ 。
(3)酸浸后需将溶液温度冷却至70℃左右,若温度过高会导致最终产品吸收率过低,原因是____________ 。
(4)上述流程中氯化过程的化学反应方程式为________________________________________ 。
已知TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) △H=+151kJ·mol-1。该反应极难进行,当向反应体系中加入碳后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是
TiCl4(l)+O2(g) △H=+151kJ·mol-1。该反应极难进行,当向反应体系中加入碳后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是_______________________________ 。
(5)TiCl4极易水解,利用此性质可制备纳米级TiO2·xH2O,该反应的化学反应方程式是_____________ 。

已知:
①酸浸 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
②水解 TiOSO4(aq)+2H2O(l)
 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)③煅烧 H2TiO3(s)
 TiO2(s)+H2O(s)
TiO2(s)+H2O(s)(1)FeTiO3中钛元素的化合价为
(2)碱浸过程发生反应的离子反应方程式为
(3)酸浸后需将溶液温度冷却至70℃左右,若温度过高会导致最终产品吸收率过低,原因是
(4)上述流程中氯化过程的化学反应方程式为
已知TiO2(s)+2Cl2(g)
 TiCl4(l)+O2(g) △H=+151kJ·mol-1。该反应极难进行,当向反应体系中加入碳后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是
TiCl4(l)+O2(g) △H=+151kJ·mol-1。该反应极难进行,当向反应体系中加入碳后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是(5)TiCl4极易水解,利用此性质可制备纳米级TiO2·xH2O,该反应的化学反应方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】已知:溴苯的沸点为 ,苯的沸点为
,苯的沸点为 。实验室用苯和液溴制取溴苯并验证反应类型的实验装置如图:
。实验室用苯和液溴制取溴苯并验证反应类型的实验装置如图:
(1)冷凝管的进水口为__________ (填“A”或“B”);冷凝管的作用:__________ 。
(2)d中盛放的试剂是__________ 。
(3)有同学认为苯与溴的反应为取代反应,请根据该实验装置特点和实验现象。叙述得出这一结论的实验现象:_____________ 。
(4)分离提纯:
①反应后a瓶中的溴苯中因溶有溴而显褐色,提纯溴苯的过程中,除去溴苯中的溴可加入__________ 溶液,振荡,再通过__________ (填分离方法)分离提纯;
②苯与溴还可能发生副反应生成对二溴苯(沸点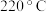 )和邻二溴苯(沸点
)和邻二溴苯(沸点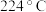 ),因此最后再经
),因此最后再经_______ (填分离方法)即可得到较纯净的溴苯,该过程中为了受热均匀和易于控制温度,可采用_______ (填“水浴”或“油浴”)加热
(5)检验鉴别:充分反应后,三颈烧瓶中的粗产品经水洗、分液后得到水洗液,为验证水洗液中是否存在 不能选用的试剂是__________(填字母)
不能选用的试剂是__________(填字母)
 ,苯的沸点为
,苯的沸点为 。实验室用苯和液溴制取溴苯并验证反应类型的实验装置如图:
。实验室用苯和液溴制取溴苯并验证反应类型的实验装置如图: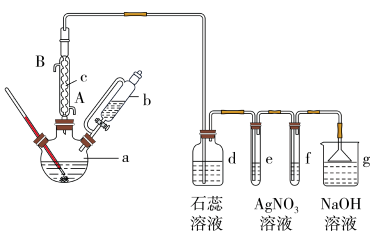
(1)冷凝管的进水口为
(2)d中盛放的试剂是
(3)有同学认为苯与溴的反应为取代反应,请根据该实验装置特点和实验现象。叙述得出这一结论的实验现象:
(4)分离提纯:
①反应后a瓶中的溴苯中因溶有溴而显褐色,提纯溴苯的过程中,除去溴苯中的溴可加入
②苯与溴还可能发生副反应生成对二溴苯(沸点
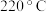 )和邻二溴苯(沸点
)和邻二溴苯(沸点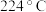 ),因此最后再经
),因此最后再经(5)检验鉴别:充分反应后,三颈烧瓶中的粗产品经水洗、分液后得到水洗液,为验证水洗液中是否存在
 不能选用的试剂是__________(填字母)
不能选用的试剂是__________(填字母)A. 溶液 溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D.苯酚溶液 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】已知有以下物质相互转化
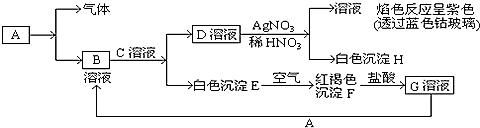
试回答:
(1)写出B的化学式___ 。C的化学式___ 。D的化学式___ 。
(2)写出由E转变成F的化学方程式___ 。
(3)把KSCN加到G溶液中的现象是___ ;向G溶液加入A的有关离子反应方程式___ 。
(4)焰色反应是___ (填物理或化学)变化,经过焰色反应试验后的铂丝可选择下面___ (填字母)试剂清洗。
A.硫酸 B.盐酸 C.硝酸
(5)选择合适的方法除杂:
①Fe2O3[Fe(OH)2]______ 。
②FeCl3溶液(FeCl2)______ 。
③FeCl2溶液(FeCl3)______ 。

试回答:
(1)写出B的化学式
(2)写出由E转变成F的化学方程式
(3)把KSCN加到G溶液中的现象是
(4)焰色反应是
A.硫酸 B.盐酸 C.硝酸
(5)选择合适的方法除杂:
①Fe2O3[Fe(OH)2]
②FeCl3溶液(FeCl2)
③FeCl2溶液(FeCl3)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某小组同学分别探究 溶液、
溶液、 溶液的性质。
溶液的性质。
Ⅰ.探究 溶液的性质。
溶液的性质。
(1)基于 中
中 元素的化合价,小组同学预测
元素的化合价,小组同学预测 具有还原性,预测依据是
具有还原性,预测依据是___________ 。因此可以与酸性 溶液反应,并进行如下实验操作:
溶液反应,并进行如下实验操作:
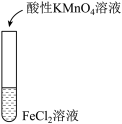
ⅰ中的现象是___________ ,某同学认为ⅰ中现象并不能证明 具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象、②
具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象、②___________ ,为证实该反应中 确实被氧化,需要在反应后的溶液中检验有
确实被氧化,需要在反应后的溶液中检验有 的生成才可证明。
的生成才可证明。
Ⅱ.探究 溶液的性质。
溶液的性质。
小组同学依次进行如下实验操作并观察到对应现象:
(2)ⅳ中溶液变红的原因是___________ 。
Ⅲ.小组同学探究ⅳ中褪色原因,提出两种假设:a.铁离子被转化,b. 被转化。
被转化。
(3)分别向褪色后的溶液中滴加 溶液和
溶液和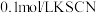 溶液各1滴,观察到
溶液各1滴,观察到___________ 现象,得出结论:假设b成立。
(4)进一步预测 可能被转化为
可能被转化为 ,并通过实验验证了该预测。已知
,并通过实验验证了该预测。已知 中N的化合价为
中N的化合价为 价,S的化合价为
价,S的化合价为 价。若
价。若 与
与 反应生成
反应生成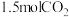 时转移电子
时转移电子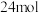 ,则该反应中
,则该反应中 的N被转化为
的N被转化为___________ 。
 溶液、
溶液、 溶液的性质。
溶液的性质。Ⅰ.探究
 溶液的性质。
溶液的性质。(1)基于
 中
中 元素的化合价,小组同学预测
元素的化合价,小组同学预测 具有还原性,预测依据是
具有还原性,预测依据是 溶液反应,并进行如下实验操作:
溶液反应,并进行如下实验操作:
ⅰ中的现象是
 具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象、②
具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象、② 确实被氧化,需要在反应后的溶液中检验有
确实被氧化,需要在反应后的溶液中检验有 的生成才可证明。
的生成才可证明。Ⅱ.探究
 溶液的性质。
溶液的性质。小组同学依次进行如下实验操作并观察到对应现象:
| 操作 | 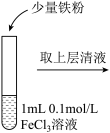 | 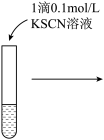 |  |
| ⅱ | ⅲ | ⅳ | |
| 现象 | 溶液由棕黄色变为浅绿色 | 无明显现象 | 溶液变为红色,而后红色褪去 |
Ⅲ.小组同学探究ⅳ中褪色原因,提出两种假设:a.铁离子被转化,b.
 被转化。
被转化。(3)分别向褪色后的溶液中滴加
 溶液和
溶液和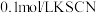 溶液各1滴,观察到
溶液各1滴,观察到(4)进一步预测
 可能被转化为
可能被转化为 ,并通过实验验证了该预测。已知
,并通过实验验证了该预测。已知 中N的化合价为
中N的化合价为 价,S的化合价为
价,S的化合价为 价。若
价。若 与
与 反应生成
反应生成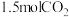 时转移电子
时转移电子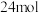 ,则该反应中
,则该反应中 的N被转化为
的N被转化为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】聚合硫酸铁是一种新型高效的无机高分子絮凝剂。用硫酸亚铁晶体及硫酸为原料催化氧化法生成硫酸铁,再水解、聚合成产品。实验室模拟生产过程如下:
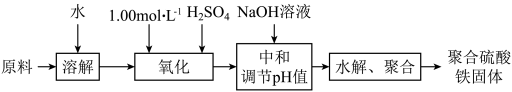
已知Fe3+能水解成氢氧化铁:Fe3++3H2O===Fe(OH)3+3H+,为了防止Fe3+水解需加入硫酸。
(1)①用原料配制2.50 moL·L-1的硫酸亚铁溶液时用到的定量仪器有_________________ 。
②写出氧化过程中的离子方程式:________ 。
(2)综合考虑实际投料硫酸亚铁与硫酸的物质的量之比为1/1.25左右最佳,加入的硫酸比理论值稍多,但不能过多的原因是__________________________________ 。
(3)硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3·ySO3·zH2O),现采用重量法测定x、y、z的值。
①测定时所需的试剂是______ (填选项序号)。
A.NaOH B. Ba(OH)2
C.BaCl2D.FeSO4
②需要测定________ 和__________ 的质量(填写化合物的化学式)。
(4)选出测定过程中所需的基本操作(按操作先后顺序列出)______________ (填序号)。
①过滤、洗涤 ②蒸发、结晶 ③萃取、分液 ④冷却、称量 ⑤烘干或灼烧

已知Fe3+能水解成氢氧化铁:Fe3++3H2O===Fe(OH)3+3H+,为了防止Fe3+水解需加入硫酸。
(1)①用原料配制2.50 moL·L-1的硫酸亚铁溶液时用到的定量仪器有
②写出氧化过程中的离子方程式:
(2)综合考虑实际投料硫酸亚铁与硫酸的物质的量之比为1/1.25左右最佳,加入的硫酸比理论值稍多,但不能过多的原因是
(3)硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3·ySO3·zH2O),现采用重量法测定x、y、z的值。
①测定时所需的试剂是
A.NaOH B. Ba(OH)2
C.BaCl2D.FeSO4
②需要测定
(4)选出测定过程中所需的基本操作(按操作先后顺序列出)
①过滤、洗涤 ②蒸发、结晶 ③萃取、分液 ④冷却、称量 ⑤烘干或灼烧
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取Cu2(OH)2SO4的工艺流程如下:

(1) 步骤Ⅰ“氨浸”时,控制温度为50~55 ℃,pH约为9.5,含铜化合物转化为[Cu(NH3)4]SO4溶液。
① CuO被浸取的离子方程式为________ 。
②浸取温度不宜超过55 ℃,其原因是________ 。
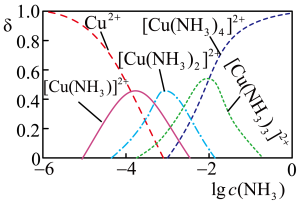
③ Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(δ)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1 L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为[Cu(NH3)4]2+(CO32-转变为HCO3-,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是________ 。
(2) “除AsO2-”时,FeSO4需过量,一方面使AsO2-沉淀完全,另一目的是________ 。
(3) “蒸氨”时发生反应的化学方程式为________ 。
(4) 为了实现生产过程中物质循环利用,可采取的措施为________ 。

(1) 步骤Ⅰ“氨浸”时,控制温度为50~55 ℃,pH约为9.5,含铜化合物转化为[Cu(NH3)4]SO4溶液。
① CuO被浸取的离子方程式为
②浸取温度不宜超过55 ℃,其原因是
③ Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(δ)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1 L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为[Cu(NH3)4]2+(CO32-转变为HCO3-,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是

(2) “除AsO2-”时,FeSO4需过量,一方面使AsO2-沉淀完全,另一目的是
(3) “蒸氨”时发生反应的化学方程式为
(4) 为了实现生产过程中物质循环利用,可采取的措施为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】三氧化二锑(Sb2O3)是一种两性氧化物,俗称锑白,可用作阻燃剂。一种以脆硫铅锑矿(主要成分为Pb4FeSb6S14)为原料制备锑白的工艺流程图如下:

已知:①金属阳离子开始沉淀、完全沉淀的pH如下表所示:
②氯化浸出后的浸出液中除SbCl5外,还含SbCl3、PbCl2、FeCl3。请回答下列问题:
(1)将矿石粉碎的目的为_____________ 。
(2)滤渣I的主要成分为_____________ (填名称)。
(3)已知Fe3+和Sb5+的氧化性相当,加入锑粉除了将Sb5+还原为Sb3+外,另外一个作用是_______________ 。
(4)SbCl3分子内所有原子最外层均达8电子稳定结构,SbCl3的电子式为____________ ,写出SbCl3水解的离子方程式_____________ 。
(5)加入碱性物质中和时,选用NH3·H2O而不选用NaOH的原因是______ (用化学方程式表示)。

已知:①金属阳离子开始沉淀、完全沉淀的pH如下表所示:
| pb2+ | Sb3+ | Fe2+ | Fe3+ | |
| 开始沉淀pH | 7.04 | 0.53 | 7.0 | 1.9 |
| 完全沉淀pH | 9.04 | 2.05 | 9.0 | 3.2 |
②氯化浸出后的浸出液中除SbCl5外,还含SbCl3、PbCl2、FeCl3。请回答下列问题:
(1)将矿石粉碎的目的为
(2)滤渣I的主要成分为
(3)已知Fe3+和Sb5+的氧化性相当,加入锑粉除了将Sb5+还原为Sb3+外,另外一个作用是
(4)SbCl3分子内所有原子最外层均达8电子稳定结构,SbCl3的电子式为
(5)加入碱性物质中和时,选用NH3·H2O而不选用NaOH的原因是
您最近一年使用:0次



