2024高三下·全国·专题练习
1 . 硫氰化钾( )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示: 不溶于水,密度比水的大;
不溶于水,密度比水的大;
② 不溶于
不溶于 ;
;
③三颈烧瓶内盛放有 、水和催化剂。
、水和催化剂。
回答下列问题:
制备 溶液:
溶液:
测定晶体中 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴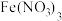 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。
(1)滴定时发生的反应: (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是_______ 。
(2)晶体中 的质量分数为
的质量分数为_______ (结果精确至0.1%)。
 )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示: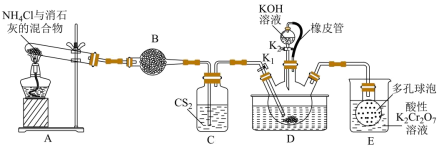
 不溶于水,密度比水的大;
不溶于水,密度比水的大;②
 不溶于
不溶于 ;
;③三颈烧瓶内盛放有
 、水和催化剂。
、水和催化剂。回答下列问题:
制备
 溶液:
溶液:测定晶体中
 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴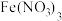 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。(1)滴定时发生的反应:
 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是(2)晶体中
 的质量分数为
的质量分数为
您最近一年使用:0次
2024高三下·全国·专题练习
2 . 测定钛白中TiO2的含量可用滴定分析法:称取mg样品放入锥形瓶中,加入H2SO4和(NH4)2SO4混合溶液,加热使样品溶解。冷却后,加入足量稀盐酸(Ti元素存在形式变为TiO2+)。加入过量铝粉将TiO2+充分还原[ (未配平)],待过量金属铝完全溶解并冷却后,滴加2~3滴指示剂,用cmol/L的NH4Fe(SO4)2标准溶液进行滴定(Fe3+能将Ti3+氧化成四价钛的化合物),重复上述滴定操作2~3次,平均消耗NH4Fe(SO4)2标准溶液VmL。
(未配平)],待过量金属铝完全溶解并冷却后,滴加2~3滴指示剂,用cmol/L的NH4Fe(SO4)2标准溶液进行滴定(Fe3+能将Ti3+氧化成四价钛的化合物),重复上述滴定操作2~3次,平均消耗NH4Fe(SO4)2标准溶液VmL。
(1)过量铝粉的作用除了还原TiO2+外,另一个作用是___________ 。
(2)上述滴定过程中应选用指示剂为___________ 。
(3)下列关于滴定分析的操作,不正确 的是___________ 。
A.用托盘天平称量TiO2样品mg
B.滴定管用蒸馏水洗涤时,洗涤液应从滴定管下端放出
C.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得TiO2的含量测定结果偏高
(4)钛白中TiO2质量分数为___________ 。(写出最简表达式即可)。
 (未配平)],待过量金属铝完全溶解并冷却后,滴加2~3滴指示剂,用cmol/L的NH4Fe(SO4)2标准溶液进行滴定(Fe3+能将Ti3+氧化成四价钛的化合物),重复上述滴定操作2~3次,平均消耗NH4Fe(SO4)2标准溶液VmL。
(未配平)],待过量金属铝完全溶解并冷却后,滴加2~3滴指示剂,用cmol/L的NH4Fe(SO4)2标准溶液进行滴定(Fe3+能将Ti3+氧化成四价钛的化合物),重复上述滴定操作2~3次,平均消耗NH4Fe(SO4)2标准溶液VmL。(1)过量铝粉的作用除了还原TiO2+外,另一个作用是
(2)上述滴定过程中应选用指示剂为
(3)下列关于滴定分析的操作,
A.用托盘天平称量TiO2样品mg
B.滴定管用蒸馏水洗涤时,洗涤液应从滴定管下端放出
C.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得TiO2的含量测定结果偏高
(4)钛白中TiO2质量分数为
您最近一年使用:0次
3 . 我国硒储量居世界首位,硒广泛用于冶金、陶瓷、电子、太阳能等领域。工业上常将含硒废料处理得到亚硒酸( )和硒酸(
)和硒酸(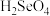 ),进而制备单质硒。
),进而制备单质硒。
(1)基态硒原子核外电子的空间运动状态有________ 种。
(2)甲硒醇(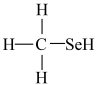 )的熔沸点低于甲醇(
)的熔沸点低于甲醇(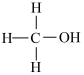 ),原因是
),原因是________________ 。
(3) 亚硒酸溶液中含硒微粒的分布系数
亚硒酸溶液中含硒微粒的分布系数 与溶液
与溶液 的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
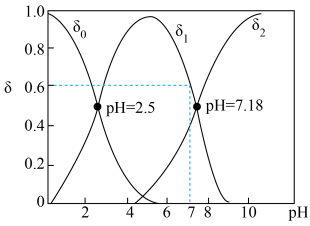
①曲线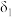 表示的含硒微粒是
表示的含硒微粒是________ 。
②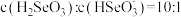 ,溶液
,溶液
________ 。
③向溶液中滴入氨水, 由5.5增大到7.3的过程中,主要反应的离子方程式为
由5.5增大到7.3的过程中,主要反应的离子方程式为________________ , 时,溶液中
时,溶液中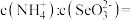
_______ 。
④在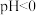 的酸性环境下,向溶液中通入
的酸性环境下,向溶液中通入 制得单质
制得单质 的离子方程式为
的离子方程式为________________ 。
(4) 可以用于测定粗硒中硒的含量,操作步骤如下:
可以用于测定粗硒中硒的含量,操作步骤如下:
Ⅰ.用浓 将样品中的
将样品中的 氧化为
氧化为 ;
;
Ⅱ.用 溶液还原
溶液还原 为
为 ,同时生成
,同时生成 ;
;
Ⅲ.以淀粉为指示剂,用 标准溶液滴定Ⅱ中生成的
标准溶液滴定Ⅱ中生成的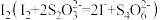 。
。
实验中准确称量 粗硒样品,滴定中消耗
粗硒样品,滴定中消耗 的
的 标准溶液
标准溶液 。
。
①滴定终点的现象为________ 。
②粗硒样品中硒的质量分数为________ 。
 )和硒酸(
)和硒酸(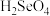 ),进而制备单质硒。
),进而制备单质硒。(1)基态硒原子核外电子的空间运动状态有
(2)甲硒醇(
 )的熔沸点低于甲醇(
)的熔沸点低于甲醇( ),原因是
),原因是(3)
 亚硒酸溶液中含硒微粒的分布系数
亚硒酸溶液中含硒微粒的分布系数 与溶液
与溶液 的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
①曲线
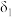 表示的含硒微粒是
表示的含硒微粒是②
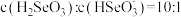 ,溶液
,溶液
③向溶液中滴入氨水,
 由5.5增大到7.3的过程中,主要反应的离子方程式为
由5.5增大到7.3的过程中,主要反应的离子方程式为 时,溶液中
时,溶液中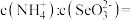
④在
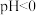 的酸性环境下,向溶液中通入
的酸性环境下,向溶液中通入 制得单质
制得单质 的离子方程式为
的离子方程式为(4)
 可以用于测定粗硒中硒的含量,操作步骤如下:
可以用于测定粗硒中硒的含量,操作步骤如下:Ⅰ.用浓
 将样品中的
将样品中的 氧化为
氧化为 ;
; Ⅱ.用
 溶液还原
溶液还原 为
为 ,同时生成
,同时生成 ;
;Ⅲ.以淀粉为指示剂,用
 标准溶液滴定Ⅱ中生成的
标准溶液滴定Ⅱ中生成的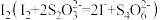 。
。实验中准确称量
 粗硒样品,滴定中消耗
粗硒样品,滴定中消耗 的
的 标准溶液
标准溶液 。
。①滴定终点的现象为
②粗硒样品中硒的质量分数为
您最近一年使用:0次
名校
4 . Ⅰ.近年来运用有机合成的方法制备出了许多具有下图所示立体结构的环状化合物,如图:_______ 。
(2)Ⅰ、Ⅱ、Ⅲ之间的关系是______。
(3)物质Ⅰ、Ⅱ中含有的官能团的名称是_______ 。
Ⅱ.三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(4)分子中原子个数比
______ 。
(5)三聚氰胺的分子式为________ 。
(6)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳、氮两种元素组成的六元杂环。则三聚氰胺的结构简式为________ 。
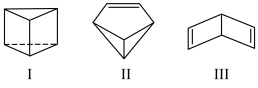
(2)Ⅰ、Ⅱ、Ⅲ之间的关系是______。
| A.同素异形体 | B.同系物 | C.同分异构体 | D.同种物质 |
(3)物质Ⅰ、Ⅱ中含有的官能团的名称是
Ⅱ.三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(4)分子中原子个数比

(5)三聚氰胺的分子式为
(6)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳、氮两种元素组成的六元杂环。则三聚氰胺的结构简式为
您最近一年使用:0次
名校
5 . 汽车尾气中含有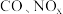 等有害气体。
等有害气体。
(1) 能形成酸雨,写出
能形成酸雨,写出 转化为
转化为 的化学方程式:
的化学方程式:______ .
(2)汽车尾气中 生成过程的能量变化示意图如下:
生成过程的能量变化示意图如下:____________ .
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示: 电极上发生的是
电极上发生的是______ 反应(填“氧化”或“还原”)。
②外电路中,电子的流动方向是从______ 电极流出(填 或Pt);Pt电极上的电极反应式为
或Pt);Pt电极上的电极反应式为______ .
(4)一种新型催化剂能使 和
和 发生反应:
发生反应: 。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
①请将表中数据补充完整:A______ ;B______ .
②能验证温度对化学反应速率影响规律的实验是______ (填实验编号)。
③实验Ⅰ和实验Ⅱ中,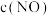 随时间
随时间 的变化曲线如图所示,其中表示实验Ⅱ的曲线是
的变化曲线如图所示,其中表示实验Ⅱ的曲线是______ (填“甲”或“乙”)。 。一定温度下,在容积不变的密闭容器中,下列可以说明该反应达到平衡状态的是
。一定温度下,在容积不变的密闭容器中,下列可以说明该反应达到平衡状态的是______ 。(从A-D项中选择)
A.容器内 的质量分数不再变化。
的质量分数不再变化。
B.相同时间内,消耗 同时生成
同时生成
C.容器内压强不再变化
D.容器内气体的平均密度不再发生变化
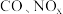 等有害气体。
等有害气体。(1)
 能形成酸雨,写出
能形成酸雨,写出 转化为
转化为 的化学方程式:
的化学方程式:(2)汽车尾气中
 生成过程的能量变化示意图如下:
生成过程的能量变化示意图如下:
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:

 电极上发生的是
电极上发生的是②外电路中,电子的流动方向是从
 或Pt);Pt电极上的电极反应式为
或Pt);Pt电极上的电极反应式为(4)一种新型催化剂能使
 和
和 发生反应:
发生反应: 。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。| 实验编号 | 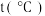 |  初始浓度 初始浓度 |  初始浓度 初始浓度 | 催化剂的比表面积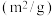 |
| Ⅰ | 280 | 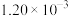 |  | 82 |
| Ⅱ | 280 | 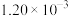 |  | 124 |
| Ⅲ | 350 |  |  | 82 |
②能验证温度对化学反应速率影响规律的实验是
③实验Ⅰ和实验Ⅱ中,
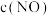 随时间
随时间 的变化曲线如图所示,其中表示实验Ⅱ的曲线是
的变化曲线如图所示,其中表示实验Ⅱ的曲线是
 。一定温度下,在容积不变的密闭容器中,下列可以说明该反应达到平衡状态的是
。一定温度下,在容积不变的密闭容器中,下列可以说明该反应达到平衡状态的是A.容器内
 的质量分数不再变化。
的质量分数不再变化。B.相同时间内,消耗
 同时生成
同时生成
C.容器内压强不再变化
D.容器内气体的平均密度不再发生变化
您最近一年使用:0次
名校
解题方法
6 . 以废铁屑(含少量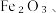 FeS等杂质)为原料,制备硫酸亚铁晶体
FeS等杂质)为原料,制备硫酸亚铁晶体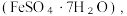 流程示意图如下:
流程示意图如下: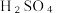 的作用是
的作用是
_________ (用离子方程式表示)。过程中产生的有毒气体,可用___________ 溶液吸收。
(2)酸浸时间对所得溶液的成分影响如下表所示。
用文字说明导致上述颜色变化的可能原因。___________
(3)已知: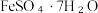 受热易失水,则操作X为:蒸发浓缩、
受热易失水,则操作X为:蒸发浓缩、________ 、过滤、洗涤。FeSO4强热后继续分解,推测产物为___________ 、Fe2O3和SO3。
测定所得硫酸亚铁晶体中的含量,步骤如下:
Ⅰ.称取ag硫酸亚铁晶体样品,配制成100mL溶液。
Ⅱ.取出10mL溶液,加入适量稀硫酸,滴入 的
的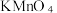 溶液,至反应完全,共消耗
溶液,至反应完全,共消耗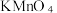 溶液cmL。(反应原理:
溶液cmL。(反应原理:
(4)计算硫酸亚铁晶体样品中 质量分数
质量分数___________ 。
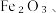 FeS等杂质)为原料,制备硫酸亚铁晶体
FeS等杂质)为原料,制备硫酸亚铁晶体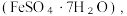 流程示意图如下:
流程示意图如下:
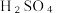 的作用是
的作用是
(2)酸浸时间对所得溶液的成分影响如下表所示。
| 酸浸时间 | 1min | 30min | 120min |
| 用KSCN溶液检验 | 变红 | 未变红 | 变红 |
(3)已知:
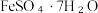 受热易失水,则操作X为:蒸发浓缩、
受热易失水,则操作X为:蒸发浓缩、测定所得硫酸亚铁晶体中的含量,步骤如下:
Ⅰ.称取ag硫酸亚铁晶体样品,配制成100mL溶液。
Ⅱ.取出10mL溶液,加入适量稀硫酸,滴入
 的
的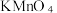 溶液,至反应完全,共消耗
溶液,至反应完全,共消耗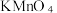 溶液cmL。(反应原理:
溶液cmL。(反应原理:
(4)计算硫酸亚铁晶体样品中
 质量分数
质量分数
您最近一年使用:0次
名校
解题方法
7 . 回答下列问题
(1)请根据官能团的不同对下列有机物进行分类:
①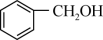 ;②
;②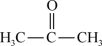 ;③
;③ ;④
;④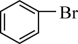 ;⑤H3C-CHO;⑥ CH3COOH;⑦
;⑤H3C-CHO;⑥ CH3COOH;⑦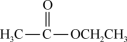
Ⅰ.酚:___________ (填序号) ; 醛:___________ (填序号)。
Ⅱ.⑥的官能团名称为___________ ,⑦的官能团名称为___________ 。
(2)与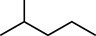 表示的有机物互为同分异构体且一氯代物有两种的烃的结构简式为
表示的有机物互为同分异构体且一氯代物有两种的烃的结构简式为___________ 。
(3)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为: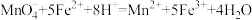 (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗酸性KMnO4标准溶液的体积20.00mL
①此滴定实验达到终点的颜色变化为___________ 。
②若滴定前平视读数,滴定终点时仰视读数,则所测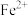 含量:
含量:___________ 。(填“无影响”、“偏高”或“偏低”)。
③上述样品中FeSO4·7H2O的质量分数为___________ 。(FeSO4·7H2O,M=278 g/mol,小数点后保留一位)
(1)请根据官能团的不同对下列有机物进行分类:
①
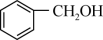 ;②
;②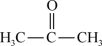 ;③
;③ ;④
;④ ;⑤H3C-CHO;⑥ CH3COOH;⑦
;⑤H3C-CHO;⑥ CH3COOH;⑦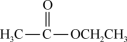
Ⅰ.酚:
Ⅱ.⑥的官能团名称为
(2)与
 表示的有机物互为同分异构体且一氯代物有两种的烃的结构简式为
表示的有机物互为同分异构体且一氯代物有两种的烃的结构简式为(3)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为:
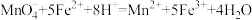 (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗酸性KMnO4标准溶液的体积20.00mL
①此滴定实验达到终点的颜色变化为
②若滴定前平视读数,滴定终点时仰视读数,则所测
 含量:
含量:③上述样品中FeSO4·7H2O的质量分数为
您最近一年使用:0次
2024高三下·全国·专题练习
8 . 三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3}是重要的化工原料。制备反应式为:2CoCl2·6H2O+10NH3+2NH4Cl+H2O2 2[Co(NH3)6]Cl3+14H2O,反应放出大量热。已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。②[Co(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[Co(NH3)6]Cl3的实验步骤:
2[Co(NH3)6]Cl3+14H2O,反应放出大量热。已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。②[Co(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[Co(NH3)6]Cl3的实验步骤:
Ⅲ.在静置的同时,需对静置液进行“操作A”后过滤;用无水乙醇洗涤晶体2~3次。
(1)步骤Ⅲ中的“操作A”是_______ 。
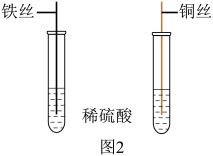
(2)用如图3装置测定产品中NH3的含量(部分装置已省略):
液封装置1的作用是_______ 。
液封装置2的作用是_______ 。
②滴定:将液封装置2中的水倒入锥形瓶后滴定剩余的H2SO4,消耗c2mol·L-1的NaOH标准溶液V2mL。若未将液封装置2中的水倒入锥形瓶,测得NH3的质量分数将_______ (填“偏高”或“偏低”或“不变”)。
 2[Co(NH3)6]Cl3+14H2O,反应放出大量热。已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。②[Co(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[Co(NH3)6]Cl3的实验步骤:
2[Co(NH3)6]Cl3+14H2O,反应放出大量热。已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。②[Co(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[Co(NH3)6]Cl3的实验步骤: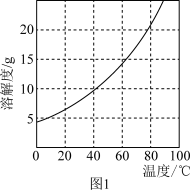

Ⅲ.在静置的同时,需对静置液进行“操作A”后过滤;用无水乙醇洗涤晶体2~3次。
(1)步骤Ⅲ中的“操作A”是
(2)用如图3装置测定产品中NH3的含量(部分装置已省略):
液封装置1的作用是
液封装置2的作用是
②滴定:将液封装置2中的水倒入锥形瓶后滴定剩余的H2SO4,消耗c2mol·L-1的NaOH标准溶液V2mL。若未将液封装置2中的水倒入锥形瓶,测得NH3的质量分数将
您最近一年使用:0次
2024高三下·全国·专题练习
9 . 制备的泄盐样品中MgSO4·7H2O的含量可用EDTA二钠盐(用Na2H2Y表示)进行测定,实验测定方法如下:
则制得的泄盐样品中MgSO4·7H2O的质量分数为___________ 。
| 实验测定方法 | 涉及的反应 |
| ①在1.5 g样品中加入足量的EDTA二钠盐溶液,配成pH=9~10的100.00 mL甲溶液 | Mg2++H2Y2-=MgH2Y |
| ②取25.00 mL甲溶液于锥形瓶中,用含0.100 mol·L-1 Zn2+的标准液进行滴定,消耗20.00 mL含Zn2+标准液 | Zn2++H2Y2-=ZnH2Y |
| ③再取25.00 mL甲溶液于另一锥形瓶中,调节pH为5~6,用含0.100 mol·L-1 Zn2+的标准液进行滴定,消耗35.00 mL含Zn2+标准液 | Zn2++MgH2Y=Mg2++ZnH2Y、Zn2++H2Y2-=ZnH2Y |
您最近一年使用:0次
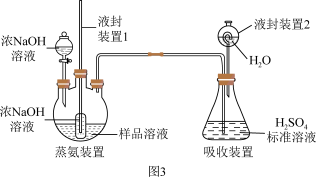
10 . 金属的用途与性质密切相关。
(1)图1所示赤铁矿的主要成分是___________ (填化学式)。___________ 。
(3)在空气中,铝具有很好的抗腐蚀性,其原因用化学方程式表示为___________ 。
(4)为探究铁、铜的金属活动性,分别将铁丝、铜丝插入稀硫酸中(图2所示),说明铁比铜的金属活动性更强的实验现象是___________ ,反应的化学方程式是___________ 。___________ (填化学式,下同),滤液中溶质的组成可能是___________ 或___________ 。
(1)图1所示赤铁矿的主要成分是

| 铜 | 铝 | |
| 密度/(g•cm﹣3) | 8.92 | 2.70 |
| 地壳中含量(质量分数/%) | 0.007 | 7.73 |
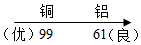
| 导电性(以银的导电性为100做标准) |
| |
(3)在空气中,铝具有很好的抗腐蚀性,其原因用化学方程式表示为
(4)为探究铁、铜的金属活动性,分别将铁丝、铜丝插入稀硫酸中(图2所示),说明铁比铜的金属活动性更强的实验现象是
您最近一年使用:0次