解题方法
1 . 工业上常以铝土矿为原料来冶炼金属铝。已知:铝土矿的主要成分是 (其中含有
(其中含有 、
、 等杂质)。为检测某铝土矿样品中
等杂质)。为检测某铝土矿样品中 的含量,进行如下实验过程:
的含量,进行如下实验过程:
①取矿样10.0g加入过量稀盐酸溶解,过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.0mL逐滴加入 的NaOH溶液。得到如右图所示的变化关系。
的NaOH溶液。得到如右图所示的变化关系。___________ 。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为___________ ,其物质的量为___________ 。
(3)该铝土矿样中 的质量分数为
的质量分数为___________ 。
 (其中含有
(其中含有 、
、 等杂质)。为检测某铝土矿样品中
等杂质)。为检测某铝土矿样品中 的含量,进行如下实验过程:
的含量,进行如下实验过程:①取矿样10.0g加入过量稀盐酸溶解,过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.0mL逐滴加入
 的NaOH溶液。得到如右图所示的变化关系。
的NaOH溶液。得到如右图所示的变化关系。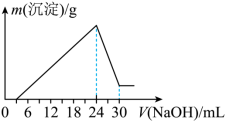
(2)最后所得不溶于NaOH溶液的沉淀的化学式为
(3)该铝土矿样中
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
2 . SO2在生产生活中有重要的应用,处理不当会造成环境污染。回答下列问题:
(1)标准状况下16.0gSO2的体积为______ L,与______ molH2O中所含氧原子数相等。
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。
①该反应中被还原的元素是_____ 。
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为______ 。
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为______ g•m-3(用含a的表达式表示,假定样品中其它气体均不参与反应,SO2可被溶液充分吸收)。
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_____ ;需用量筒量取密度为1.84g•cm-3,质量分数为98%的浓硫酸_____ mL;若定容时俯视刻度线,则所配溶液的浓度______ (填“偏高”、“偏低”或“不变”)。
(1)标准状况下16.0gSO2的体积为
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO
 +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。①该反应中被还原的元素是
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2.样品中CuSO4·5H2O的质量分数为_______ (列出算式可能用到的化学式量:CuSO4 160、CuSO4·5H2O 250、Cu(NO3)2·3H2O 242、BaSO4 233)。
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
4 . 完成下列问题
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值_______ (列出计算过程)。
(2)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+,写出计算CuSO4·5H2O质量分数的表达式ω=_______ 。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值
(2)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+,写出计算CuSO4·5H2O质量分数的表达式ω=
您最近一年使用:0次
2022高三·全国·专题练习
5 . 测定晶体中KSCN的含量:称取10.0g样品,配成1000mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴 溶液作指示剂,用
溶液作指示剂,用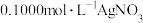 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 ,标准溶液20.00mL。
,标准溶液20.00mL。
(1)滴定时发生的反应: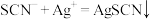 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是___________ 。
(2)晶体中KSCN的质量分数为___________ (计算结果精确至0.1%)。
 溶液作指示剂,用
溶液作指示剂,用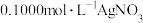 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 ,标准溶液20.00mL。
,标准溶液20.00mL。(1)滴定时发生的反应:
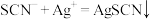 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是(2)晶体中KSCN的质量分数为
您最近一年使用:0次
2022高三·全国·专题练习
6 . 为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验。利用高氯酸(高沸点酸)将mg样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再进行酸碱滴定来测定含量。实验装置如图所示。
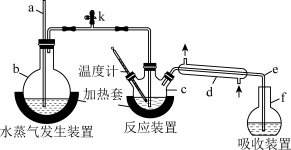
定量测定:将f中得到的馏出液配成 溶液,取其中
溶液,取其中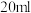 加入
加入
 溶液,得到
溶液,得到 沉淀(不考虑其他沉淀的生成),再用
沉淀(不考虑其他沉淀的生成),再用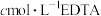 标准溶液滴定剩余
标准溶液滴定剩余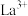 (
( 与
与 按
按 配合),消耗
配合),消耗 标准溶液
标准溶液 ,则氟化稀土样品中氟的质量分数为
,则氟化稀土样品中氟的质量分数为___ 。

定量测定:将f中得到的馏出液配成
 溶液,取其中
溶液,取其中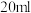 加入
加入
 溶液,得到
溶液,得到 沉淀(不考虑其他沉淀的生成),再用
沉淀(不考虑其他沉淀的生成),再用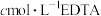 标准溶液滴定剩余
标准溶液滴定剩余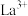 (
( 与
与 按
按 配合),消耗
配合),消耗 标准溶液
标准溶液 ,则氟化稀土样品中氟的质量分数为
,则氟化稀土样品中氟的质量分数为
您最近一年使用:0次
2021高三·全国·专题练习
7 . 测定三草酸合铁酸钾中铁的含量。
(1)称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L—1KMnO4溶液滴定至终点。滴定终点的现象是___________ 。
(2)向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为___________ 。
(1)称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L—1KMnO4溶液滴定至终点。滴定终点的现象是
(2)向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为
您最近一年使用:0次
名校
8 . 粗ZnS中S含量测定可采用“碘量法”测得。称取0.210g样品置于碘量瓶中,移取25.00mL0.1000mol/L的I2溶液于其中,并加入乙酸溶液,密闭,置于暗处反应10min,有单质S析出。以淀粉为指示剂,过量的I2用0.1000mol/L的Na2S2O3溶液滴定至终点。重复实验,数据如下:
已知:I2+2 =2I-+
=2I-+ ,假设杂质不参加反应。
,假设杂质不参加反应。
计算该样品中S元素的质量分数是____ %(保留小数点后一位);写出简要的计算过程。
| 序号 | 滴定前读数/mL | 滴定终点读数/mL |
| 1 | 0.28 | 10.30 |
| 2 | 0.08 | 11.26 |
| 3 | 1.34 | 11.32 |
已知:I2+2
 =2I-+
=2I-+ ,假设杂质不参加反应。
,假设杂质不参加反应。计算该样品中S元素的质量分数是
您最近一年使用:0次
名校
9 . 市售铁强化盐中铁含量测定。
已知:①铁强化盐中含有NaCl、KIO3、NaFeY,其中n(KIO3):n(NaFeY)=1:50,
②I2+2S2O =2I-+S4O
=2I-+S4O
称取m g样品,加稀硫酸溶解后配成100 mL溶液。取出10 mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用c mol/L Na2S2O3标准溶液滴定,重复操作2~3次,消耗Na2S2O3标准溶液平均值为V mL。
(1)I-除了与Fe3+反应外,还可发生的反应的离子方程式为___________ 。
(2)样品中铁元素的质量分数为___________ (列出式子即可)。
已知:①铁强化盐中含有NaCl、KIO3、NaFeY,其中n(KIO3):n(NaFeY)=1:50,
②I2+2S2O
 =2I-+S4O
=2I-+S4O
称取m g样品,加稀硫酸溶解后配成100 mL溶液。取出10 mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用c mol/L Na2S2O3标准溶液滴定,重复操作2~3次,消耗Na2S2O3标准溶液平均值为V mL。
(1)I-除了与Fe3+反应外,还可发生的反应的离子方程式为
(2)样品中铁元素的质量分数为
您最近一年使用:0次
10 . 为了测定镁铝合金中各成分金属的含量,可采取以下两种方法:
(1)将8g镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣4.4g,则合金样品中铝的质量分数为_______ 。
(2)在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
则盐酸的物质的量浓度为____ (保留三位有效数字),合金中镁铝的物质的量之比____ 。
(1)将8g镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣4.4g,则合金样品中铝的质量分数为
(2)在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 2.55 | 3.85 | 4.59 |
| 生成气体体积/L | 2.80 | 3.36 | 3.36 |
则盐酸的物质的量浓度为
您最近一年使用:0次



