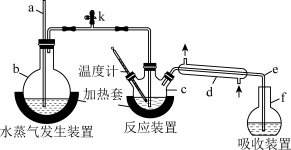
为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验。利用高氯酸(高沸点酸)将mg样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再进行酸碱滴定来测定含量。实验装置如图所示。
定量测定:将f中得到的馏出液配成 溶液,取其中
溶液,取其中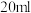 加入
加入
 溶液,得到
溶液,得到 沉淀(不考虑其他沉淀的生成),再用
沉淀(不考虑其他沉淀的生成),再用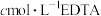 标准溶液滴定剩余
标准溶液滴定剩余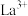 (
( 与
与 按
按 配合),消耗
配合),消耗 标准溶液
标准溶液 ,则氟化稀土样品中氟的质量分数为
,则氟化稀土样品中氟的质量分数为___ 。

定量测定:将f中得到的馏出液配成
 溶液,取其中
溶液,取其中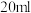 加入
加入
 溶液,得到
溶液,得到 沉淀(不考虑其他沉淀的生成),再用
沉淀(不考虑其他沉淀的生成),再用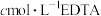 标准溶液滴定剩余
标准溶液滴定剩余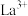 (
( 与
与 按
按 配合),消耗
配合),消耗 标准溶液
标准溶液 ,则氟化稀土样品中氟的质量分数为
,则氟化稀土样品中氟的质量分数为
2022高三·全国·专题练习 查看更多[1]
(已下线)专题18 无机实验计算-2022年高考化学二轮复习重点专题常考点突破练
更新时间:2022-03-12 09:44:13
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:①软锰矿与过量KOH、KClO3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转化为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得到深紫色的KMnO4产品。
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒机理与下列物质相似的是_________(填序号)
(2)溶液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是__________ ;
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250mL0.1mol•L-1标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量为_________ g;
②取上述制得的KMnO4产品0.6000g,酸化后用0.1mol•L-1标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液20.00ML。计算该KMnO4产品的纯度_________ (请给出计算过程)。(有关离子方程式为:MnO +S2O
+S2O +H+---SO
+H+---SO +Mn2++H2O 未配平)
+Mn2++H2O 未配平)
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒机理与下列物质相似的是_________(填序号)
| A.75%酒精 | B.双氧水 | C.苯酚 | D.84消毒液(NaClO溶液) |
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250mL0.1mol•L-1标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量为
②取上述制得的KMnO4产品0.6000g,酸化后用0.1mol•L-1标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液20.00ML。计算该KMnO4产品的纯度
 +S2O
+S2O +H+---SO
+H+---SO +Mn2++H2O 未配平)
+Mn2++H2O 未配平)
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】磷精矿湿法制备磷酸的一种工艺流程:

取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L-1 NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL。精制磷酸中H3PO4的质量分数是________ 。(已知:H3PO4摩尔质量为98 g·mol-1)

取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L-1 NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL。精制磷酸中H3PO4的质量分数是
您最近一年使用:0次
【推荐1】将2.24L(标准状况)的氯气通入30.00mL密度为1.33g/cm3的10.000 mol/L氢氧化钠热溶液中,生成NaCl 、NaClO 、NaClO3和H2O,其中NaCl为 0.16 mol。
(1)标准状况下, 2.24L氯气的物质的量为________ mol。
(2)氢氧化钠溶液的质量分数为______ %(保留两位小数)。
(3)反应所得溶液中NaClO 和NaClO3的物质的量共为________ mol。
(4)含氯消毒剂杀菌后氯元素均以-1价态存在。试通过计算回答,上述反应所得溶液的杀菌能力相当于多少mL0.1000mol/L次氯酸钙溶液的的杀菌能力______ ?
(1)标准状况下, 2.24L氯气的物质的量为
(2)氢氧化钠溶液的质量分数为
(3)反应所得溶液中NaClO 和NaClO3的物质的量共为
(4)含氯消毒剂杀菌后氯元素均以-1价态存在。试通过计算回答,上述反应所得溶液的杀菌能力相当于多少mL0.1000mol/L次氯酸钙溶液的的杀菌能力
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】将Mg、Cu组成的1.32g混合物投入适量稀硝酸中恰好反应,固体完全溶解时收集到的还原产物NO气体0.02mol,向反应后的溶液中加入2 mol/L的NaOH溶液30 mL时金属离子恰好沉淀完全.则形成沉淀的质量为 。
您最近一年使用:0次

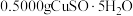 样品,加适量水溶解,转移至碘量瓶中,加过量
样品,加适量水溶解,转移至碘量瓶中,加过量 溶液并用稀
溶液并用稀 酸化,以淀粉溶液为指示剂,用
酸化,以淀粉溶液为指示剂,用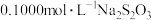 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 的溶液
的溶液 。测定过程中发生下列反应:
。测定过程中发生下列反应: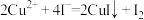 、
、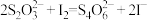 。计算
。计算 样品的纯度(写出计算过程):
样品的纯度(写出计算过程):

