2022高三·全国·专题练习
1 . 碳酸钠产品中 含量测定:
含量测定:
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸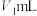 ;
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸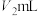 ;
;
④平行测定三次,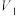 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
开始分解。
(ii)相关盐在不同温度下的溶解度表(g/100gH2O)
(1)产品中 的质量分数为
的质量分数为___________ (保留三位有效数字);
(2)第一滴定终点时,某同学俯视读数,其他操作均正确,则 质量分数的计算结果
质量分数的计算结果___________ (填“偏大”“偏小”或“无影响”)。
 含量测定:
含量测定:①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用
 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸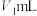 ;
;③在上述锥形瓶中再加入2滴指示剂N,继续用
 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸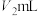 ;
;④平行测定三次,
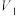 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。已知:(i)当温度超过35℃时,
 开始分解。
开始分解。(ii)相关盐在不同温度下的溶解度表(g/100gH2O)
温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
 | 11.9 | 15.8 | 21.0 | 27.0 | |||
 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
 的质量分数为
的质量分数为(2)第一滴定终点时,某同学俯视读数,其他操作均正确,则
 质量分数的计算结果
质量分数的计算结果
您最近一年使用:0次
2022高三·全国·专题练习
2 . 设计如下实验测定NaCl产品中SO 的含量,填写下列表格。
的含量,填写下列表格。
 的含量,填写下列表格。
的含量,填写下列表格。| 操作 | 现象 | 目的/结论 | |
| ① | 称取样品m1g,加水溶解,加盐酸调至弱酸性,滴加过量c1mol·L-1BaCl2溶液V1mL | 稍显浑浊 | 目的: |
| ② | 继续滴加过量c2mol·L-1K2CrO4溶液V2mL | 产生黄色沉淀 | 目的:沉淀过量的Ba2+。 |
| ③ | 过滤洗涤,滴加少许指示剂于滤液中,用c3mol·L-1FeSO4溶液滴定至终点,消耗FeSO4溶液V3mL | 结论:SO 的质量分数为 的质量分数为 |
您最近一年使用:0次
名校
3 . A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸。A、B相对分子质量都不超过200,完全燃烧都只生成CO2和H2O,且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652)。A溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B相对分子质量之差为___________ 。
(2)1个B分子中应该有___________ 个氧原子。
(3)A的分子式是___________ 。
(4) B可能有的三种结构简式是___________ 、___________ 、___________ 。
(1)A、B相对分子质量之差为
(2)1个B分子中应该有
(3)A的分子式是
(4) B可能有的三种结构简式是
您最近一年使用:0次
2021-06-18更新
|
517次组卷
|
2卷引用:甘肃省天水市一中2020-2021学年高二下学期第二阶段(期中)考试化学试题
4 . 天然气在生活、生产中应用越来越广泛,如成为居民日常燃料,成为工业合成氨原料等。由天然气制取合成氨原料其主要反应为:
CH4(g)+H2O(g)→CO(g)+3H2(g) ①
2CH4(g)+O2(g)→2CO(g)+4H2(g) ②
CO(g)+H2O(g)→CO2(g)+H2(g) ③
(1)1m3(标准状况)CH4按②式完全反应,产生H2_______ mol。(保留一位小数)
(2)一定量的CH4、空气、水蒸气反应后得到某混合气体,各成分的质量分数分别是为O2 32%,N2 28%,CO2 22%,CH4 16%,H2 2%,此混合气体对氢气的相对密度是______________ (保留一位小数)
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应后,得到的气体组成如下表:
列式计算该富氧空气中O2和N2的体积比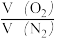 =
=____________ 。反应中的CH4、H2O(g)和富氧空气的体积比=___________ 。
(4)某课外活动小组探究CH4和纯氧的反应,取CH4和纯氧组成的混合气体a mol通入装有9.36g Na2O2固体的密闭容器中,用电火花不断引燃,使之高温下充分反应,恢复至常温时,容器内压强几乎为零。剩余固体成分与a的取值及CH4与O2的体积比值n之间有很多种情况,试帮助该小组同学填写如下几种情况。
CH4(g)+H2O(g)→CO(g)+3H2(g) ①
2CH4(g)+O2(g)→2CO(g)+4H2(g) ②
CO(g)+H2O(g)→CO2(g)+H2(g) ③
(1)1m3(标准状况)CH4按②式完全反应,产生H2
(2)一定量的CH4、空气、水蒸气反应后得到某混合气体,各成分的质量分数分别是为O2 32%,N2 28%,CO2 22%,CH4 16%,H2 2%,此混合气体对氢气的相对密度是
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应后,得到的气体组成如下表:
| 气体 | CO | H2 | N2 | O2 | CO2 |
| 体积(L) | 15 | 70 | 20 | 4.5 | 10 |
列式计算该富氧空气中O2和N2的体积比
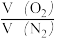 =
=(4)某课外活动小组探究CH4和纯氧的反应,取CH4和纯氧组成的混合气体a mol通入装有9.36g Na2O2固体的密闭容器中,用电火花不断引燃,使之高温下充分反应,恢复至常温时,容器内压强几乎为零。剩余固体成分与a的取值及CH4与O2的体积比值n之间有很多种情况,试帮助该小组同学填写如下几种情况。
| a取值 | n=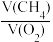 | 剩余固体 |
| Na2CO3,NaOH,Na2O2 | ||
| Na2CO3,NaOH | ||
| Na2CO3,NaOH | ||
| Na2CO3 |
您最近一年使用:0次
5 . 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________ 。
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
| 18K金成分 | Au | Ag |
| 含量(质量分数) | 75.00% |
您最近一年使用:0次
2019-12-15更新
|
497次组卷
|
2卷引用:江西省山江湖协作体2019-2020学年高一上学期第三次月考(自招班)化学试题
名校
6 . 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)新型材料Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。将22.4 g Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为28.8 g。
①产生的氢气的体积为_________ mL(标准状况下)。
②将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量__________ mol。
(2)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。
Nierite的化学式为___________ 。
(3)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
(1)新型材料Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。将22.4 g Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为28.8 g。
①产生的氢气的体积为
②将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量
(2)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。
Nierite的化学式为
(3)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
| 18K金成分 | Au | Ag |
| 含量(质量分数) | 75.00% |
您最近一年使用:0次
名校
7 . 肼是一种强还原剂,用NaClO与NH3反应可用于生产肼(N2H4),其反应的化学方程式为:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生产1000 g质量分数为25.6%的肼溶液最少需要___________ L(标准状况)NH3。
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原( 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00 mL。
被还原为Cr3+),消耗该溶液20.00 mL。
①用H2O2与次氯酸钠反应的离子方程式为___________ 。
②实验中加热煮沸的目的是___________ 。
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。___________
⑴生产1000 g质量分数为25.6%的肼溶液最少需要
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(
 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00 mL。
被还原为Cr3+),消耗该溶液20.00 mL。①用H2O2与次氯酸钠反应的离子方程式为
②实验中加热煮沸的目的是
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。
您最近一年使用:0次
2017-04-16更新
|
634次组卷
|
4卷引用:2017届江苏省南通市高三第一次模拟考试化学试卷
2010·上海徐汇·一模
8 . 粉煤灰是燃煤电厂排出的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为43.4%,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
Al6Si2O13 + 3Na2CO3→ 2NaAlSiO4+ 4NaAlO2+ 3CO2↑ ①
Al6Si2O13 + 5Na2CO3→ 2Na2SiO3 + 6NaAlO2+ 5CO2↑ ②
SiO2+ Na2CO3→ Na2SiO3+ CO2↑ ③
(1)粉煤灰中铝的质量分数为________ % 。
(2)用1 mol Al6Si2O13 和 4 mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3____________ mol,共消耗Na2CO3________ mol(得到的固体中无SiO2)。
(3)若粉煤灰中 Al6Si2O13 与 SiO2的物质的量之比为1:2,则1kg粉煤灰与6mol Na2CO3反应(反应物全部都参与反应),可制得NaAlO2_________________ mol。
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2) =x,消耗Na2CO3 ymol,试确定y与x的关系式________________ 。
Al6Si2O13 + 3Na2CO3→ 2NaAlSiO4+ 4NaAlO2+ 3CO2↑ ①
Al6Si2O13 + 5Na2CO3→ 2Na2SiO3 + 6NaAlO2+ 5CO2↑ ②
SiO2+ Na2CO3→ Na2SiO3+ CO2↑ ③
(1)粉煤灰中铝的质量分数为
(2)用1 mol Al6Si2O13 和 4 mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3
(3)若粉煤灰中 Al6Si2O13 与 SiO2的物质的量之比为1:2,则1kg粉煤灰与6mol Na2CO3反应(反应物全部都参与反应),可制得NaAlO2
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2) =x,消耗Na2CO3 ymol,试确定y与x的关系式
您最近一年使用:0次
名校
9 . 硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
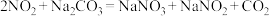 ①
①
 ②
②
(1)根据反应②,每产生22.4L(标准状况下) ,吸收液质量将增加
,吸收液质量将增加______________ g。
(2)NO和 的混合气体的组成可表示为NOx,该混合气体通入纯碱溶液完全吸收时,x值可能为
的混合气体的组成可表示为NOx,该混合气体通入纯碱溶液完全吸收时,x值可能为_______ (选填编号)
a.1.2 b.1.5 c.1.6 d.2.1
(3)在标准状况下,将含a L 和b L NO混合气体通入625g质量分数为21.2%的纯碱溶液中,恰好完全被吸收,且吸收液质量增加44g。
和b L NO混合气体通入625g质量分数为21.2%的纯碱溶液中,恰好完全被吸收,且吸收液质量增加44g。
计算:
i.a=______________ L,b=______________ L。
ii.反应②中生成 的质量为
的质量为______________ g。
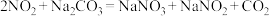 ①
① ②
②(1)根据反应②,每产生22.4L(标准状况下)
 ,吸收液质量将增加
,吸收液质量将增加(2)NO和
 的混合气体的组成可表示为NOx,该混合气体通入纯碱溶液完全吸收时,x值可能为
的混合气体的组成可表示为NOx,该混合气体通入纯碱溶液完全吸收时,x值可能为a.1.2 b.1.5 c.1.6 d.2.1
(3)在标准状况下,将含a L
 和b L NO混合气体通入625g质量分数为21.2%的纯碱溶液中,恰好完全被吸收,且吸收液质量增加44g。
和b L NO混合气体通入625g质量分数为21.2%的纯碱溶液中,恰好完全被吸收,且吸收液质量增加44g。计算:
i.a=
ii.反应②中生成
 的质量为
的质量为
您最近一年使用:0次
10 . H2O2作为绿色氧化剂应用广泛,氢醌法制备H2O2原理如下:

取2.50g产品,加蒸馏水定容至100mL摇匀。取20.00mL于锥形瓶中,用0.0500mol·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98mL、20.90mL、20.02mL。假设其他杂质不干扰结果,产品中H2O2质量分数为_______ 。

取2.50g产品,加蒸馏水定容至100mL摇匀。取20.00mL于锥形瓶中,用0.0500mol·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98mL、20.90mL、20.02mL。假设其他杂质不干扰结果,产品中H2O2质量分数为
您最近一年使用:0次



