2013·上海·零模
1 . 实验室利用铜屑、硝酸和硫酸的混酸为原料制备硫酸铜晶体。结合具体操作过程回答下列问题。
(1)配制混酸:将3 mol/L的硫酸(密度1.180g/cm3)与15mol/L的浓硝酸(密度1.400 g/cm3)按体积比5:1混合后冷却。
①计算混酸中硫酸的质量分数为__________ ;
②取1g混酸,用水稀释至20.00mL,用0.5mol/L烧碱进行滴定,消耗标准烧碱溶液的体积为__________ mL。
(2)灼烧废铜屑:称量一定质量表面含油污的纯铜屑(铜含量为99.84%),置于坩埚中灼烧,将油污充分氧化后除去,直至铜屑表面均呈黑色。冷却后称量,固体质量比灼烧前增加了3.2 %,
①固体中氧元素的质量分数为__________ (保留3位小数);
②固体中铜与氧化铜的物质的量之比为___________ 。
(3)溶解:称取2.064g固体,慢慢分批加入一定质量的混酸,恰好完全反应。列式计算产生NO气体体积在标准状况下的体积(设硝酸的还原产物只有NO)。______________
(4)结晶:将反应后的溶液水浴加热浓缩后冷却结晶,析出胆矾晶体。
①计算反应后溶液中CuSO4的物质的量是__________ ;
②若最终得到胆矾晶体质量为6.400g,胆矾的产率为_________ 。(精确到1%)
(1)配制混酸:将3 mol/L的硫酸(密度1.180g/cm3)与15mol/L的浓硝酸(密度1.400 g/cm3)按体积比5:1混合后冷却。
①计算混酸中硫酸的质量分数为
②取1g混酸,用水稀释至20.00mL,用0.5mol/L烧碱进行滴定,消耗标准烧碱溶液的体积为
(2)灼烧废铜屑:称量一定质量表面含油污的纯铜屑(铜含量为99.84%),置于坩埚中灼烧,将油污充分氧化后除去,直至铜屑表面均呈黑色。冷却后称量,固体质量比灼烧前增加了3.2 %,
①固体中氧元素的质量分数为
②固体中铜与氧化铜的物质的量之比为
(3)溶解:称取2.064g固体,慢慢分批加入一定质量的混酸,恰好完全反应。列式计算产生NO气体体积在标准状况下的体积(设硝酸的还原产物只有NO)。
(4)结晶:将反应后的溶液水浴加热浓缩后冷却结晶,析出胆矾晶体。
①计算反应后溶液中CuSO4的物质的量是
②若最终得到胆矾晶体质量为6.400g,胆矾的产率为
您最近一年使用:0次
解题方法
2 . 化学正在走向精准。当代化学的三大支柱是:理论、实验和计算。
Ⅰ.某溶液为硫酸和硝酸混合后的稀溶液,取200.00mL,该溶液加入过量锌粉充分反应。反应后溶液中只含有一种溶质,其浓度为 (溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。
(溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。______
Ⅱ.某硫铜矿的主要成分为 ,可用于冶炼金属铜,为测定矿石中
,可用于冶炼金属铜,为测定矿石中 的质量分数,进行如下实验(杂质不参加反应):
的质量分数,进行如下实验(杂质不参加反应):
步骤1:在1.00g试样中加入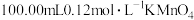 的酸性溶液,加热,硫元素全部转化为
的酸性溶液,加热,硫元素全部转化为 ,铜元素全部转化为
,铜元素全部转化为 ,滤去不溶性杂质。
,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用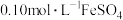 溶液与剩余
溶液与剩余 恰好反应,消耗10.00mL。列式计算
恰好反应,消耗10.00mL。列式计算 的质量分数
的质量分数______ 。
Ⅰ.某溶液为硫酸和硝酸混合后的稀溶液,取200.00mL,该溶液加入过量锌粉充分反应。反应后溶液中只含有一种溶质,其浓度为
 (溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。
(溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。Ⅱ.某硫铜矿的主要成分为
 ,可用于冶炼金属铜,为测定矿石中
,可用于冶炼金属铜,为测定矿石中 的质量分数,进行如下实验(杂质不参加反应):
的质量分数,进行如下实验(杂质不参加反应):步骤1:在1.00g试样中加入
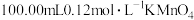 的酸性溶液,加热,硫元素全部转化为
的酸性溶液,加热,硫元素全部转化为 ,铜元素全部转化为
,铜元素全部转化为 ,滤去不溶性杂质。
,滤去不溶性杂质。步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用
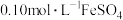 溶液与剩余
溶液与剩余 恰好反应,消耗10.00mL。列式计算
恰好反应,消耗10.00mL。列式计算 的质量分数
的质量分数
您最近一年使用:0次
3 . 某铅合金中含有Pb, Bi, Ni等元素,称取此合金试样2.420g,用HNO3溶解并定容至250mL。移取50.00 mL上述试液于250mL锥形瓶中,调节pH=1,以二甲酚橙为指示剂,用0.07500 mol·L-1 EDTA标准溶液滴定,消耗5.25mL。然后,用六次甲基四胺缓冲溶液将pH调至5,再以上述EDTA标准溶液滴定,消耗28.76 mL。加入邻二氨菲,置换出镍配合物中的EDTA, 用0.04500 mol ·L-1Pb(NO3)2标准溶液滴定置换出的EDTA,消耗8.76mL。计算此合金试样中Pb, Bi, Ni的质量分数________ 。(lgKBiY= 27.94, lgKPbY = 18.04, IgKNiY = 18.62)
您最近一年使用:0次
4 . 铝镁合金是飞机制造、化工生产等行业的重要材料。某研究性学习小组为测定某铝镁合金(不含其他元素)中铝的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白:
[方案一]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的离子方程式是___ 。
[实验步骤]
(2)称取8.1g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0mol·L-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥___ mL。
(3)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将___ (填“偏高”、“偏低”或“无影响”)。
[方案二]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(4)同学们拟选用下列实验装置完成实验:
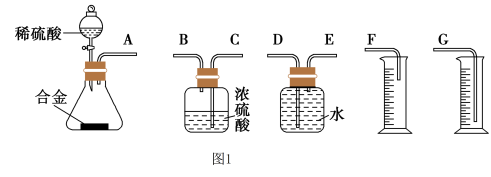
你认为最简易的装置其连接顺序是A接( ),( )接( ),( )接( )(填接口字母,注意:可不填满)___ 。
(5)仔细分析上述实验装置后,同学们认为会引起较大误差。于是他们设计了如图2所示的实验装置。与图2装置相比,用图1连接的装置进行实验时,若不考虑导管中液体体积的影响,测定铝镁合金中铝的质量分数将___ (填“偏大”、“偏小”或“无影响”).
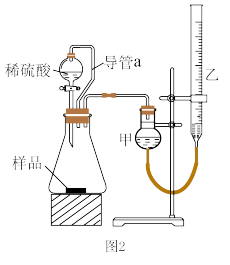
某同学提出该实验装置不够完善,应在甲和锥形瓶之间添加一个装有碱石灰的干燥装置。你的意见是___ (填“需要”或“不需要”)
(6)用图2装置进行实验时:为了较准确测量氢气的体积,在读反应前后量气管乙中液面的读数求其差值的过程中,应注意___(填字母编号)。
(7)图2装置进行实验,合金的质量为7.8g,测得氢气体积为8.96L(标准状况),则合金中铝的质量分数为___ (保留两位有效数字)。
[方案一]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的离子方程式是
[实验步骤]
(2)称取8.1g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0mol·L-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥
(3)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将
[方案二]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(4)同学们拟选用下列实验装置完成实验:

你认为最简易的装置其连接顺序是A接( ),( )接( ),( )接( )(填接口字母,注意:可不填满)
(5)仔细分析上述实验装置后,同学们认为会引起较大误差。于是他们设计了如图2所示的实验装置。与图2装置相比,用图1连接的装置进行实验时,若不考虑导管中液体体积的影响,测定铝镁合金中铝的质量分数将

某同学提出该实验装置不够完善,应在甲和锥形瓶之间添加一个装有碱石灰的干燥装置。你的意见是
(6)用图2装置进行实验时:为了较准确测量氢气的体积,在读反应前后量气管乙中液面的读数求其差值的过程中,应注意___(填字母编号)。
| A.冷却至室温 |
| B.等待片刻,待乙管中液面不再上升时立即读数 |
| C.读数时应移动右侧量气管,使甲乙两端液面相平 |
| D.视线与凹液面最低处相平 |
您最近一年使用:0次
解题方法
5 . 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4。回答下列问题:
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为___ 。
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为___ 。
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少___ ?
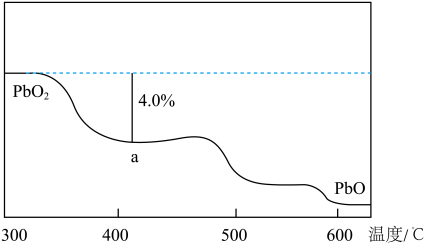
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%【(即样品起始质量—a点固体质量)/样品起始质量×100%】的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值___ 、___ 。
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%【(即样品起始质量—a点固体质量)/样品起始质量×100%】的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值

您最近一年使用:0次
解题方法
6 . 硫酸是一种重要的化工原料。接触法生产的硫酸产品有98%的硫酸、20%的发烟硫酸(H2SO4和SO3的混合物,其中SO3的质量分数为0.2)。
完成下列计算:
(1)若不计生产过程的损耗,__________ m3 SO2(折合成标准状况)经充分转化、吸收,可产出1吨 98%的硫酸(密度为1.84g/mL)。若98%的硫酸可表示为SO3• H2O,20%的发烟硫酸可表示为SO3•aH2O,则a的值为
H2O,20%的发烟硫酸可表示为SO3•aH2O,则a的值为 ___________ (用分数表示)。
(2)铝和铝的化合物在社会生产和人类生活中也有着重要的作用。现有甲、乙两瓶无色溶液,已知它们可能是Na[Al(OH)4]溶液和H2SO4溶液。现经实验获得如下数据:
(已知:2Na[Al(OH)4]+H2SO4→2Al(OH)3↓+Na2SO4+2H2O)
请通过必要的计算推断过程回答:乙溶液中的溶质是什么________ ?其物质的量浓度为多少________ ?
完成下列计算:
(1)若不计生产过程的损耗,
 H2O,20%的发烟硫酸可表示为SO3•aH2O,则a的值为
H2O,20%的发烟硫酸可表示为SO3•aH2O,则a的值为 (2)铝和铝的化合物在社会生产和人类生活中也有着重要的作用。现有甲、乙两瓶无色溶液,已知它们可能是Na[Al(OH)4]溶液和H2SO4溶液。现经实验获得如下数据:
(已知:2Na[Al(OH)4]+H2SO4→2Al(OH)3↓+Na2SO4+2H2O)
| 组别 | 甲(mL) | 乙(mL) | 沉淀的物质的量(mol) |
| ① | 140 | 10 | 0.02 |
| ② | 10 | 140 | 0.02 |
| ③ | 20 | 560 | 0.04 |
请通过必要的计算推断过程回答:乙溶液中的溶质是什么
您最近一年使用:0次
2010·上海普陀·二模
7 . 钾元素可以与氧元素在不同条件下生成K2O2、KO2和KO3,如:
(1)KOH与O3反应,反应前后气体体积减小67.2L(S.T.P.),则生成KO3__________ g。
(2)将上述生成的混和物用液氨冷却结晶,可得到KO3晶体。它会缓慢分解为KO2和O2; .已知分解后残留固体中含氧的质量分数为0.5063,则KO3的分解百分率为
.已知分解后残留固体中含氧的质量分数为0.5063,则KO3的分解百分率为_____ 。(保留两位小数)
(3)已知某样品中含有K2O2、KO2和KO3中的两种,把71.1g该样品加入过量的Al2(SO4)3溶液中,产生白色沉淀23.4g。
①该样品中钾原子与氧原子个数的最简整数比为_______ 。(写出计算过程)
②写出可能存在的组合中两种化合物的物质的量之比_________ 。
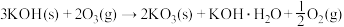
(1)KOH与O3反应,反应前后气体体积减小67.2L(S.T.P.),则生成KO3
(2)将上述生成的混和物用液氨冷却结晶,可得到KO3晶体。它会缓慢分解为KO2和O2;
 .已知分解后残留固体中含氧的质量分数为0.5063,则KO3的分解百分率为
.已知分解后残留固体中含氧的质量分数为0.5063,则KO3的分解百分率为(3)已知某样品中含有K2O2、KO2和KO3中的两种,把71.1g该样品加入过量的Al2(SO4)3溶液中,产生白色沉淀23.4g。
①该样品中钾原子与氧原子个数的最简整数比为
②写出可能存在的组合中两种化合物的物质的量之比
您最近一年使用:0次
2014·上海杨浦·三模
8 . 氯、磷的化合物广泛用于农药、医药、染料等领域。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1mol的H2O完全反应会生成2mol的HCl,则X的组成元素是___ ;已知X的相对分子质量为153.5,则X的化学式为___ 。
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07gX与448mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2___ mol,气体的体积将变为___ mL。
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.480g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.550g,计算产物中PCl3的质量分数___ (保留4位有效数字)。
(4)PCl3和PCl5能发生如下水解反应:PCl3+3H2O→H3PO3+3HCl;PCl5+4H2O→H3PO4+5HCl
现将一定量的PCl3和PCl5混合物溶于足量水中,在加热条件下缓缓通入0.020molO2,恰好将H3PO3氧化为H3PO4。往反应后的溶液中加入15.725gCa(OH)2,充分反应后磷元素全部转化为Ca3(PO4)2沉淀,过滤后得到2.5L滤液,测得pH为12。计算:
①Ca3(PO4)2(已知式量310)沉淀的质量___ ;
②滤液中溶质的物质的量浓度___ 。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1mol的H2O完全反应会生成2mol的HCl,则X的组成元素是
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07gX与448mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.480g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.550g,计算产物中PCl3的质量分数
(4)PCl3和PCl5能发生如下水解反应:PCl3+3H2O→H3PO3+3HCl;PCl5+4H2O→H3PO4+5HCl
现将一定量的PCl3和PCl5混合物溶于足量水中,在加热条件下缓缓通入0.020molO2,恰好将H3PO3氧化为H3PO4。往反应后的溶液中加入15.725gCa(OH)2,充分反应后磷元素全部转化为Ca3(PO4)2沉淀,过滤后得到2.5L滤液,测得pH为12。计算:
①Ca3(PO4)2(已知式量310)沉淀的质量
②滤液中溶质的物质的量浓度
您最近一年使用:0次
9 . (l)将2.78gFeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如下图所示.
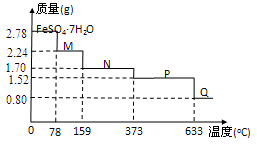
①100℃时,M的化学式为_______________
②FeSO4·H2O存在的最高温度为_______________
③380℃的P加热至650℃时反应的气体产物通入BaCl2溶液中,生成的沉淀的化学式为逸出的气体为,若通入Ba(NO3)2稀溶液中.逸出的气体则为.
(2)称取含有KBrO3、KBr 及惰性物质试样10.00g,溶解定容于100ml容量瓶中。移取25 .00ml 试液,在H2SO4介质中以Na2SO3还原BrO3-至Br-,调至中性,用0.10mol/LAgNO3滴定至终点,用去70.00ml。另取25.00ml试液,用硫酸酸化后,加热赶去Br2,再调至中性,滴定剩余的Br-,用去上述AgNO3的标准溶液10.00ml。
(已知KBrO3、KBr的摩尔质量分别为167.0g/mol,119.0g/mol)
①加入Na2SO3后发生反应的离子方程式为:;
②计算试样中KBr的质量分数为:(保留两位小数)

①100℃时,M的化学式为_______________
②FeSO4·H2O存在的最高温度为_______________
③380℃的P加热至650℃时反应的气体产物通入BaCl2溶液中,生成的沉淀的化学式为逸出的气体为,若通入Ba(NO3)2稀溶液中.逸出的气体则为.
(2)称取含有KBrO3、KBr 及惰性物质试样10.00g,溶解定容于100ml容量瓶中。移取25 .00ml 试液,在H2SO4介质中以Na2SO3还原BrO3-至Br-,调至中性,用0.10mol/LAgNO3滴定至终点,用去70.00ml。另取25.00ml试液,用硫酸酸化后,加热赶去Br2,再调至中性,滴定剩余的Br-,用去上述AgNO3的标准溶液10.00ml。
(已知KBrO3、KBr的摩尔质量分别为167.0g/mol,119.0g/mol)
①加入Na2SO3后发生反应的离子方程式为:;
②计算试样中KBr的质量分数为:(保留两位小数)
您最近一年使用:0次
解题方法
10 . 碳酸钠有两种化合物,碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3),其中碳酸钠最为重要,在工业上有广泛的应用。在生活中,碳酸氢钠是常用的发酵剂的主要成分。完成下列计算:
(1)某天然碱的化学组成可能为aNa2CO3・bNaHCO3・cH2O(a、b、c为正整数),为了确定其成分:称取天然碱样品7.3g,充分加热后得到水的质量为0.9g,二氧化碳的质量为1.1g。该天然碱的化学式为____________ 。
(2)为了测定某发酵剂样品中碳酸氢钠的含量,取样品n克,充分灼烧以后,称的残留固体质量为m克(假设其他成分不分解)。则样品中碳酸氢钠的质量:_________ (填含n、m的计算式)。
(3)已知酸性强弱顺序为:H2CO3 > HCO3- > HX。取由0.4molNaX、0.2molNa2CO3和0.1molNaHCO3组成的混合物,溶于200mL水中,往所得溶液中通入一定量的CO2气体,反应明显分两步,完成下列表格。
(1)某天然碱的化学组成可能为aNa2CO3・bNaHCO3・cH2O(a、b、c为正整数),为了确定其成分:称取天然碱样品7.3g,充分加热后得到水的质量为0.9g,二氧化碳的质量为1.1g。该天然碱的化学式为
(2)为了测定某发酵剂样品中碳酸氢钠的含量,取样品n克,充分灼烧以后,称的残留固体质量为m克(假设其他成分不分解)。则样品中碳酸氢钠的质量:
(3)已知酸性强弱顺序为:H2CO3 > HCO3- > HX。取由0.4molNaX、0.2molNa2CO3和0.1molNaHCO3组成的混合物,溶于200mL水中,往所得溶液中通入一定量的CO2气体,反应明显分两步,完成下列表格。
| CO2(mol) | 0.05 | 0.15 | 0.6 |
| NaX(mol) | |||
| Na2CO3(mol) | |||
| NaHCO3(mol) |
您最近一年使用:0次



