解题方法
1 . 工业上常以铝土矿为原料来冶炼金属铝。已知:铝土矿的主要成分是 (其中含有
(其中含有 、
、 等杂质)。为检测某铝土矿样品中
等杂质)。为检测某铝土矿样品中 的含量,进行如下实验过程:
的含量,进行如下实验过程:
①取矿样10.0g加入过量稀盐酸溶解,过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.0mL逐滴加入 的NaOH溶液。得到如右图所示的变化关系。
的NaOH溶液。得到如右图所示的变化关系。___________ 。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为___________ ,其物质的量为___________ 。
(3)该铝土矿样中 的质量分数为
的质量分数为___________ 。
 (其中含有
(其中含有 、
、 等杂质)。为检测某铝土矿样品中
等杂质)。为检测某铝土矿样品中 的含量,进行如下实验过程:
的含量,进行如下实验过程:①取矿样10.0g加入过量稀盐酸溶解,过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.0mL逐滴加入
 的NaOH溶液。得到如右图所示的变化关系。
的NaOH溶液。得到如右图所示的变化关系。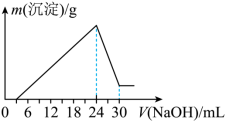
(2)最后所得不溶于NaOH溶液的沉淀的化学式为
(3)该铝土矿样中
 的质量分数为
的质量分数为
您最近一年使用:0次
2 . 化学兴趣小组为测定某大理石样品中CaCO3的含量,进行如下实验:取18.0g样品置于烧杯中,向其中加入质量分数为5%的稀盐酸(样品中杂质不与盐酸反应),测得生成气体的质量与加入盐酸的质量关系如图所示,请回答下列问题。
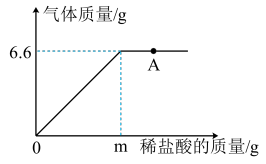
(1)实验室现有质量分数为30%的盐酸50.0g,最多可配制质量分数为5%的盐酸___________ g。
(2)图中“A”点的溶质是___________ (填化学式)。
(3)计算该样品中CaCO3的质量分数。_________ (写出计算过程,结果精确到0.1%)

(1)实验室现有质量分数为30%的盐酸50.0g,最多可配制质量分数为5%的盐酸
(2)图中“A”点的溶质是
(3)计算该样品中CaCO3的质量分数。
您最近一年使用:0次
2023高三·全国·专题练习
3 . 某实验小组以 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:
步骤2,产品中 的含量测定
的含量测定
①称取产品 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的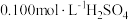 溶液,
溶液,
③沉淀完全后, 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为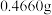 。
。
产品中 的质量分数为
的质量分数为_______ (保留三位有效数字)。
 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:步骤2,产品中
 的含量测定
的含量测定①称取产品
 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;②在不断搅拌下,向①所得溶液逐滴加入热的
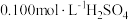 溶液,
溶液,③沉淀完全后,
 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为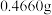 。
。产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
4 . 若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2.样品中CuSO4·5H2O的质量分数为_______ (列出算式可能用到的化学式量:CuSO4 160、CuSO4·5H2O 250、Cu(NO3)2·3H2O 242、BaSO4 233)。
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
5 . 完成下列问题
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值_______ (列出计算过程)。
(2)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+,写出计算CuSO4·5H2O质量分数的表达式ω=_______ 。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值
(2)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+,写出计算CuSO4·5H2O质量分数的表达式ω=
您最近一年使用:0次
解题方法
6 . SO2在生产生活中有重要的应用,处理不当会造成环境污染。回答下列问题:
(1)标准状况下16.0gSO2的体积为______ L,与______ molH2O中所含氧原子数相等。
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。
①该反应中被还原的元素是_____ 。
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为______ 。
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为______ g•m-3(用含a的表达式表示,假定样品中其它气体均不参与反应,SO2可被溶液充分吸收)。
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_____ ;需用量筒量取密度为1.84g•cm-3,质量分数为98%的浓硫酸_____ mL;若定容时俯视刻度线,则所配溶液的浓度______ (填“偏高”、“偏低”或“不变”)。
(1)标准状况下16.0gSO2的体积为
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO
 +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。①该反应中被还原的元素是
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
您最近一年使用:0次
21-22高一·全国·假期作业
7 . 回收得到的SeO2的含量,可以通过下面的方法测定:①SeO2+KI+HNO3→Se+I2+KNO3+H2O(未配平)②I2+Na2S2O3→Na2S4O6+NaI(未配平)实验中,准确称量SeO2样品0.1500g,消耗0.2000mol·L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为____ 。
您最近一年使用:0次
2022高三·全国·专题练习
8 . 测定晶体中KSCN的含量:称取10.0g样品,配成1000mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴 溶液作指示剂,用
溶液作指示剂,用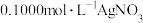 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 ,标准溶液20.00mL。
,标准溶液20.00mL。
(1)滴定时发生的反应: (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是___________ 。
(2)晶体中KSCN的质量分数为___________ (计算结果精确至0.1%)。
 溶液作指示剂,用
溶液作指示剂,用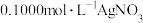 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 ,标准溶液20.00mL。
,标准溶液20.00mL。(1)滴定时发生的反应:
 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是(2)晶体中KSCN的质量分数为
您最近一年使用:0次
2022高三·全国·专题练习
9 . 设计如下实验测定NaCl产品中SO 的含量,填写下列表格。
的含量,填写下列表格。
 的含量,填写下列表格。
的含量,填写下列表格。| 操作 | 现象 | 目的/结论 | |
| ① | 称取样品m1g,加水溶解,加盐酸调至弱酸性,滴加过量c1mol·L-1BaCl2溶液V1mL | 稍显浑浊 | 目的: |
| ② | 继续滴加过量c2mol·L-1K2CrO4溶液V2mL | 产生黄色沉淀 | 目的:沉淀过量的Ba2+。 |
| ③ | 过滤洗涤,滴加少许指示剂于滤液中,用c3mol·L-1FeSO4溶液滴定至终点,消耗FeSO4溶液V3mL | 结论:SO 的质量分数为 的质量分数为 |
您最近一年使用:0次
2022高三·全国·专题练习
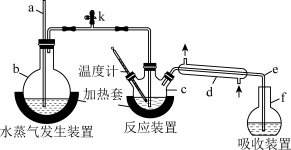
10 . 为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验。利用高氯酸(高沸点酸)将mg样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再进行酸碱滴定来测定含量。实验装置如图所示。
定量测定:将f中得到的馏出液配成 溶液,取其中
溶液,取其中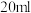 加入
加入
 溶液,得到
溶液,得到 沉淀(不考虑其他沉淀的生成),再用
沉淀(不考虑其他沉淀的生成),再用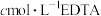 标准溶液滴定剩余
标准溶液滴定剩余 (
( 与
与 按
按 配合),消耗
配合),消耗 标准溶液
标准溶液 ,则氟化稀土样品中氟的质量分数为
,则氟化稀土样品中氟的质量分数为___ 。

定量测定:将f中得到的馏出液配成
 溶液,取其中
溶液,取其中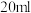 加入
加入
 溶液,得到
溶液,得到 沉淀(不考虑其他沉淀的生成),再用
沉淀(不考虑其他沉淀的生成),再用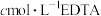 标准溶液滴定剩余
标准溶液滴定剩余 (
( 与
与 按
按 配合),消耗
配合),消耗 标准溶液
标准溶液 ,则氟化稀土样品中氟的质量分数为
,则氟化稀土样品中氟的质量分数为
您最近一年使用:0次



